Przeczytaj
Właściwości fizyczne chloru
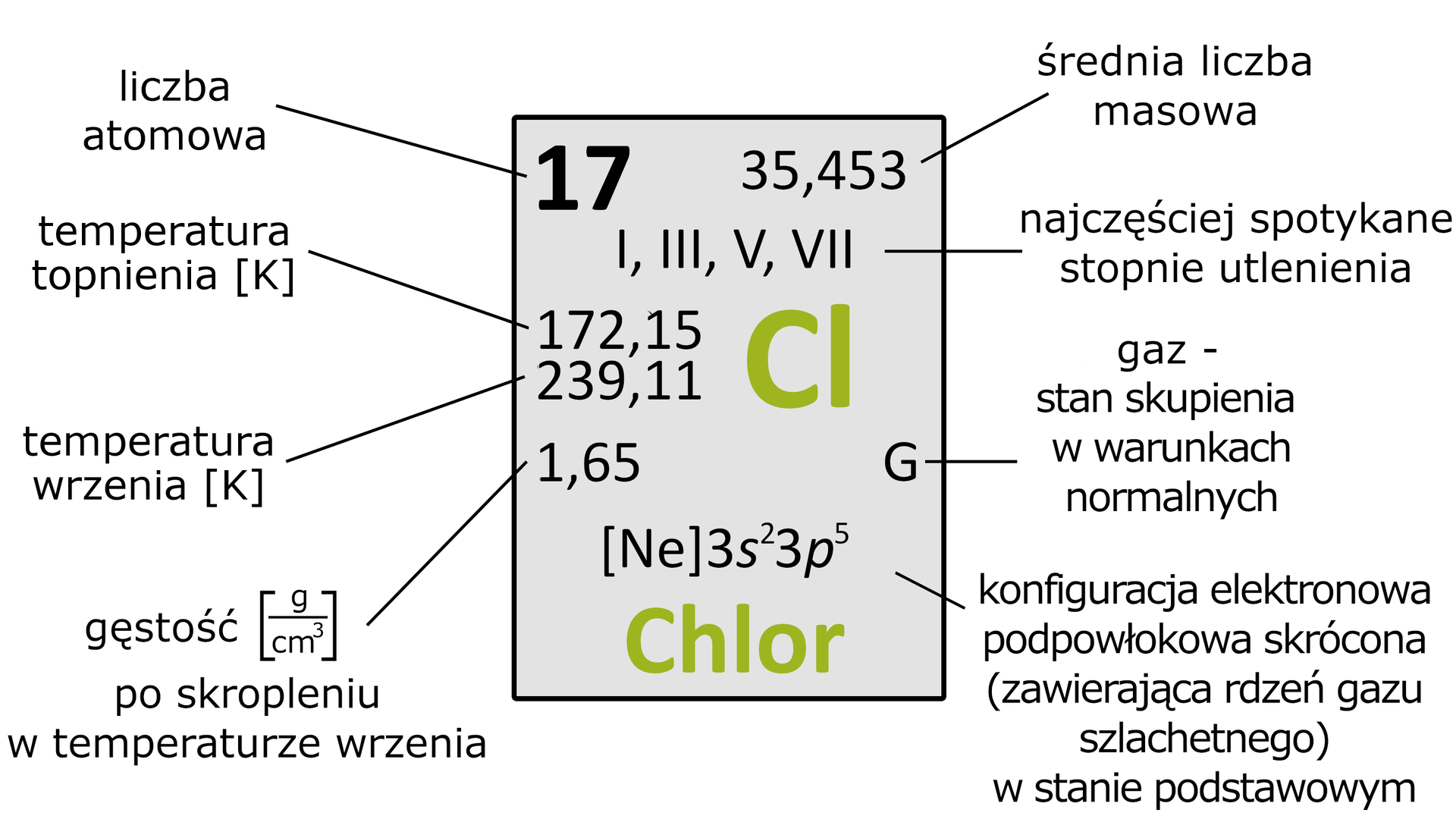
Przeanalizuj dane z tabeli i określ, w jakim stanie skupienia występuje chlor w warunkach normalnych.
chlorowiec | temperatura topnienia | temperatura wrzenia | promień jonowy [] | promień kowalencyjny [] |
|---|---|---|---|---|
Chlor | ||||
Brom | ||||
Jod |
Chlor jest gazem o barwie zielonożółtej, cięższym od powietrza. Charakteryzuje się ostrym, intensywnym zapachem i jest wyczuwalny w powietrzu przy stężeniu . Chlor rozpuszcza się w wodzie, tworząc tzw. wodę chlorową. Rozpuszczalność chloru w wodzie zależy od temperatury. W wody o temperaturze rozpuszcza się chloru (odmierzonego w warunkach normalnych). Chlor w reakcji z wodą ulega dysproporcjonowaniu na chlorowodór
() i kwas chlorowy() ().
Właściwości chemiczne chloru
Dlaczego atomy chloru łączą się, tworząc cząsteczki dwuatomowe? Jaki wpływ na konfigurację każdego z atomów chloru, tworzących cząsteczkę , ma uwspólnienie dodatkowego elektronu?
Chlor jest aktywnym chemicznie niemetalem, który w związkach może występować na , , , i stopniu utlenienia. Łączy się on bezpośrednio z większością pierwiastków. Z metalami tworzy sole – chlorki. Jest silnym utleniaczem, co sprawia, że w odpowiednich warunkach może utleniać wiele metali, w tym również metale szlachetne:
Metale, takie jak np. żelazo, utlenia do wyższych stopni utlenienia niż :
W przyrodzie najpopularniejszymi związkami chloru są:
W obecności światła łączy się z wodorem, tworząc chlorowodór:
Chlorowodór jest głównie otrzymywany przez działanie stężonych roztworów mocnych kwasów, np. kwasu siarkowego() na chlorki, np. chlorek sodu:
Od tej reakcji wywodzi się nazwa zwyczajowa kwasu chlorowodorowego – kwas solny, bo wypierany jest z soli kuchennej.
W reakcji z wodą tworzy mocny kwas chlorowodorowy:
Tlenki chloru są związkami generalnie nietrwałymi. Wszystkie mają charakter kwasowy.
stopień utlenienia chloru | wzór tlenku | wzór strukturalny tlenku | wzór kwasu tlenowego | wzór strukturalny kwasu | nazwa kwasu | wzrost mocy kwasów | wzrost właściwości utleniających |
|---|---|---|---|---|---|---|---|
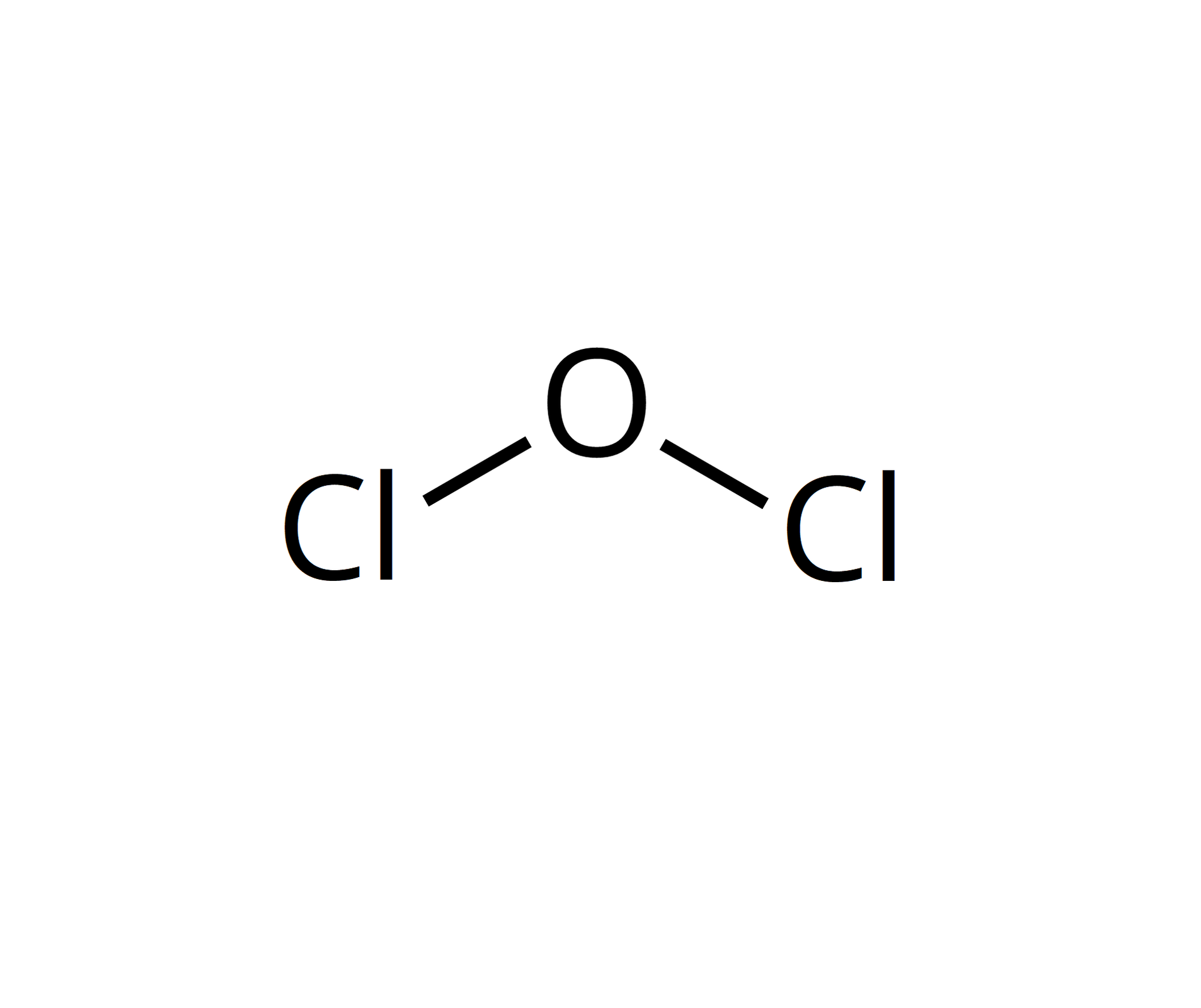 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 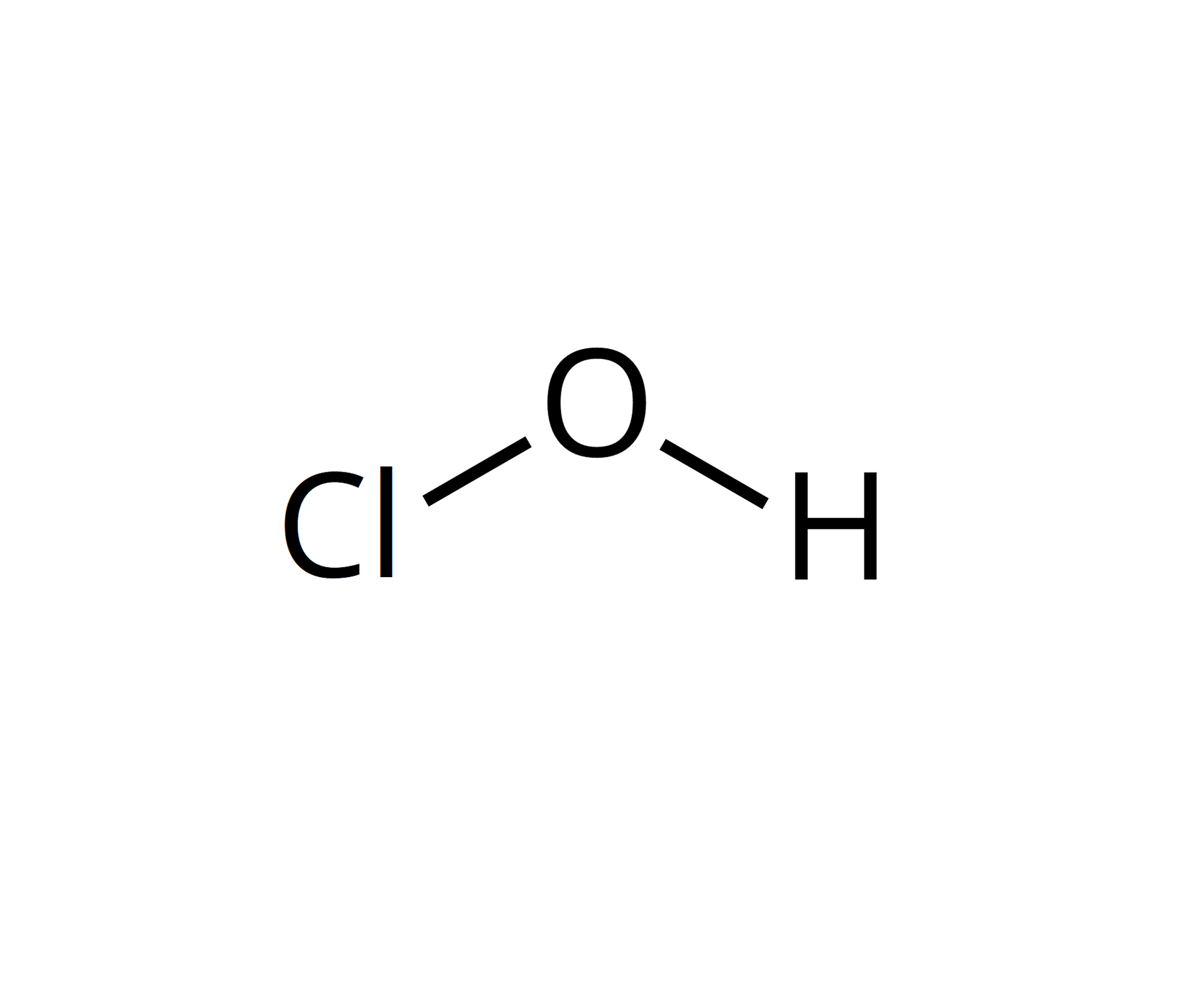 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas chlorowy |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 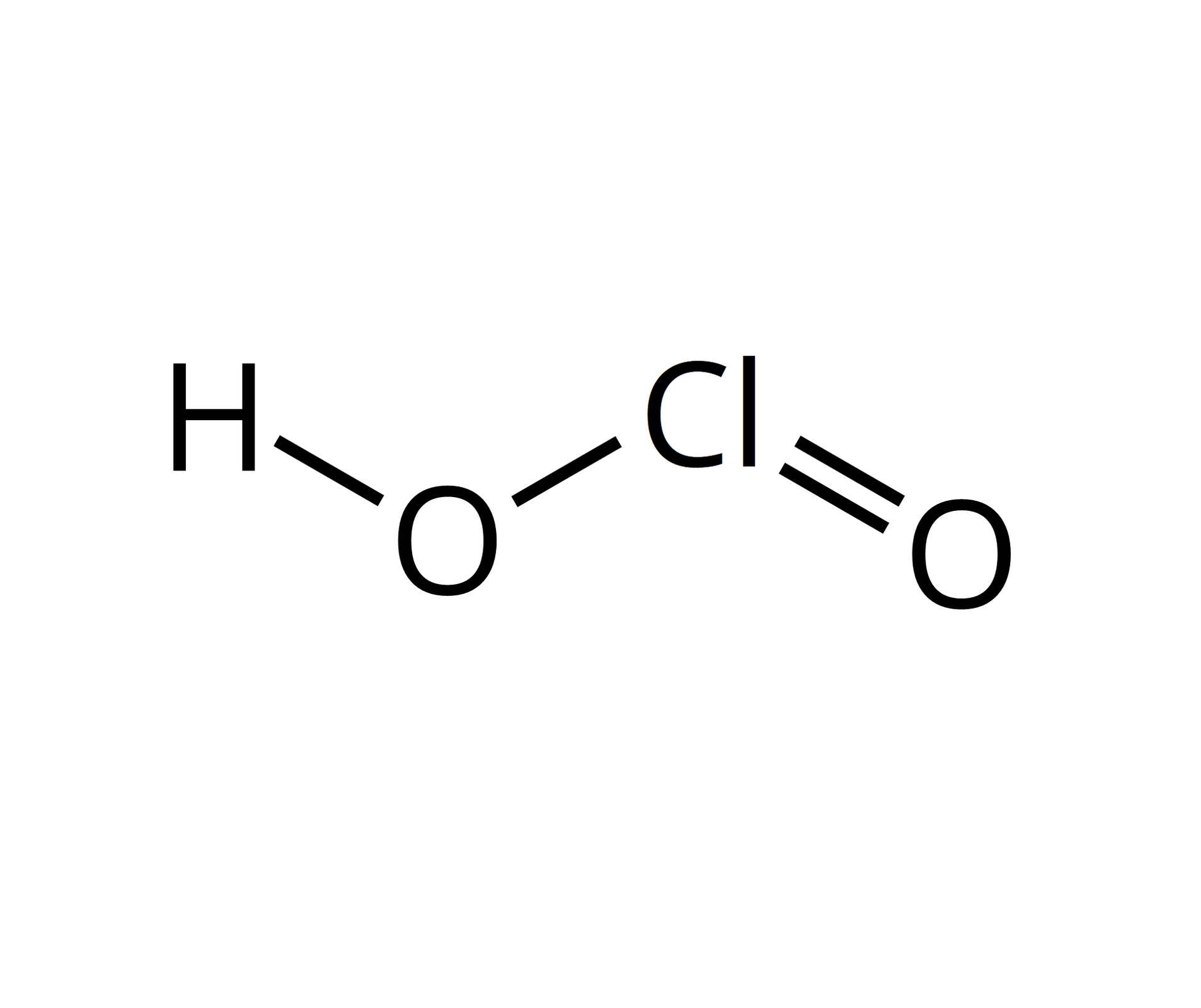 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas chlorowy | |||||
– | – | 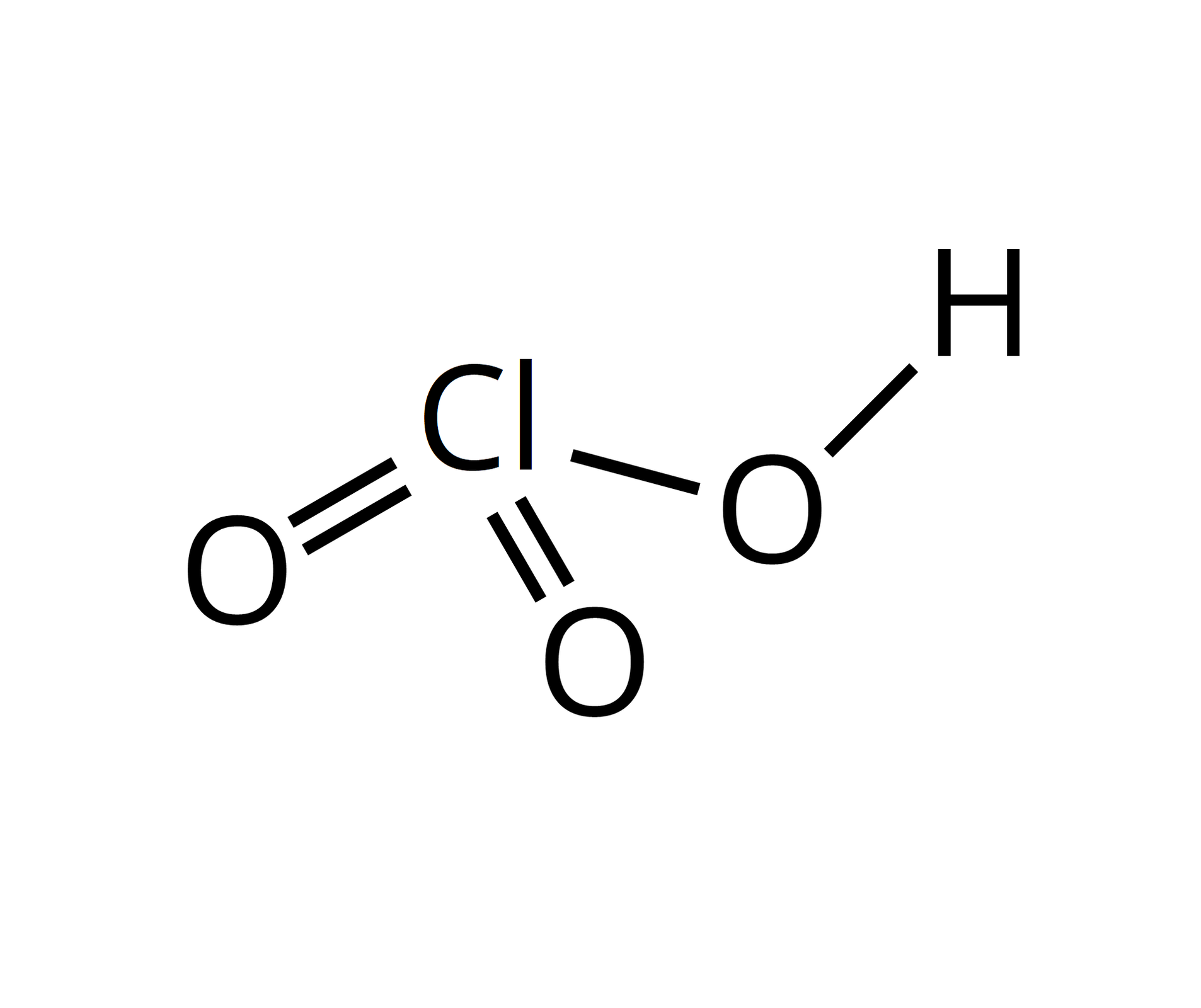 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas chlorowy | ||||
 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kwas chlorowy |
Istnieją jeszcze dwa tlenki chloru: tlenek chloru(,) oraz tlenek
chloru(,) . Mówi się także o hipotetycznym istnieniu tlenku chloru o wzorze .
Najmocniejszym kwasem tlenowymkwasem tlenowym chloru jest kwas chlorowy(). To wyjątkowo silny utleniacz. Jego sole – chlorany(), są substancjami o silnych właściwościach utleniających, a ich ucieranie w możdzierzu może wywołać reakcję wybuchową z tlenem.
Chlorany maja właściwości utleniające, np.:
To właśnie powstawanie aktywnego tlenu w reakcji rozkładu chloranu() decyduje o właściwościach wybielaczy zawierających chlor.
Słownik
(fr. oxygéne, dosłownie „kwasoród”, „tlen”) atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
(gr. ḗlektron „bursztyn”, lýsis „rozłożenie”) podstawowy proces elektrochemiczny polegający na chemicznej przemianie składników elektrolitu (a często i materiału elektrod), przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego
kwasy, których reszty kwasowe posiadają atomy tlenu
ang. parts per million, czyli liczba części na milion (), oznaczenie stosowane m.in. przy wyrażaniu stężeń
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Mizerski T., Tablice chemiczne, Warszawa 2008.
Orlińska I., Fluorowce i ich związki, „Chemia w szkole” 2010, nr 5, s. 19‑28.
Trzebiatowski W., Chemią nieorganiczna, Warszawa 1977, s. 146‑173.



