Przeczytaj
Badania nad tRNA i rybosomami
Proces biosyntezy białekbiosyntezy białek, w którym biorą udział tRNAtRNA oraz rybosomy, jest bardzo złożony i nie został jeszcze całkowicie poznany – do tej pory prowadzone są nad nim badania. Najdokładniej zanalizowano budowę oraz funkcje tRNA i rybosomów w komórkach prokariotycznychprokariotycznych, u bakterii Escherichia coli. Niewątpliwie u EukaryotaEukaryota tRNA i rybosomy cechują się większą złożonością. Co ciekawe jednak, w organellach półautonomicznychorganellach półautonomicznych komórek organizmów eukariotycznych rybosomy swoją strukturą bardziej przypominają te prokariotyczne.
Budowa i funkcje cząsteczki tRNA
Transportujący kwas rybonukleinowy, czyli tRNA, zwany inaczej przenoszącym lub przenośnikowym, jest samodzielnie występującą molekułą występującą w cytoplazmie komórek oraz w organellach półautonomicznychorganellach półautonomicznych. W cytoplazmie tRNA stanowi ok. 10 do 15% całkowitego RNA obecnego w komórkach. W porównaniu z innymi typami kwasów rybonukleinowych tRNA jest cząsteczką względnie małą, a jego masa cząsteczkowamasa cząsteczkowa wynosi średnio 25000 u.
W komórce tRNA spełnia dwie podstawowe funkcje, które są ściśle powiązane z procesem biosyntezy białekbiosyntezy białek:
rozpoznaje właściwy aminokwas na podstawie informacji zapisanej w kodzie genetycznym zawartym w mRNAmRNA, podczas interakcji tRNA oraz mRNA;
przenosi właściwy aminokwas do tworzonego łańcucha polipeptydowego, czyli białkowego.
W komórkach prokariotycznych występuje ok. 40 rodzajów tRNA, a w komórkach eukariotycznych – aż 60 rodzajów. Biorąc pod uwagę, że wyróżniamy 20 rodzajów aminokwasów, można wywnioskować, że istnieje kilka rodzajów tRNA transportujących taki sam aminokwas. Potwierdza to fakt, że kod genetyczny jest zdegenerowanyzdegenerowany – aminokwasy mogą być kodowane przez więcej niż jeden kodon.
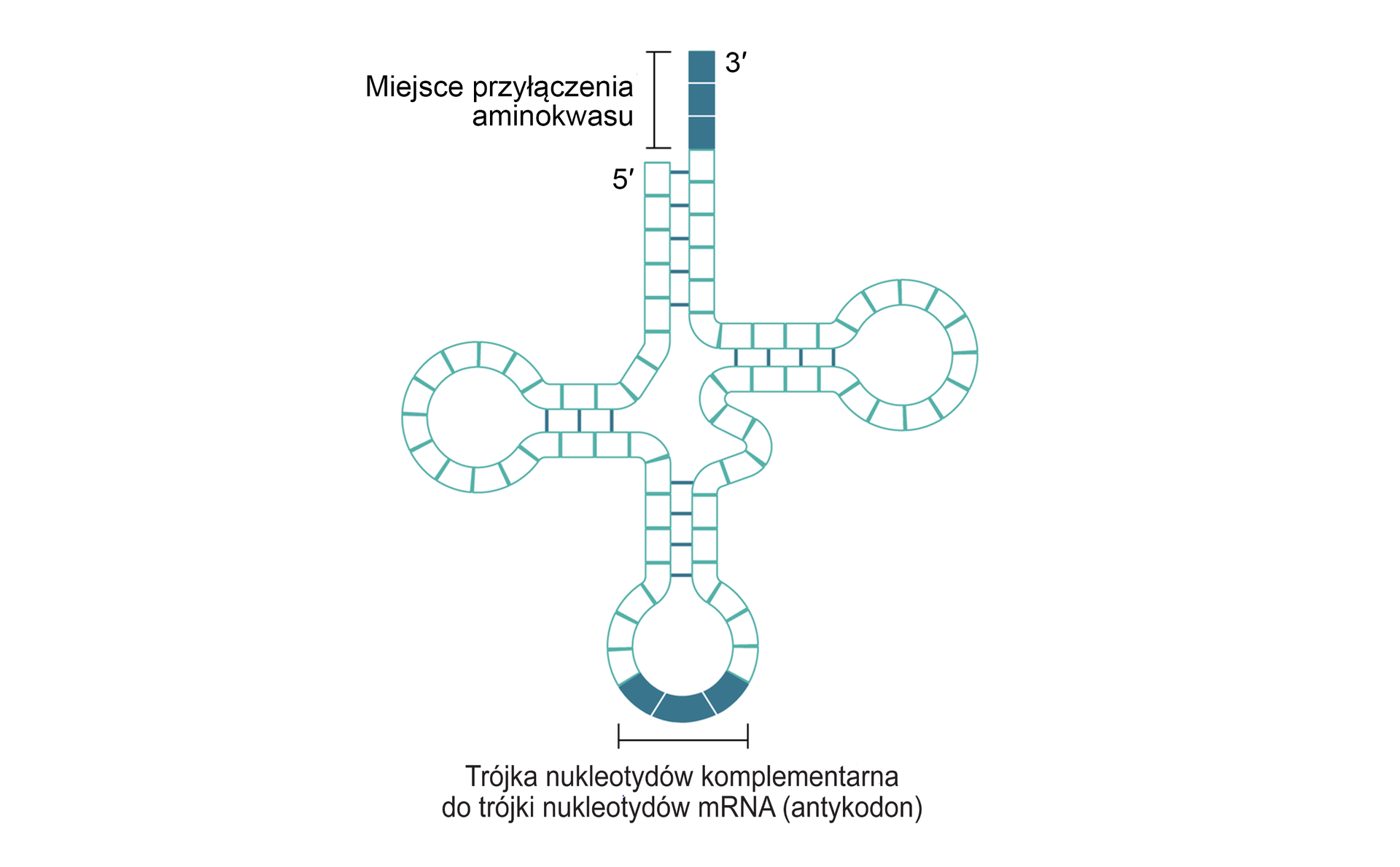
Cząsteczka tRNA zbudowana jest z nukleotydów (od 63 do 94), składających się z cukru rybozy, reszty fosforanowej oraz zasady azotowej. Zasady azotowe występujące w RNA to: adenina (A), guanina (G), cytozyna (C) oraz uracyl (U). Każdy rodzaj nukleotydu zawiera jedną zasadę azotową, czyli są cztery rodzaje nukleotydów. W tRNA występują także modyfikowane nukleotydy zawierające inne zasady azotowe: pseudouracyl w pętli Tpsic i dihydroksyuracyl w pętli D.
Struktura tRNA przypomina kształtem czterolistną koniczynę: cząsteczkę tworzą cztery pętle, z których każda pełni inne funkcje.
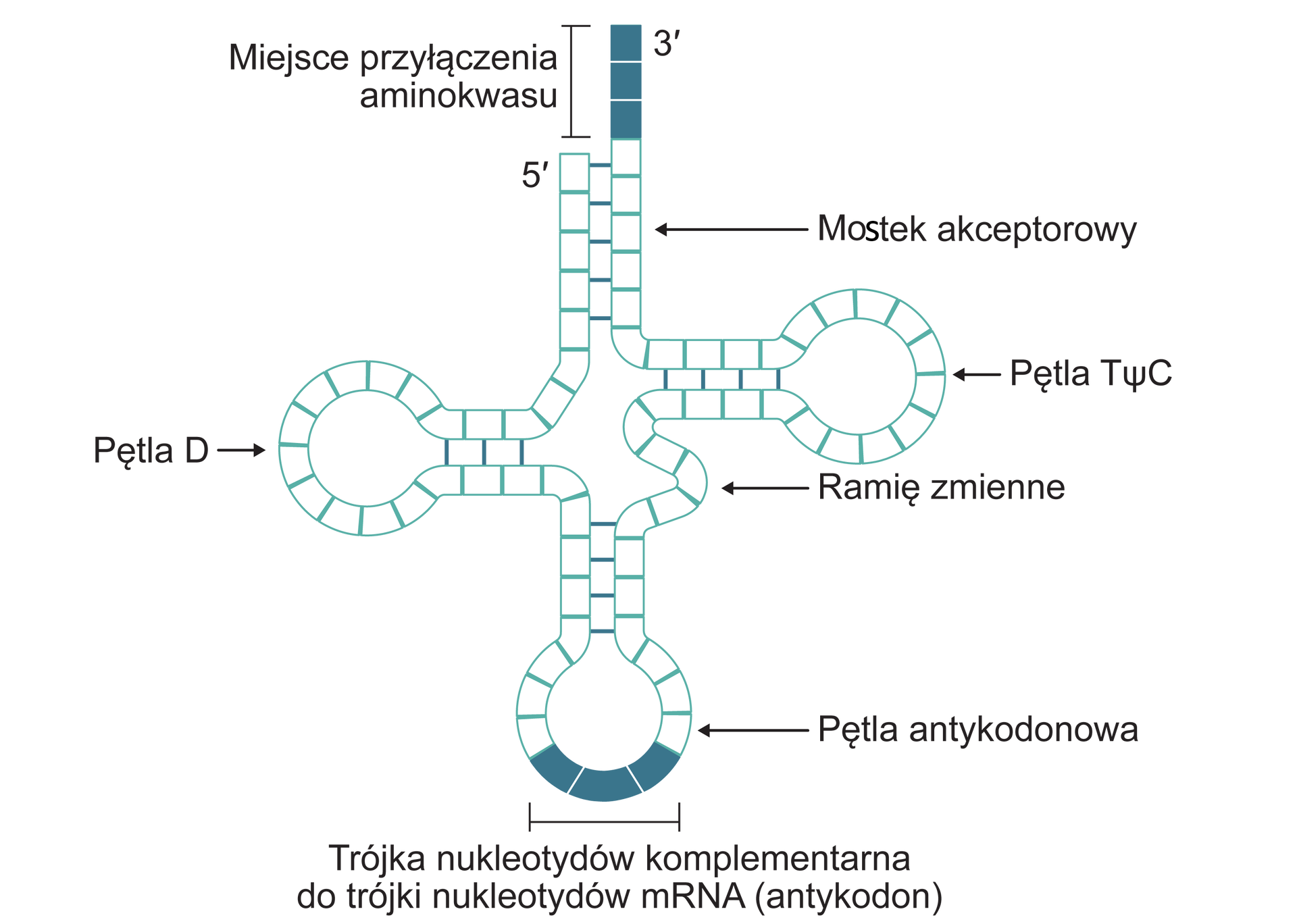
W podstawie cząsteczki tRNA występują dwa charakterystyczne końce stabilizowane sparowanymi nukleotydami. Jeden koniec, dłuższy, oznacza się jako 3′ (czytaj: trzy prim), a drugi, krótszy – jako 5′ (pięć prim). Razem oba końce tworzą tzw. ramię akceptorowe. Na końcu 5′ występuje zawsze nukleotyd guaninowy, a na końcu 3′ – trzy nukleotydy z zasadami: cytozyną, cytozyną i adeniną (CCA). To właśnie do nukleotydu adeninowego przyłącza się procesie aminoacylacji aminokwas, który następnie jest transportowany przez tRNA w przebiegu biosyntezy białkabiosyntezy białka.
Cząsteczka tRNA w kształcie koniczyny nosi nazwę struktury drugorzędowej tRNA. Struktura pierwszorzędowa tRNA to łańcuch nukleotydów połączonych wiązaniami kowalencyjnymiwiązaniami kowalencyjnymi pomiędzy resztami fosforanowymi oraz cukrami. Struktura trzeciorzędowa tRNA to struktura drugorzędowa dodatkowo zwinięta przestrzennie w kształt litery L – umożliwia to wpasowanie się tRNA w strukturę rybosomu.
Francis Crick zwrócił uwagę na fakt, że istnieje pewne odstępstwo od parowania zasad azotowych budujących nukleotydy w momencie przyłączania się do kodonu cząsteczki mRNA antykodonu cząsteczki tRNA podczas translacji. Niektóre z cząsteczek tRNA mogą rozpoznawać więcej niż jeden rodzaj kodonu w cząsteczce mRNA. Według reguły tolerancji, nazwanej tak przez Cricka, zasada azotowa nukleotydu znajdująca się w trzeciej pozycji kodonu może się łączyć z zasadą azotową nukleotydu znajdującego się w trzeciej pozycji antykodonu niezgodnie z regułą komplementarności, np. U może łączyć się z A, ale także z G. Dlatego też kodony mRNA kodujące te same aminokwasy różnią się nukleotydem w pozycji trzeciej. Pozycja pierwsza i druga kodonu są takie same.
Aminoacylo‑tRNA
Aminoacylo‑tRNAAminoacylo‑tRNA to tRNA, do którego został przyłączony aminokwas.

Proces przyłączenia się aminokwasu do tRNA nosi nazwę aminoacylacjiaminoacylacji. Polega na przyłączeniu aminokwasu do nukleotydu adeninowego przy końcu 3′ przez wiązanie kowalencyjne typu estrowegoestrowego.

Budowa i funkcje rybosomów
Rybosomy to cząstki rybonukleoproteinowe, które są centrami produkcji białek zarówno w komórkach prokariotycznych, jak i eukariotycznych. W komórce eukariotycznej rybosomy występują w postaci wolnej (w cytoplazmie) bądź są przyłączone do cystern lub kanałów siateczki śródplazmatycznej. Rybosomy wolne występują również w organellach półautonomicznych.
Pod względem chemicznym rybosomy zbudowane są z kwasu rRNArRNA (rybosomalnego RNA) oraz otaczających go białek rybosomalnych. Rybosomalny RNA ma złożoną strukturę przestrzenną zawierającą wiele krótkich fragmentów dwuniciowych sparowanych zgodnie z zasadą komplementarności. Pełni funkcję nie tylko budulcową – wchodząc w skład rybosomów jest rybozymem, który katalizuje powstawanie wiązań peptydowych – uczestniczy zatem w syntezie białek. Rybosomy mają lekko elipsoidalny kształt i średnie wymiary 20 × 30 nm. Zbudowane są z dwóch dopasowanych podjednostek: małej i dużej. Łączą się one w kompletny rybosom w obecności jonów magnezu (MgIndeks górny 2+2+), które są niezbędne do stabilizacji jego przestrzennej struktury – ich brak powoduje rozdzielenie podjednostek.
Liczebność rybosomów w komórkach jest ściśle uzależniona od intensywności procesu biosyntezy białekbiosyntezy białek. Na przykład rybosomy w komórkach bakterii Escherichia coli mogą stanowić do 30% jej masy, a w komórkach królika – do 50% masy komórki. W jednej komórce ssaków może znajdować się aż 10 mln rybosomów. W komórkach mocno aktywnych metabolicznie rybosomy najczęściej przyłączone są do siateczki śródplazmatycznej.
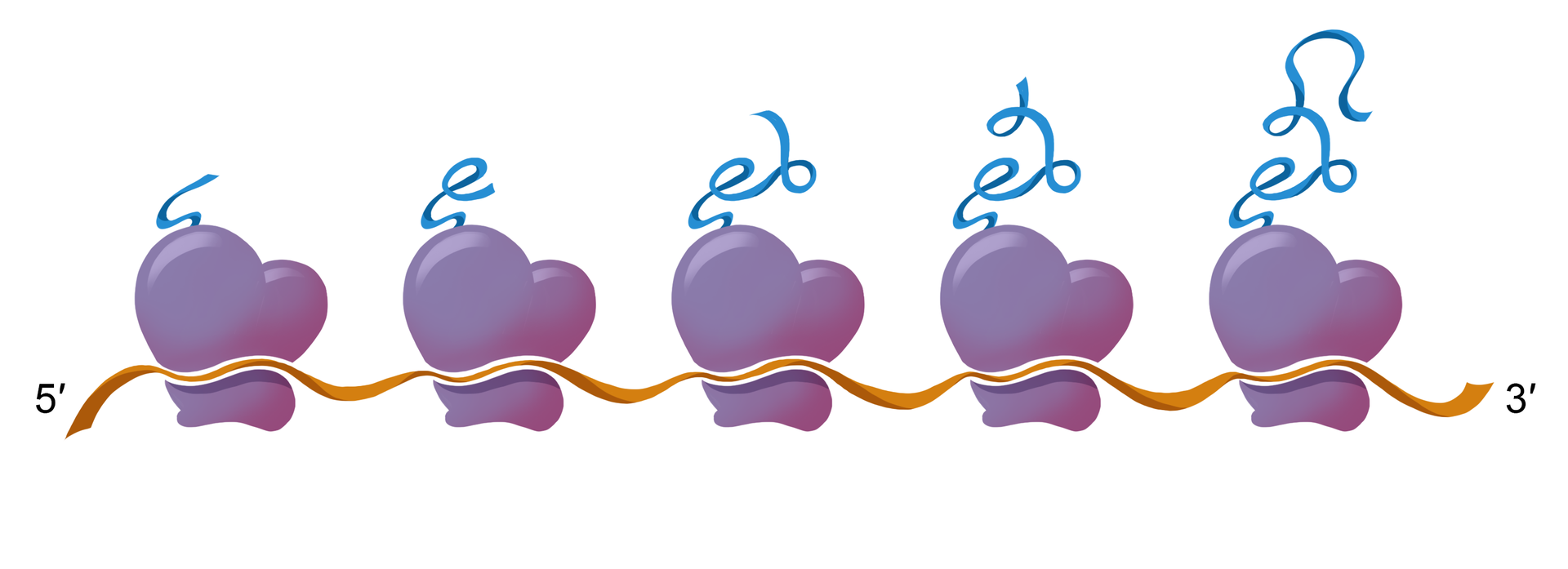
W dużej podjednostce rybosomu znajdują się trzy miejsca wiążące tRNA: miejsce P (peptydylowe lub donatorowe), miejsce A (akceptorowe) oraz miejsce E (wyjściowe). W miejscu A przyłącza się aminoacylo‑tRNA, który niesie pojedynczy aminokwas do tworzącego się łańcucha białkowego. W miejscu P przyłączony jest tzw. inicjatorowy tRNA oraz peptydylo‑tRNA – jest to miejsce wydłużania się (inaczej: elongacji) nowo tworzonego łańcucha polipeptydydowego. W miejscu E znajduje się tRNA, który oddał aminokwas i opuszcza strukturę rybosomu.
Rybosomy eukariotyczne a rybosomy prokariotyczne
Rybosomy organizmów prokariotycznych oraz eukariotycznych różnią się od siebie, mają też jednak cechy wspólne, takie jak: występowanie dwóch podjednostek, elipsoidalny kształt oraz obecność przerwy między podjednostkami, w którą wpasowuje się mRNA. Cechy różniące oba typy rybosomów to: wymiar całkowity rybosomów, rozmiar podjednostek, typ białek i rRNA budujących rybosomy oraz stosunek ilościowy RNA i białek.
Cecha | Rybosom prokariotyczny | Rybosom eukariotyczny |
|---|---|---|
Typ rRNA (współczynnik sedymentacji Swspółczynnik sedymentacji S) | 5 S, 16 S, 23 S | 5 S, 5,8 S, 18 S, 28 S |
Stosunek RNA : białko | 2 : 1 | 1 : 1 |
Współczynnik sedymentacji SWspółczynnik sedymentacji S kompletnego rybosomu | 70 S | 80 S |
Współczynnik sedymentacji S podjednostek rybosomów | mała: 30 S | mała: 40 S |
Średnica | 21–29 nm | 22–32 nm |
Słownik
proces, w którym aminokwas zostaje przyłączony do tRNA; reakcja ta jest katalizowana przez enzymy syntetazy i wymaga użycia energii w postaci ATP
tRNA zawierający aminokwas przyłączony w procesie aminoacylacji
proces polegający na wytworzeniu cząsteczki łańcucha polipeptydowego białka
organizmy w większości wielokomórkowe, zbudowane z komórek zawierających jądro komórkowe
masa cząsteczki wyrażona w atomowych jednostkach masy (u); masa cząsteczkowa jako wielkość bezwymiarowa to wielokrotność masy atomu izotopu węgla Indeks górny 1212C; w układzie SI jednostką masy cząsteczkowej jest 1 kg
matrycowy kwas rybonukleinowy; w procesie translacji stanowi matrycę zawierającą informację o sekwencji aminokwasów w białku
mitochondria i plastydy; organelle te mają własne DNA oraz rybosomy i są zdolne do prowadzenia procesu biosyntezy białek niezależnie od jądra komórkowego
struktura złożona z jednej cząsteczki mRNA oraz wielu rybosomów; zespół ten przypomina nić z nanizanymi na nią koralikami; uczestniczy w syntezie polipeptydów
organizmy w większości jednokomórkowe, których komórka nie zawiera jądra komórkowego oraz organelli komórkowych typowych dla organizmów eukariotycznych
( ribosomal RNA) rybosomalny kwas rybonukleinowy, katalizuje syntezę białka
( transfer RNA) transportujący (transferowy); również: przenoszący lub przenośnikowy) kwas rybonukleinowy, pośredniczący w przyłączaniu kolejnych aminokwasów w procesie biosyntezy białka
polega na tym, że trzy leżące obok siebie nukleotydy tworzą kodon, który koduje określony aminokwas podczas biosyntezy białka
wiązanie kowalencyjne powstające między grupą hydroksylową (–OH) a grupą karboksylową (–COOH)
wiązanie chemiczne powstające przez uwspólnienie pary elektronów pochodzących od obu atomów tworzących to wiązanie
współczynnik określający szybkość poruszania się cząstek koloidalnych pod wpływem sił odśrodkowych
zasada mówiąca, że cytozyna (C) łączy się zawsze z guaniną (G) trzema wiązaniami wodorowymi, a adenina (A) łączy się dwoma wiązaniami wodorowymi z uracylem (U) w kwasie RNA, natomiast w kwasie DNA z tyminą (T)
polega na kodowaniu tego samego aminokwasu przez więcej niż jeden kodon; maksymalna liczba kombinacji trójek utworzona z czterech nukleotydów budujących kwasy nukleinowe wynosi 64 (4Indeks górny 33 = 64); aminokwasów budujących białka jest tylko 20, stąd większość aminokwasów kodowanych jest przez więcej niż jedną trójkę (jeden kodon); spośród 64 kodonów trzy kodony stanowią sygnał STOP dla procesu translacji, a 61 koduje aminokwasy