Przeczytaj
Utlenianie i redukcja zawsze „idą” ze sobą w parze
Z pewnością znane są Ci pojęcia utleniania i redukcji. Wiesz już zatem, że reakcja utleniania nigdy nie zachodzi bez udziału reakcji redukcji i odwrotnie. Należy przy tym pamiętać, że reakcje te zachodzą „w parze”. Zatem jeżeli jedno indywiduum chemicznej jest utlenianie, to drugie musi zostać zredukowane. Stąd ów termin – reakcja redoks.
Jak zatem przebiega reakcja typu redoks z udziałem cząsteczek organicznych?
Często zadawanym pytaniem, gdy rozpoczynamy przygodę z reakcjami redoks w chemii organicznej, jest: dlaczego proces, w którym atom pozyskuje elektrony, nazywa się redukcją? Przypominając sobie pojęcie stopnia utlenieniastopnia utlenienia, zauważymy, że „redukcjaredukcja” oznacza „dodawanie elektronów”, a „utlenianieutlenianie” oznacza „usuwanie elektronów”. Jeżeli przeanalizujemy stopnie utlenienia atomów w cząsteczkach organicznych, a najczęściej są to stopnie utlenienia atomów węgla, to można przewidzieć, czy mamy do czynienia z utlenianiem, czy redukcją.
Gdy stopień utlenienia staje się bardziej ujemny, to jest to reakcja redukcji (atom pobiera elektrony). Jeżeli jednak stopień utlenienia staje się bardziej dodatni, jest to reakcja utleniania (atom traci elektrony).
Gdy mówimy o reakcjach redoks w chemii organicznej, mamy do czynienia z zestawem bardzo rozpoznawalnych przekształceń grup funkcyjnych. Spójrzmy na przykłady zamieszczone poniżej, zwracając uwagę na zmianę stopnia utlenienia atomu węgla. Porównując liczbę wiązań typu węgiel‑wodór, możemy uporządkować znane grupy funkcyjne wg zmian stopnia utlenienia.
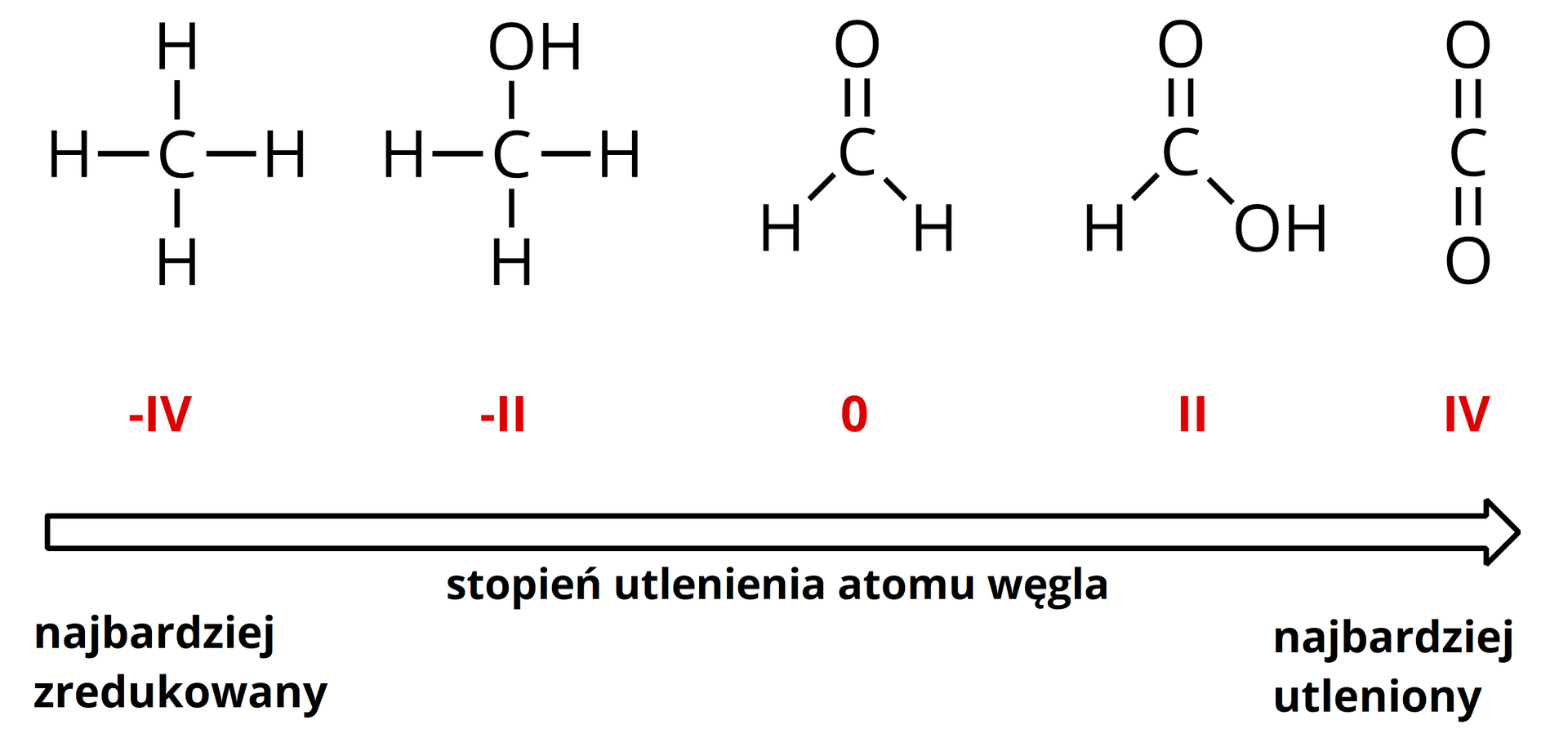
Z powyższego rysunku wynika, że najbardziej zredukowanym atomem węgla jest ten w cząsteczce metanu o wzorze . Jeżeli zaczniemy przesuwać się od strony lewej do prawej, to zauważymy, że stopień utlenienia atomu węgla wzrasta.
Typowe utleniacze i reduktory
Poniżej przedstawiono przykłady najbardziej popularnych utleniaczyutleniaczy i reduktorówreduktorów, używanych w reakcjach redoks z udziałem związków organicznych.
uleniacze | reduktory |
- dichromian(VI) potasu lub sodu | - wodór |
- tetrahydroglinian litu | |
- manganian(VII) potasu | - borowodorek sodu |
- ozon | |
- tlenek chromu(VI) | |
- chlor |
Utleniacze będą stosowane wtedy, gdy będziemy chcieli podwyższyć stopień utlenienia atomu węgla w związku organicznym. Natomiast reduktory, gdy zajdzie konieczność obniżenia stopnia utlenienia atomu węgla.
Manganian(VII) potasu
1. Utlenianie alkenów
Manganian(VII) potasu może utleniać alkeny:
w środowisku kwasowym dochodzi do całkowitego rozerwania wiązania z wytworzeniem dwóch produktów, których budowa zależy od budowy wyjściowego alkenu:
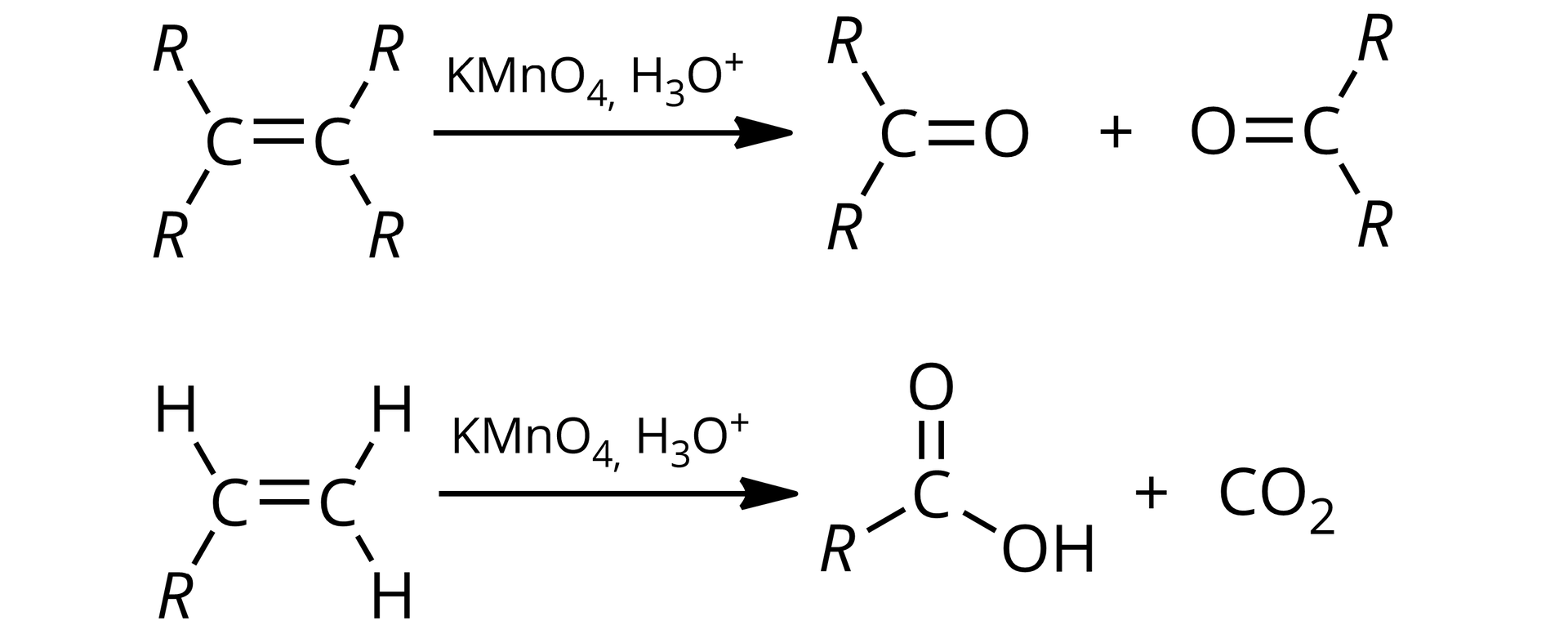
R – podstawniki węglowodorowe, alifatyczne
w środowisku obojętnym pęka tylko jedno z dwóch wiązań pomiędzy atomami węgla, pierwotnie związanymi wiązaniem podwójnym – powstają diole, czyli alkohole posiadające dwie grupy :
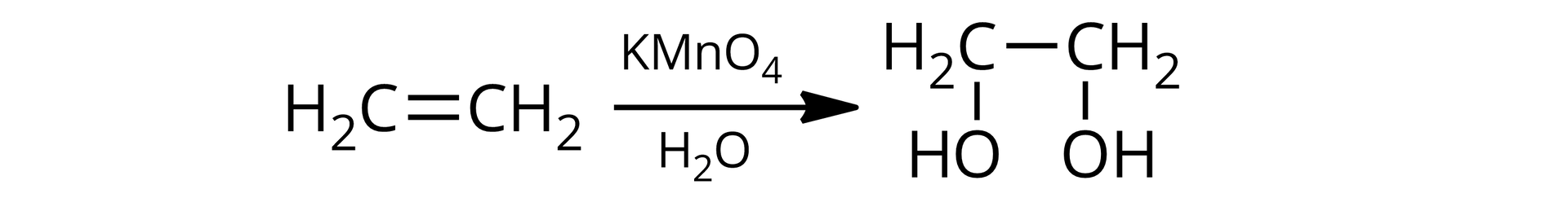
W odpowiednich warunkach diole mogą ulegać dalszemu utlenieniu.
2. Utlenianie alkoholi
Alkohole w obecności zakwaszonego roztworu manganianu(VII) potasu mogą ulegać utlenieniu do kwasów karboksylowych:
Utlenianie etanolu przy pomocy w środowisku kwasowym.
reakcja redukcji:
reakcja utlenienia:
Zbilansowane równanie reakcji:
3. Utlenianie kwasów karboksylowych
Kwasy karboksylowe generalnie nie ulegają utlenieniu. Wyjątkiem jest kwas mrówkowy oraz kwas szczawiowy. Kwas mrówkowy posiada atom węgla na formalnym II stopniu utlenienia, co różni go od pozostałych kwasów karboksylowych, w których formalny stopień karboksylowego atomu węgla wynosi III. Sprawia to, że kwas mrówkowy może utleniać się do tlenku węgla(IV).
Utlenienie kwasu szczawiowego (etanodiowego) jest możliwe ze względu na jego specyficzną budowę – bezpośrednie połączeń dwóch grup karboksylowych.
Jony dichromianowe(VI)
Jony dichromianowe(VI) utleniają alkohole do aldehydów, ketonów lub kwasów karboksylowych.
Działanie na alkohole ( w środowisku )
Utlenianie etanolu przy pomocy w środowisku kwasowym.
Bilansowanie równań reakcji redoks z udziałem cząsteczek organicznych
W przypadku reakcji redoks z udziałem cząsteczek organicznych, ich zbilansowanie sprowadza się do narysowania wzorów strukturalnych cząsteczek oraz wyznaczenia stopni utlenienia atomów. Dalsza część analizy reakcji redoks jest taka sama, jak w przypadku substratów nieorganicznych.
Ustal współczynniki stechiometryczne w poniższym równaniu reakcji. Zastosuj bilans jonowo‑elektronowy.
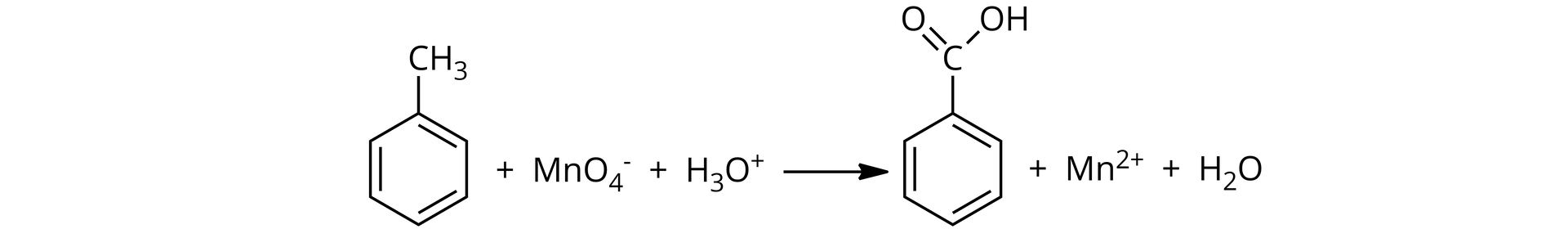
Rozwiązanie:
Przewidywanie przebiegu reakcji redoks
Poznaliśmy przykłady reakcji redoks, zachodzących z udziałem reagentów organicznych. Zastanówmy się teraz, dlaczego jon manganianowy(VII) może w środowisku kwasowym utleniać etanol do aldehydu octowego albo nawet do kwasu octowego. Zanim to zrobimy, przypomnijmy sobie, jakie reguły rządziły reakcjami redoks zachodzącymi z udziałem metali. Przeanalizujmy następującą reakcję:
Reakcja ta zachodzi, ponieważ metal aktywniejszy utlenia się kosztem metalu mniej aktywnego. Biorąc pod uwagę potencjały elektrochemiczne, zauważymy, że:
Aktywniejszy metal – – wykazuje bardziej ujemny (a więc niższy) potencjał, a metal mniej aktywny – – wykazuje potencjał bardziej dodatni (zatem wyższy). Popatrzymy teraz na potencjały trzech nieco bardziej skomplikowanych procesów redukcji:
Potencjały te należy rozumieć podobnie jak potencjały zawarte w szeregu elektrochemicznym metali. Jak można zauważyć, najwyższy potencjał wykazuje proces redukcji jonu . Dlatego jon ten może powodować utlenienie etanolu zarówno do aldehydu octowego, jak i do kwasu octowego.
W podobny sposób można analizować i przewidywać zajście innych procesów, nie tylko z odczynnikami organicznymi.
Słownik
ładunek, jaki zgromadziłby się na atomie danego pierwiastka wchodzącego w skład związku chemicznego, przy założeniu, że wszystkie wiązania chemiczne w związku mają charakter wiązań jonowych
(redukcja; łac. reductio „cofnięcie”, „odzyskanie”) proces polegający na przyjmowaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego obniża się stopień utlenienia pierwiastka oddającego elektrony
(utlenianie, oksydacja; fr. oxygéne dosłownie „kwasoród”, „tlen”) oksydacja, proces polegający na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka oddającego elektrony
(łac. reductio „cofnięcie”, „odzyskanie”) atom, jon lub cząsteczka, które w reakcji redoks są donorem elektronu (elektronów)
(fr. oxygéne, dosłownie „kwasoród”, „tlen”) atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
Bibliografia
Encyklopedia PWN
John McMurry, Chemia organiczna, cz. 2, Warszawa 2010.
Jurowski K., Jurowska A., Krzeczkowska M., Stopień utlenienia atomów (C,N, O, S i P) w związkach organicznych oraz reakcje utlenienia‑redukcji w chemii organicznej i biochemii, Kraków 2015.
Krzeczkowska M., Loch J., Mizera A., Chemia Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Master Organic Chemistry; https://www.masterorganicchemistry.com (dostęp: 20.08.2020).