Przeczytaj
Reakcje odwracalne i nieodwracalne
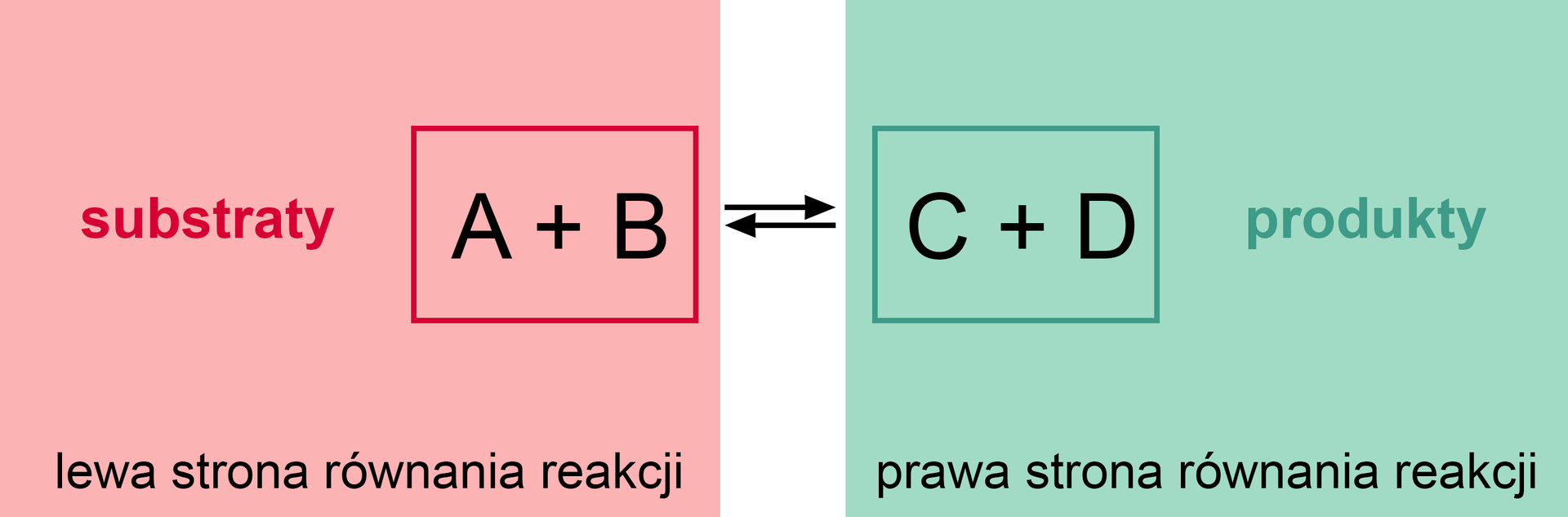
Reakcje chemiczne mogą być nieodwracalnenieodwracalne lub odwracalneodwracalne. Najczęściej spotykanymi reakcjami są te drugie. To takie, które nie biegną do samego końca, lecz w trakcie ich przebiegu równolegle tworzone są produkty, a następnie, w wyniku reakcji odwrotnej, odtwarzane są substraty z powstałych produktów. Wówczas w równaniu reakcji stosuje się dwie przeciwnie skierowane strzałki.
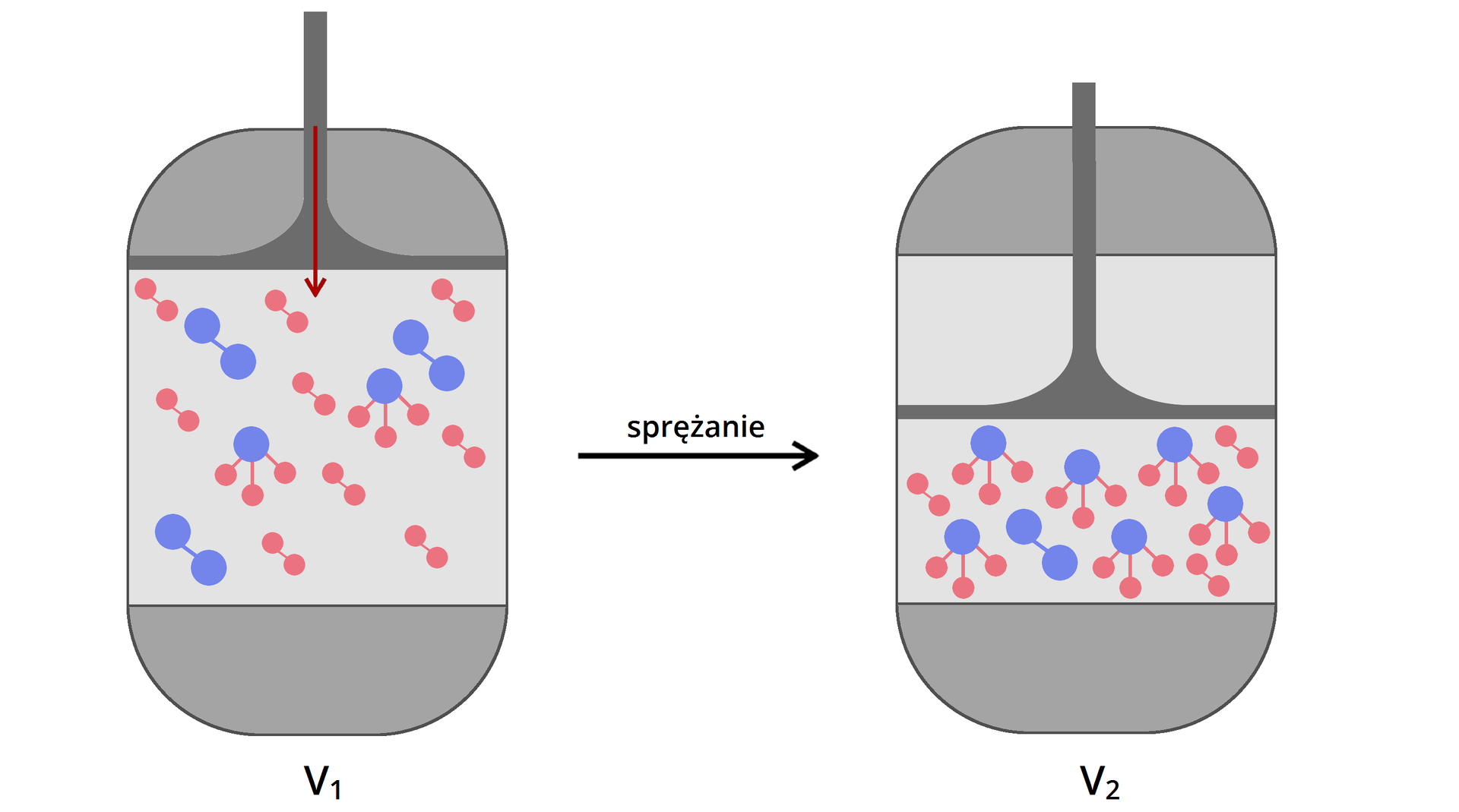
W wyniku zmieszania wodoru i azotu w stosunku molowym zaczyna zachodzić reakcja przekształcania cząsteczek i w cząsteczki .
Reakcja ta początkowo przebiega bardzo szybko, ponieważ w układzie znajduje się bardzo duża liczba cząsteczek i . W miarę jak tych cząsteczek ubywa (zmieniają się w cząsteczki ), szybkość reakcji tworzenia amoniaku spada. Równocześnie w układzie zaczyna zachodzić reakcja rozpadu amoniaku do wodoru i azotu:
Reakcja ta początkowo przebiega bardzo wolno, ponieważ w układzie znajduje się mało cząsteczek amoniaku. Kiedy liczba cząsteczek amoniaku rośnie (reakcja ich tworzenia z cząsteczek wodoru i azotu początkowo jest znacznie szybsza niż reakcja ich rozpadu), zwiększa się szybkość ich rozpadu. To wszystko trwa do czasu zrównania szybkości obu procesów. Gdy szybkość reakcji tworzenia amoniaku i jego rozpadu zyskają takie same wartości, układ osiąga stan równowagi dynamicznej. Wówczas przestają być widoczne zmiany stężeń poszczególnych reagentów w układzie. Mimo że reakcje nadal przebiegają w obie strony, szybkość tworzenia i rozpadu każdego z reagentów jest taka sama – makroskopowo nie zauważamy zmiany liczby cząsteczek i , w układzie.
Czynnikami, które mogą wywoływać zmianę położenia stanu równowagi reakcji chemicznej, są temperatura, ciśnienie, objętość układu reakcyjnego oraz stężenie reagentów.
Prawo działania mas
Ze stanem równowagi dynamicznej związane jest ważne prawo chemiczne. Jest to prawo działania mas, a treść jego brzmi następująco:
Iloczyn stężeń molowych produktów danej reakcji chemicznej podniesionych do odpowiednich potęg (równych współczynnikom stechiometrycznym w równaniu reakcji chemicznej), podzielony przez iloczyn stężeń molowych substratów podniesionych do odpowiednich potęg (równych współczynnikom stechiometrycznym w równaniu reakcji chemicznej), zmierzonych w stanie równowagi, jest wielkością stałą, niezależną od początkowych stężeń reagentów, lecz zależną od temperatury.
Gdzie , , , – stężenia równowagowe reagentów.
Aby lepiej zrozumieć to prawo, prześledźmy raz jeszcze reakcję syntezy amoniaku.
Jeśli zgodnie z równaniem reakcji chemicznej użyjemy do reakcji trzech moli cząsteczek wodoru oraz jednego mola cząsteczek azotu (), to będzie ona przebiegać do momentu ustalenia równowagi.
Stała równowagi tej reakcji () opisana jest wzorem:
Dla powyższego przykładu w podanej temperaturze (), przyjmie ona wartość . Jeśli natomiast do reakcji użyjemy sześć moli wodoru i dwa mole azotu, to reakcja będzie przebiegać do tego momentu, aż powyższy iloraz osiągnie tę samą wartość. Podobna sytuacja będzie mieć miejsce, gdy w naczyniu umieścimy moli amoniaku – wówczas będzie tak długo ulegał rozpadowi, aż wartość wyrażenia osiągnie tożsamą wartość . Dowodzi to prawdziwości powyższego prawa.
Dla przykładu, stała równowagi tej samej reakcji, ale przebiegającej w temperaturze , przyjmuje wartość .
Reakcjami chemicznymi są procesy, które przebiegają pomiędzy reagentami w różnych stanach skupienia, może to być stan ciekły (c), stan gazowy (g) oraz stan stały (s). W wyrażeniu na stałą równowagi reakcji, przebiegającej między gazami lub cieczami, nie uwzględnia się reagentów w stanie stałym i przyjmuję się, że wartość ich stężenia wynosi . Dlatego ważne jest, aby przed napisaniem wyrażenia na stałą równowagi reakcji uwzględniać stany skupienia reagentów, które biorą udział w reakcji w równaniu stechiometrycznym reakcji.
Stała równowagi reakcji pozwala przewidzieć, czy w reakcji równowagowej mamy do czynienia z przewagą substratów, czy produktów. Mała wartość stałej równowagi świadczy o przewadze substratów, natomiast duża wartość stałej równowagi świadczy o przewadze produktów.
Do zbiornika wprowadzono azot i wodór w fazie gazowej. Zapoczątkowano reakcję syntezy amoniaku:
którą prowadzono do ustalenia stanu równowagi (w danej temperaturze). Wówczas reagenty osiągnęły następujące stężenia:
;
;
.
A. Oblicz, ile wynosi wartość stałej równowagi dla podanej reakcji chemicznej w tej temperaturze.
B. Oblicz, jakie były stężenia początkowe substratów reakcji.
Słownik
stan, do którego dąży układ reakcyjny w trakcie przebiegu reakcji odwracalnej
reakcja przebiegająca tylko w jednym kierunku
reakcja, która przebiega w obu kierunkach celem osiągnięcia stanu równowagi
współczynnik opisujący stan równowagi reakcji odwracalnych; równa ilorazowi iloczynu stężeń produktów i iloczynu stężeń substratów (podniesionych do potęg zgodnych ze współczynnikami stechiometrycznymi), które zostały zmierzone w stanie równowagi
Bibliografia
Encyklopedia PWN
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.