Przeczytaj
Co to są alkiny?
To węglowodory alifatyczne (łańcuchowe), zawierające w swojej budowie jedno wiązanie potrójne pomiędzy atomami węgla. Alkiny tworzą szereg homologiczny o wzorze: , gdzie oznacza liczbę atomów węgla. Najprostszym alkinem jest etyn, o zwyczajowej nazwie acetylen i następującym wzorze strukturalnym:
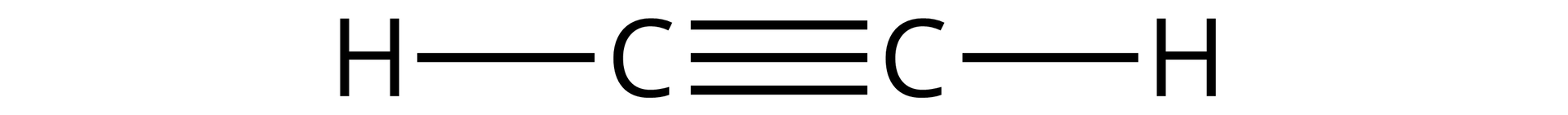
Z czego wynikają właściwości fizyczne alkinów?
W cząsteczkach alkinów nierozgałęzionych występuje wiązanie potrójne. Każde takie wiązanie składa się z jednego wiązania typu oraz dwóch typu . Orbitale walencyjne atomów węgla, połączonych wiązaniem potrójnym, są w stanie hybrydyzacji , co powoduje, że atomy te ułożone są na linii prostej. Długość wiązania potrójnego wynosi (), a jego energia wynosi . Ponadto oddziaływania międzycząsteczkowe, a więc wiązania wodorowe i siły van der Waalsa, mogą wpływać na właściwości alkinów. Poniżej przedstawiono najważniejsze właściwości fizyczne alkinów oraz ich zależność od liczby atomów węgla w łańcuchu cząsteczki.
Właściwości fizyczneWłaściwości fizyczne alkinów zmieniają się wraz ze wzrostem liczby atomów węgla w łańcuchu węglowym.
W warunkach normalnych (, ) alkiny od etynu do propynu to gazy; począwszy od dwóch izomerycznych butynów, alkiny są w warunkach normalnych cieczami; alkiny, których cząsteczki są jeszcze większe i zawierają kilkanaście lub więcej atomów węgla, charakteryzują się w tych warunkach stałym stanem skupienia.
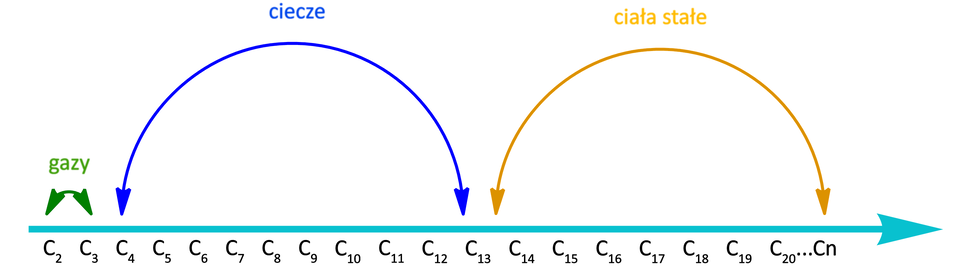
Co ciekawe, izomery położeniowe butynu charakteryzują się różną lotnością. W temperaturze pokojowej mają odmienne stany skupienia: but--yn jest gazem, natomiast but--yn – cieczą. Wynika to z położenia wiązania potrójnego pomiędzy atomami węgla, a w związku z tym symetrii cząsteczek. W przypadku but--ynu, mamy do czynienia z cząsteczką symetryczną, co sprawia, że cząsteczki te łatwiej dopasowują się do siebie przestrzennie i zwiększona jest siła oddziaływań międzycząsteczkowych. Wynika to z tego, że cząsteczki but--ynu potrzebują więcej energii do zmiany stanu skupienia na gazowy niż niesymetryczne cząsteczki but--ynu, pomiędzy którymi oddziaływania są słabsze.
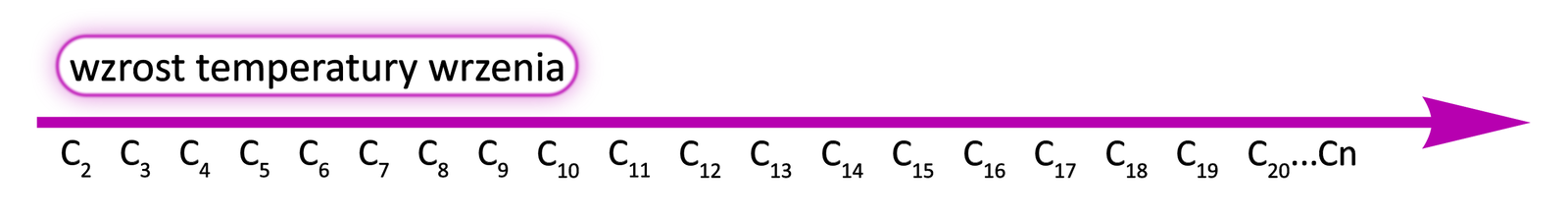
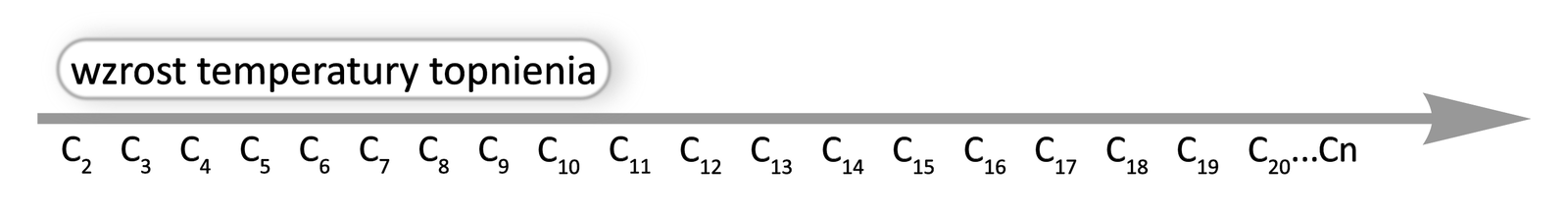
Wraz ze wzrostem liczby atomów węgla rosną zarówno temperatury wrzeniatemperatury wrzenia, jak i topnieniatopnienia nierozgałęzionych alkinów. Wynika to z tworzenia coraz większej ilości oddziaływań międzycząsteczkowych przez coraz większe cząsteczki. Aby zatem zmienić stan skupienia alkinów o coraz dłuższych łańuchach węglowych, należy dostarczyć coraz więcej energii. Natomiast im bardziej rozgałęzione cząsteczki, tym niższe temperatury topnienia i wrzenia substancji. Im cząsteczki są bardziej rozgałęzione, tym charakteryzują się słabszymi oddziaływaniami międzycząsteczkowymi.
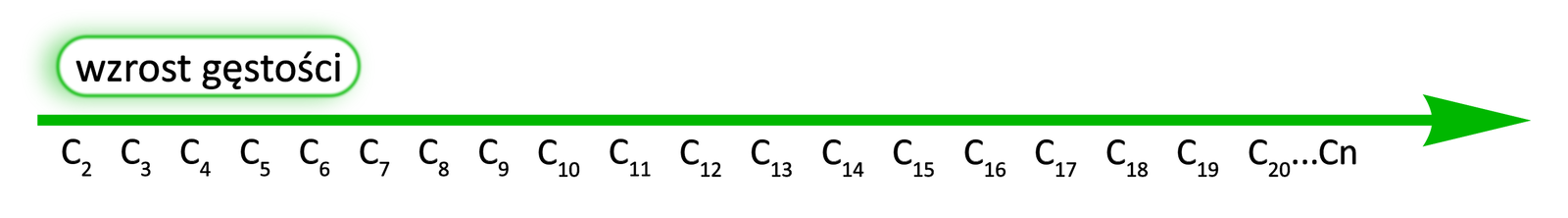
Wraz ze wzrostem długości łańcucha węglowego na ogół zwiększa się również gęstośćgęstość alkinów, jednak pozostaje mniejsza od gęstości wody wynoszącej . Gęstość zależy od masy substancji. Zatem im więcej atomów węgla w cząsteczce, tym większa gęstość.
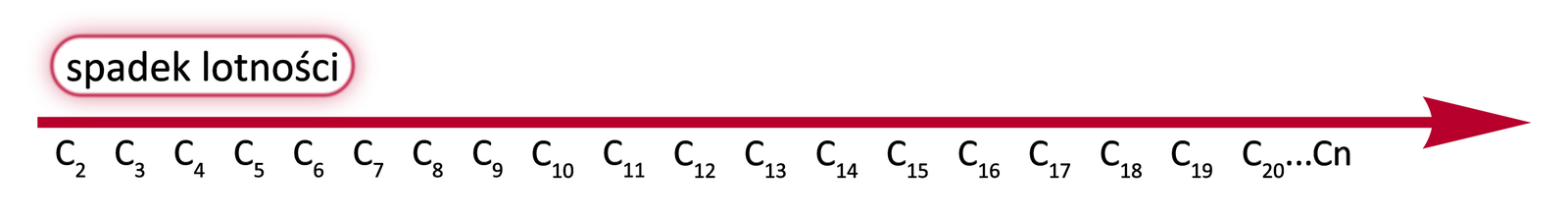
Wraz ze wzrostem długości łańcucha węglowego zmniejsza się lotnośćlotność alkinów. Jednym z czynników jest wzrastająca masa cząsteczkowa. Coraz większe cząsteczki tworzą coraz więcej oddziaływań międzycząsteczkowych, co utrudnia przechodzenie substancji w stan gazowy.
Wszystkie alkiny są bezbarwne i bezwonne (właściwość fizyczna), z wyjątkiem acetylenu o lekko specyficznym zapachu.
Alkiny są rozpuszczalne w większości rozpuszczalników organicznych, takich jak np.: benzen, aceton, chloroform. Potrójne wiązanie o charakterze kowalencyjnym niespolaryzowanym przyczynia się do niepolarnej siły tych wiązań. Alkiny są więc związkami niepolarnymi, które zgodnie z zasadą „podobne rozpuszcza się w podobnym” lepiej rozpuszczają się w rozpuszczalnikach niepolarnych.
Wielkości fizyczne wybranych alkinów
Poniżej przedstawiono wzory półstrukturalne, temperatury topnienia i wrzenia, a także gęstości w warunkach standardowych wybranych alkinów.
Tabela Wybrane właściwości fizyczne niektórych alkinów.
Nazwa | Wzór półstrukturalny | Temperatura wrzenia | Temperatura topnienia | Gęstość |
|---|---|---|---|---|
Etyn | 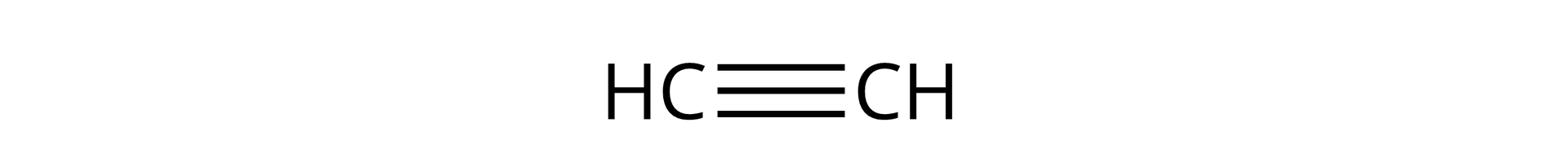 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
Propyn | 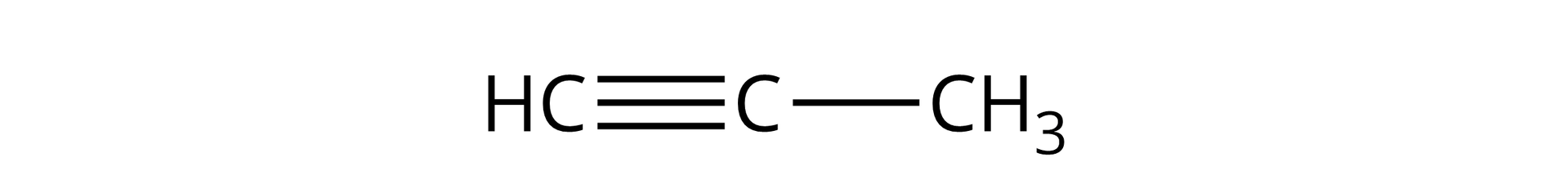 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
But‑‑yn | 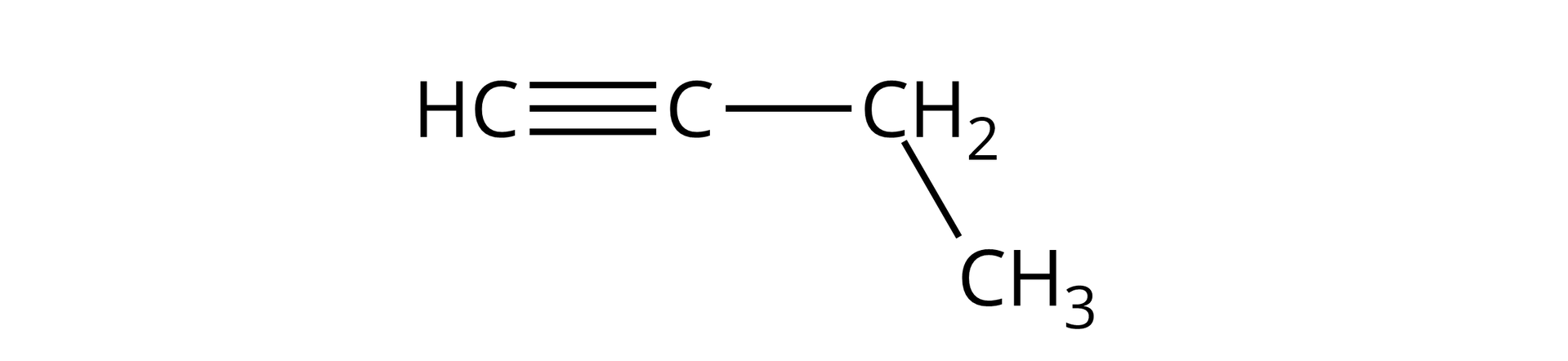 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
Heks‑‑yn | 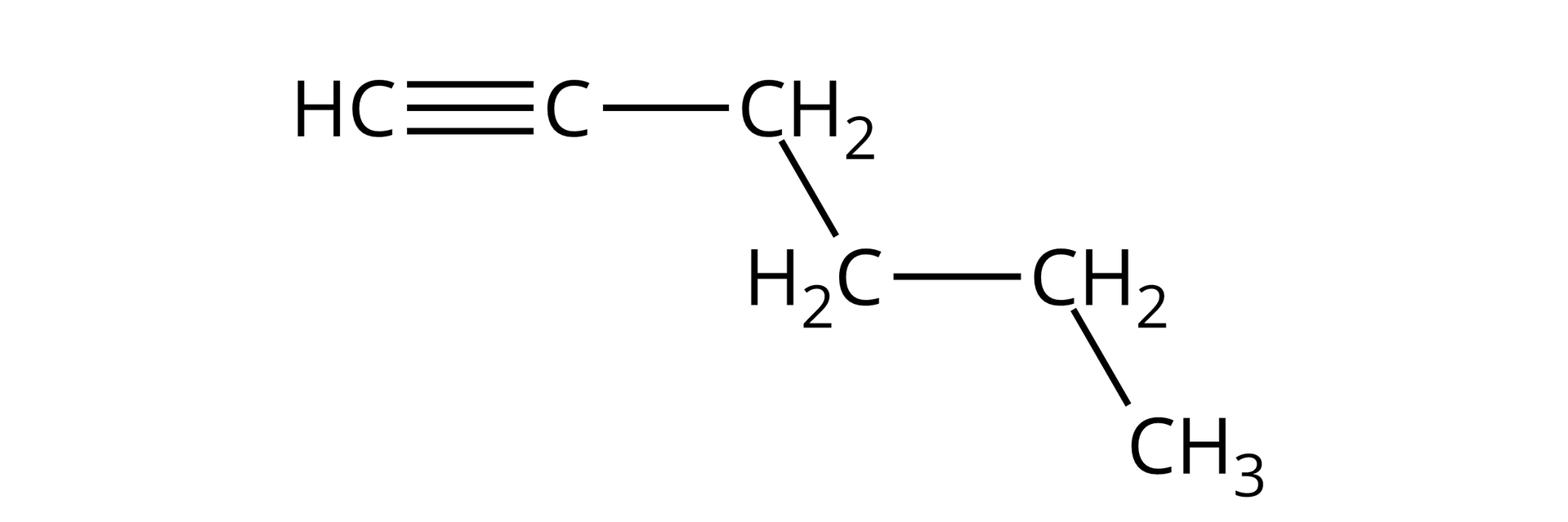 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
Dec‑‑yn | 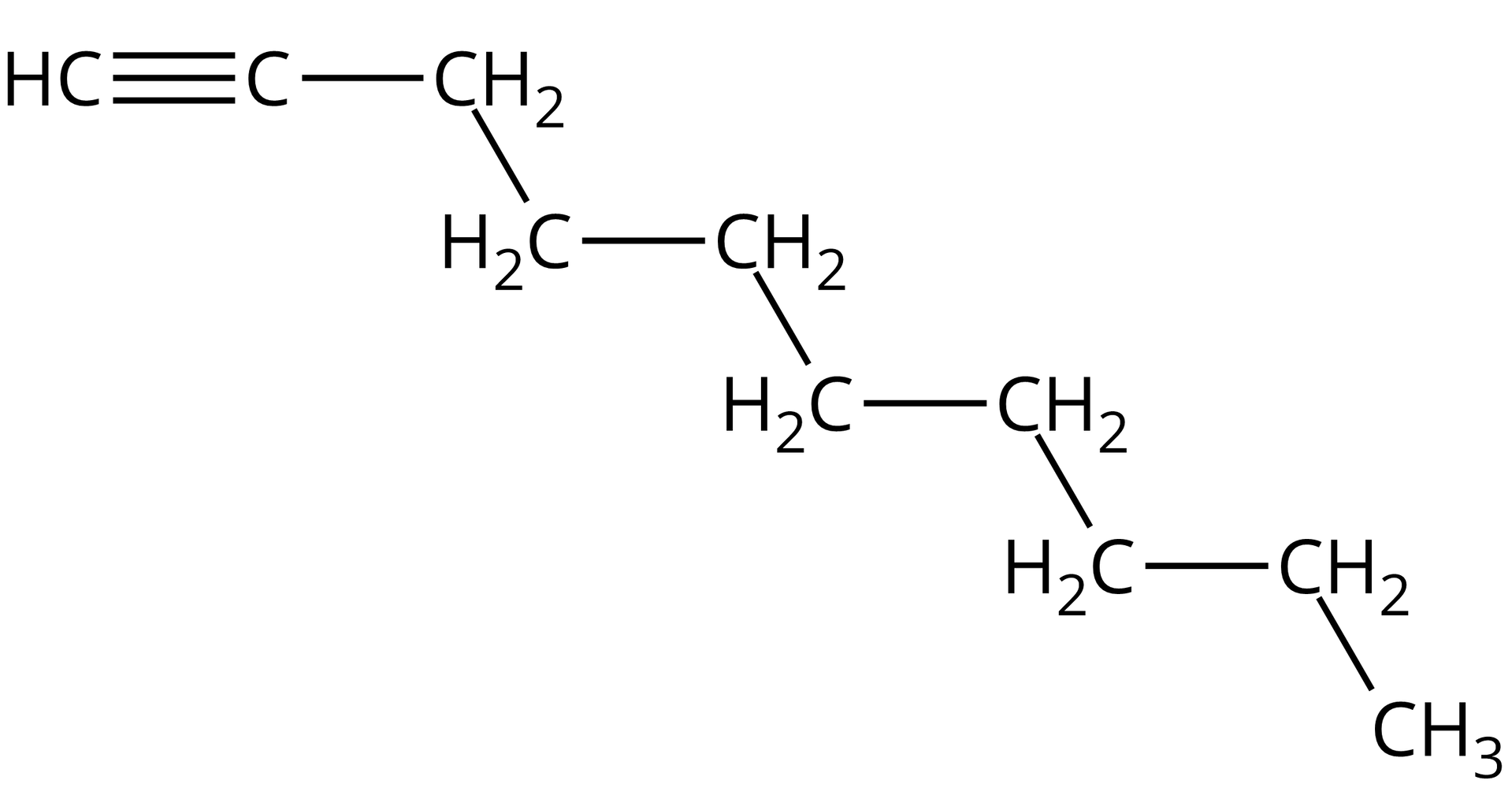 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
But‑‑yn | 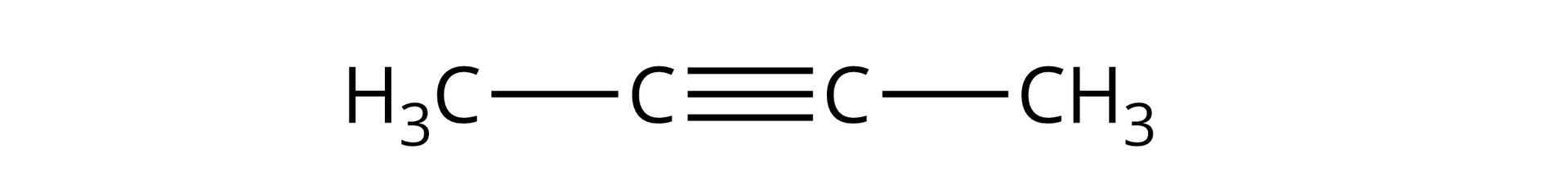 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
Pent‑‑yn | 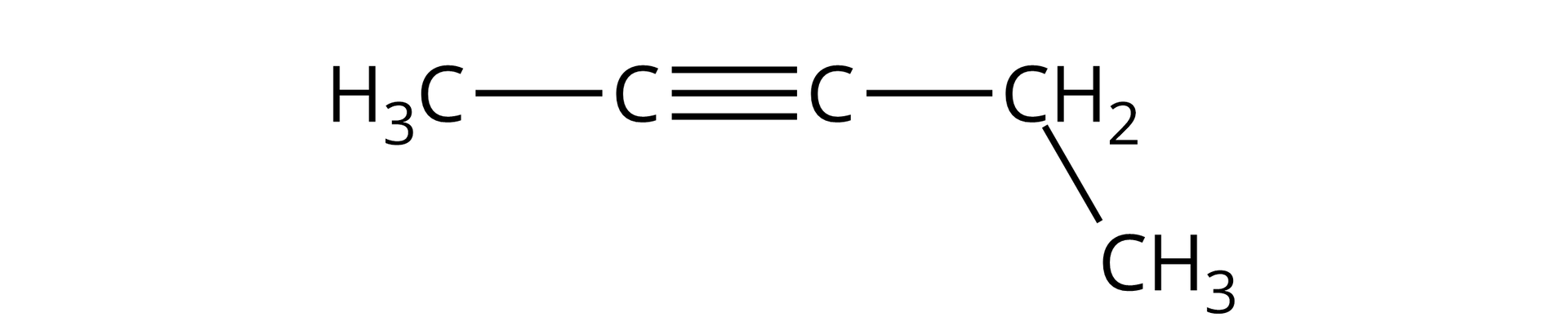 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | |||
,‑dimetylobut‑‑yn | 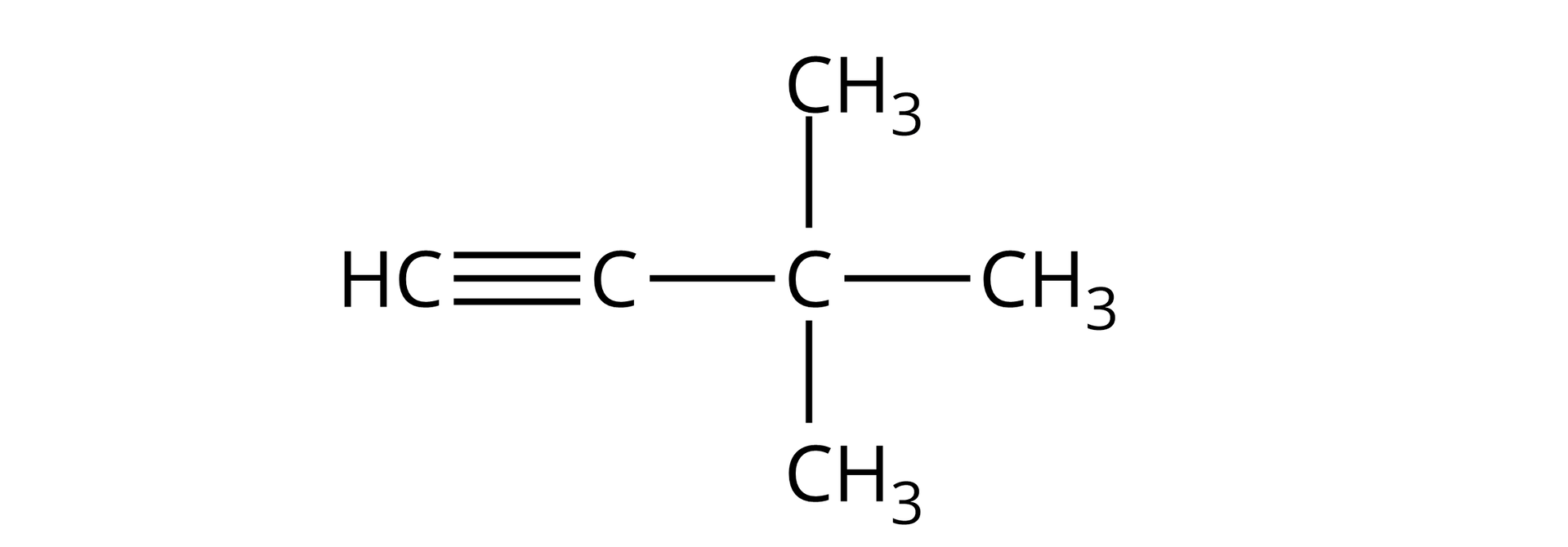 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Indeks dolny /Na podstawie: Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa, 1985./ Indeks dolny koniec/Na podstawie: Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa, 1985./
Słownik
charakterystyczne cechy danej substancji, takie jak: stan skupienia, barwa, rozpuszczalność (rozpuszczanie to zjawisko fizyczne), przewodnictwo elektryczne, przewodnictwo cieplne, temperatury wrzenia i topnienia, twardość, kruchość, kowalność, połysk, gęstość, właściwości magnetyczne
temperatura, w której substancja zmienia stan skupienia z ciekłego na gazowy (wrze); im niższe jest ciśnienie atmosferyczne, tym niższa jest temperatura wrzenia cieczy
temperatura, w której substancja zmienia stan skupienia ze stałego na ciekły (topi się); temperatura topnienia zależy od ciśnienia w otoczeniu
zdolność substancji do tworzenia z innymi substancjami układów jednorodnych — roztworów; miarą rozpuszczalności jest maksymalna ilość substancji rozpuszczająca się w określonej ilości ciekłego rozpuszczalnika, w danych warunkach temperatury i ciśnienia
stosunek masy pewnej ilości substancji do zajmowanej przez nią objętości
cecha substancji mająca postać gazu lub łatwo przechodząca w stan gazowy
Bibliografia
Bloch D. R., Organic chemistry demystified, New York 2006.
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Encyklopedia PWN
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 1985.
Vollhardt S., Organic Chemistry Structure and Function, Fifth Edition, New York 2007.