Przeczytaj
Pierwiastki bloku
Atomy pierwiastków bloku mają niecałkowicie zapełnione orbitale (z wyjątkiem atomów pierwiastków z grup i , które mają je całkowicie zapełnione, a elektrony walencyjne są umieszczone na kolejnej podpowłoce). Atomy pierwiastków grupy mają jeden elektron walencyjny, a atomy pierwiastków grupy posiadają ich dwa.
Do pierwiastków bloku należą te, które znajdują się w okresie od do i w grupach od do (z wyłączeniem lantanowców i aktynowców). Dawniej nazywane były jako pierwiastki, w których elektrony walencyjne atomów zajmują podpowłokę oraz . Właśnie z tej przyczyny cynk nie jest metalem przejściowym.
Według niektórych autorów, cały blok tworzy sekcję metali przejściowych. Natomiast wg definicji IUPAC, metale przejściowe są to pierwiastki chemiczne, których atomy lub kationy mają niecałkowicie zapełnioną podpowłokę .
Poniższa mapa myśli przedstawia najczęściej badane właściwości fizyczne materii.
- Nazwa kategorii: Właściwości fizyczne
- Nazwa kategorii: stan skupienia
- Nazwa kategorii: barwa
- Nazwa kategorii: gęstość
- Nazwa kategorii: przewodnictwo cieplne
- Nazwa kategorii: przewodnictwo elektryczne
- Nazwa kategorii: rozpuszczalność
- Nazwa kategorii: temperatura wrzenia
- Nazwa kategorii: temperatura topnienia Koniec elementów należących do kategorii Właściwości fizyczne
- Elementy należące do kategorii Właściwości fizyczne
Stan skupienia
Wszystkie pierwiastki bloku są ciałami stałymi w warunkach normalnych, oprócz rtęci, która jest cieczą. Metale te charakteryzują się dużą twardością, mogą być srebrzyste, lśniące oraz połyskliwe.
Na podstawie grafiki oraz dostępnych źródeł wiedzy opisz właściwości fizyczne złota.
Na podstawie opisu grafiki oraz dostępnych źródeł wiedzy opisz właściwości fizyczne złota.

Barwa
Z racji występowania niezapełnionych orbitali , związki kompleksowe metali przejściowych mogą absorbowaćabsorbować promieniowanie z zakresu widzialnego. Do dokładnego określenia barwy służy urządzenie nazywane spektrofotometrem.
Większość metali ma barwę srebrną/szarą, ponieważ odbijają wszystkie długości fal światła z zakresu widzialnego. Natomiast miedź i złoto nie odbijają światła fioletowego i niebieskiego. Brak tego pasma w widmie światła widzialnego sprawia, że widzimy je jako żółte lub pomarańczowe. Zjawisko to jest spowodowane strukturą elektronową złota i miedzi.
Gęstość
To stosunek masy do objętości. Najprostszym sposobem określenia gęstości jest zważenie próbki metalu i umieszczenie jej w cylindrze miarowym, w którym znajduje się ściśle określona ilość wody. Wyznaczając różnicę w poziomie wody przed zanurzeniem próbki metalu oraz po jej umieszczeniu w wodzie, a także znając masę próbki metalu, możemy obliczyć gęstość.

Wszystkie metale bloku mają dużą gęstość, po umieszczeniu w wodzie opadają na dno. Ogólna zasada jest taka, że gęstość metali rośnie w dół grupy.
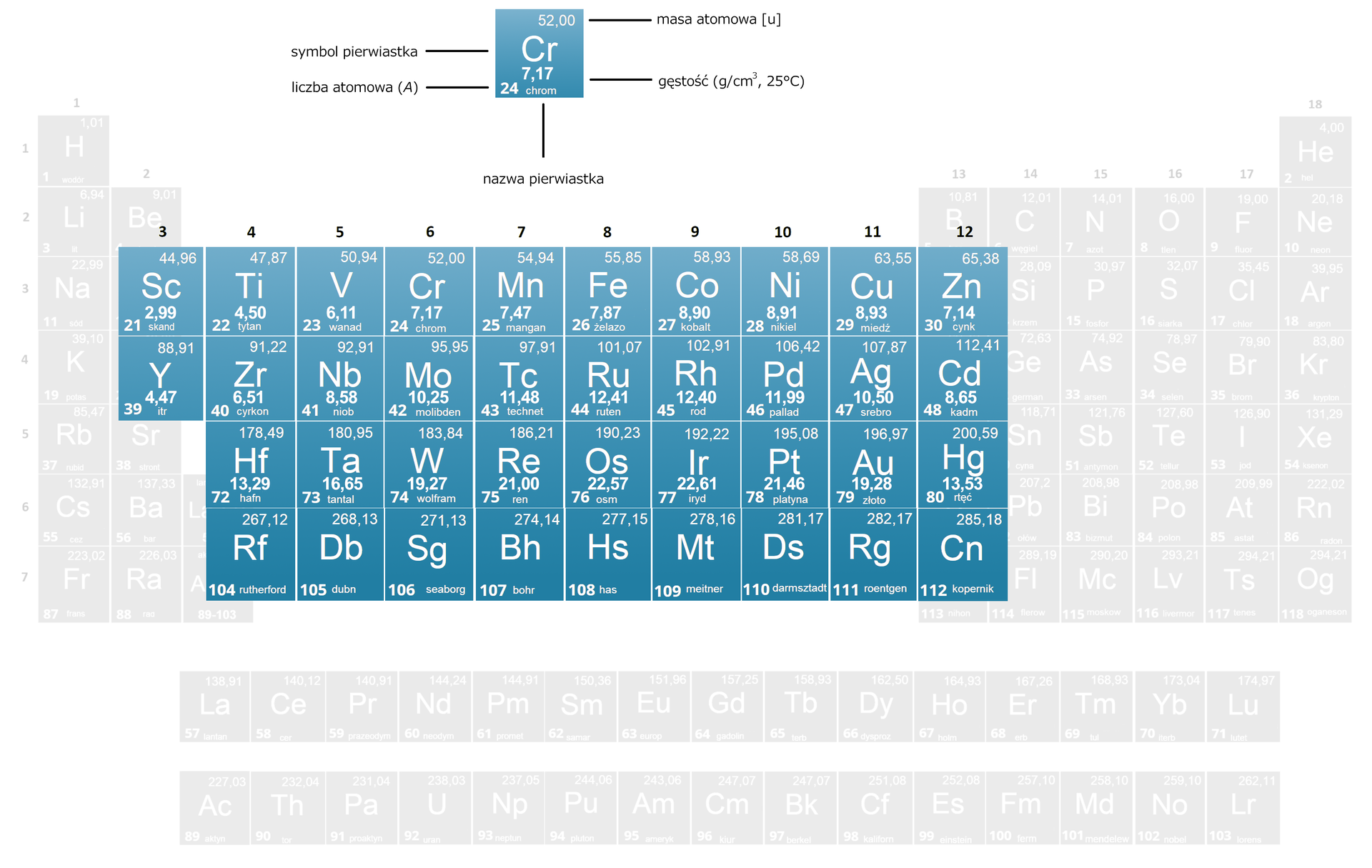
A. Możliwe odpowiedzi: 1. , 2. , 3. Możliwe odpowiedzi: 1. , 2. , 3. Możliwe odpowiedzi: 1. , 2. , 3.
Przewodnictwo
W metalach przewodnictwo cieplneprzewodnictwo cieplne jest wynikiem wymiany energii pomiędzy elektronami zdelokalizowanymi. Ciepło przekazywane jest poprzez drgające atomy oraz przez swobodne elektrony występujące w metalach – stąd różnice w wartościach przewodnictwa cieplnego metali.
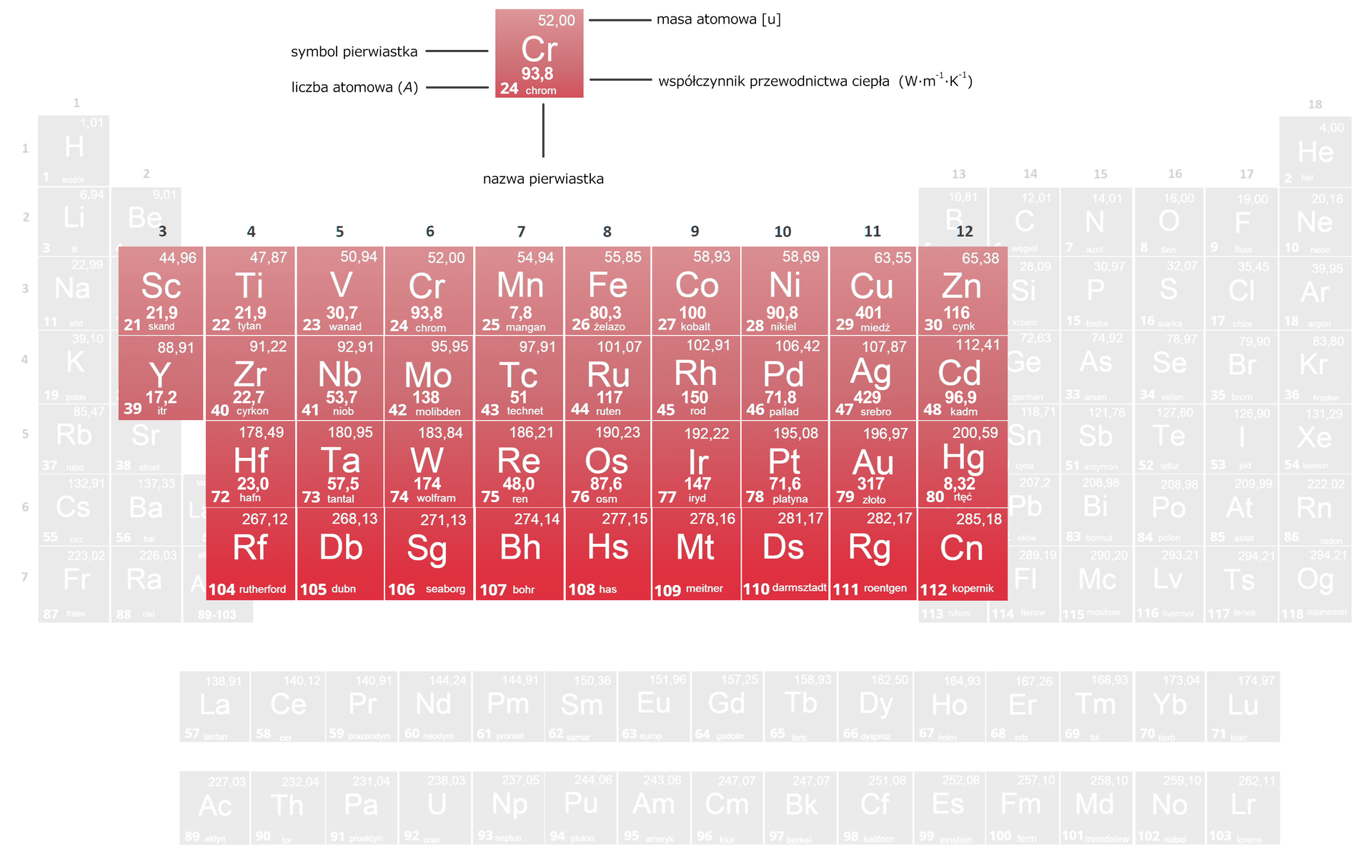
Wartość przewodnictwa cieplnego pierwiastków bloku ... Możliwe odpowiedzi: 1. rośnie w dół grupy., 2. maleje w dół grupy., 3. rośnie od lewej do prawej strony układu okresowego pierwiastków., 4. nie zależy od położenia pierwiastka w układzie okresowym pierwiastków.
Temperatura wrzenia i topnienia
Pierwiastki bloku charakteryzują się wysokimi temperaturami topnienia oraz wrzenia (powyżej ). Wyjątkiem od tej reguły jest rtęć – jedyny metal będący w stanie ciekłym w temperaturze pokojowej.
Wraz z położeniem pierwiastków w układzie okresowym, wg wzrastającej liczby atomowej, można zaobserwować periodyczne zmiany właściwości fizycznych, jak np. temperatura wrzenia i topnienia.
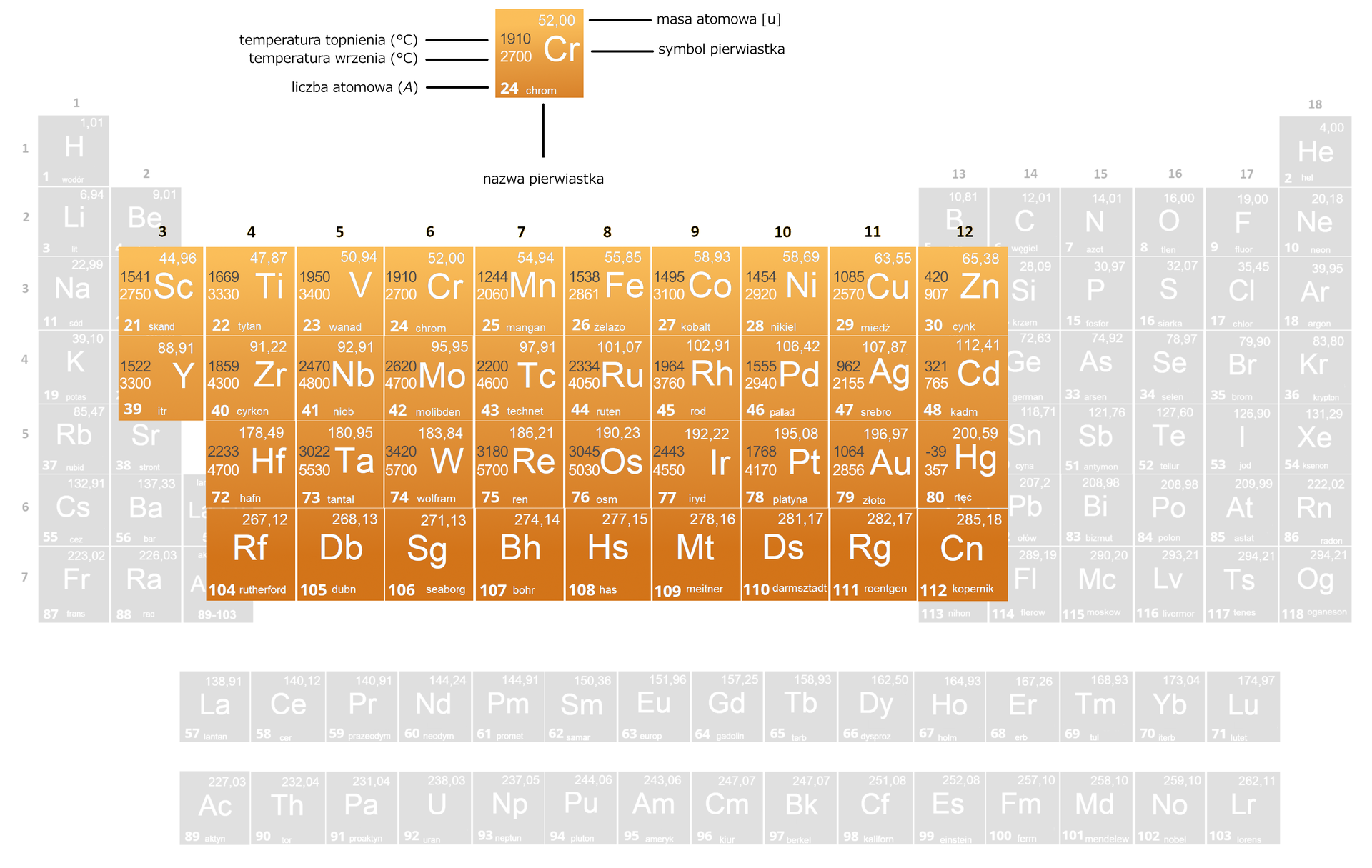
Magnetyzm
Metale bloku , które posiadają całkowicie zapełnione orbitale lub niesparowane elektrony walencyjne, mogą wykazywać właściwości fizyczne, takie jak:
ferromagnetyzm – zjawisko występowania chwilowego namagnesowania próbki metalu; najpopularniejszymi ferromagnetykami są: żelazo, kobalt oraz nikiel.
paramagnetyzm – zjawisko, w którym metale posiadają niesparowane elektrony, w wyniku czego metale są przyciągane przez magnes. Namagnesowanie jest stałe. Przykładami są mangan i platyna.
diamagnetyzm – zjawisko, które polega na zniesieniu oddziaływania elektromagnetycznego. Takie związki nie są przyciągane przez magnes.
Badanie magnetyzmu próbek metali.
Słownik
kompleksy; złożone cząsteczki lub jony (kationy, aniony), w których atom (lub jon) zw. atomem (jonem) centralnym jest połączony za pomocą wiązania koordynacyjnego z ligandami – jonami lub cząsteczkami obojętnymi, posiadającymi wolną parę elektronową
(łac. absorptio „wchłanianie”) fiz. pochłanianie (całkowite lub częściowe) energii promieniowania elektromagnetycznego, fal sprężystych lub promieniowania korpuskularnego (elektronów, neutronów, cząstek alfa i innych) przez ośrodek, w którym rozchodzi się to promieniowanie
proces przepływu ciepła w ośrodkach ciągłych (stałych, ciekłych i gazowych), który polega na przekazywaniu energii kinetycznej bezładnego ruchu cząsteczek ośrodka, z części układu o wyższej temperaturze do cząsteczek z części układu o temperaturze niższej
umownie przyjęte wartości ciśnienia (tzw. ciśnienie normalne), , i temperatury (tzw. temperatura normalna), , dla których podaje się zwykle wartości wielkości fizycznych, charakteryzujące ciała
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała .

