Przeczytaj
Czas połowicznej przemiany
Czas połowicznej przemiany substratu jest ważnym czynnikiem w kinetyce chemicznejkinetyce chemicznej. Analizuje szybkość przebiegu reakcji chemicznych i ich mechanizmówmechanizmów w odniesieniu do różnych warunków, tj. ciśnienia, temperatury, stężenia oraz natury reagentów, biorących udział w tej reakcji.
Z tym działem związane są pojęcia:
szybkości reakcjiszybkości reakcji;
cząsteczkowości reakcjicząsteczkowości reakcji;
rzędowości reakcjirzędowości reakcji (rząd reakcji);
stałej szybkości reakcjistałej szybkości reakcji.
Szybkość reakcji
Reakcją chemiczną nazywa się przemianę jednego lub większej ilości substratów w jeden lub kilka różnych produktów. Dlatego też szybkość reakcji chemicznej wyraża się jako iloraz stężenia molowego substratu (ze znakiem ujemnym, ponieważ w reakcji go ubywa) lub produktu do czasu i nie jest to wielkość stała, ponieważ w trakcie przebiegu reakcji ulega zmianom (maleje).
Powyższą zależność można zobrazować za pomocą wykresów zależności zmian stężenia molowego substratu i produktu do czasu.

Szybkość reakcji jest uwarunkowana wieloma czynnikami, które mogą ją zwiększać lub zmniejszać. Należą do nich:
temperatura,
stężenie reagentów,
stosowane rozpuszczalniki,
katalizatorykatalizatory/inhibitoryinhibitory,
mieszanie,
rozdrobnienie,
ciśnienie.
Cząsteczkowość reakcji
Cząsteczkowość reakcji to liczba cząsteczek substratu – atomów, jonów lub rodników, które biorą udział w danej reakcji elementarnejreakcji elementarnej. Przykładowo dwucząsteczkowa reakcja to synteza jodowodoru.
Rzędowość reakcji a stała szybkości
Rzędowość reakcji chemicznej to suma wykładników potęg poszczególnych stężeń molowych substratów. Dla syntezy jodowodoru:
Dla powyższej reakcji chemicznej równanie kinetycznerównanie kinetyczne na szybkość reakcji chemicznej to:
gdzie – stała szybkości reakcji.
Rząd reakcji wynosi (, ponieważ stężenia substratów są podniesione do potęgi – kolor ).
W przypadku reakcji złożonych, składających się z kilku etapów, równanie kinetyczne ustala się doświadczalnie. Wówczas rząd reakcji nie musi być wartością całkowitą, jak dla reakcji prostych.
Stała szybkości reakcji to współczynnik proporcjonalności w równaniu kinetycznym reakcji chemicznej. Jednostkę stałej szybkości determinuje równanie kinetyczne w taki sposób, aby szybkość reakcji chemicznej wyrażona była w
. Zależność jednostki stałej szybkości reakcji od rzędu reakcji przedstawia poniższy wzór:
gdzie – rząd reakcji.
Reakcje rzędu
W kinetyce chemicznej analizowane są zależności dla reakcji o różnej rzędowości. Do najbardziej znanych należą reakcje: zerowego rzędu, rzędu oraz rzędu. Na cele powyższego tematu przeanalizujesz zależności dla reakcji rzędu.
Reakcjami rzędu nazywane są te, dla których rząd wynosi . Dla nich równanie kinetyczne ma postać:
gdzie:
– stężenie molowe substratu pozostałe po czasie ,
– początkowe stężenie molowe substratu,
– stała szybkości reakcji ,
– czas przebiegu reakcji,
– logarytm naturalny o podstawie (liczba Eulera), gdzie
Powyższe wyrażenie można również zapisać jako zależność masy ( i ), liczby moli ( i ) lub liczby cząsteczek ( i ) i wówczas:
W opisie zależności, w kinetyce chemicznej, stosowane są wykresy. Poniżej podano kilka przykładowych wykresów, które służą do opisu kinetyki reakcji rzędu.
Wykresy zależności stężenia molowego substratu od czasu oraz szybkości reakcji od czasu są wykresami ekspotencjalnymi. Ta zależność związana jest z równaniem kinetycznym ( – liczba Eulera), ale wynika również z malejącej w czasie reakcji ilości substratów, a tym samym – malejącej szybkości reakcji.
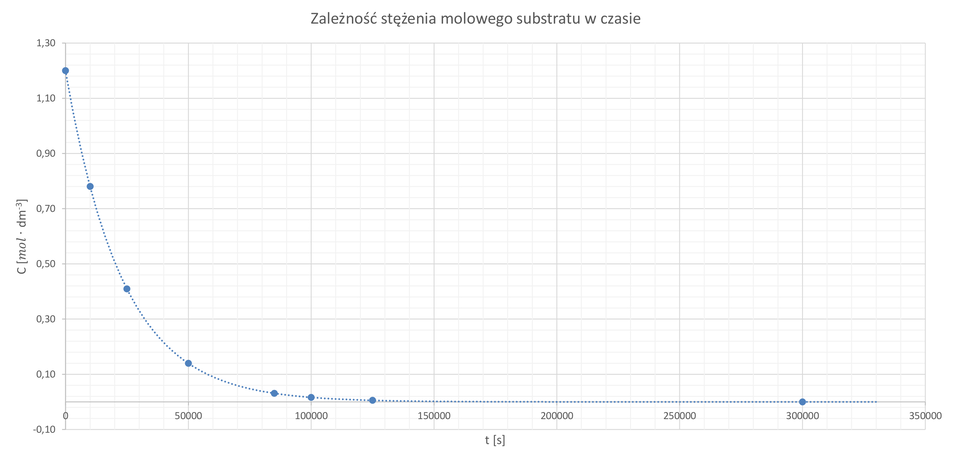
Na wykresy zależności stężenia molowego substratu w funkcji czasu ma wpływ stała szybkości reakcji: jeżeli stała szybkość jest większa, to nachylenie wykresu będzie ostrzejsze.
![Na ilustracji znajduje się wykres zależności logarytmu naturalnego (oś Y) od czasu (oś X). Na wykresie jest prosta biegnąca wysoko na osi Y w dół na skos do osi X. Z postępującym czasem wartości logarytmu maleją i zbliżają się do zera. Punkt, w którym prosta się zaczyna to punkt przecięcia = In [ S ] 0 . Jej nachylenie oznacza się minus k.](https://static.zpe.gov.pl/portal/f/res-minimized/R1CwbTUMl1ai4/1634338081/2k72CY79oSvYnoLoc4zwizfXsyVB74R5.png)
Przykładami reakcji rzędu są reakcje rozkładu, hydrolizy estrów, inwersji sacharozy w glukozę i fruktozę, jodowania acetonu oraz reakcje rozkładów promieniotwórczych. Dla nich można obliczyć czas potrzebny do zaniku połowy z początkowej ilości substratu, wówczas:
gdzie – masa pozostała po zaniku połowy substratu.
Następnie, po podstawieniu do wzoru na równanie kinetyczne,
otrzymujemy wzór na czas połowicznej przemiany (czyli potrzebny do zaniku połowy substratu):
Oblicz czas połowicznej przemiany dla reakcji rzędu, której stała szybkości wynosi:
Dla poniższej reakcji stała szybkości wynosi .
Oblicz czas połowicznej przemiany i zaznacz go na wykresie zależności zmian stężenia molowego substratu w czasie. Stężenie początkowe substratu wynosiło .
Słownik
opis faktycznego przebiegu reakcji chemicznej, razem ze wszystkimi stadiami i produktami pośrednimi
reakcja chemiczna, która zachodzi w jednym etapie/akcie, bez produktów pośrednich
substancja chemiczna, której dodatek do reakcji powoduje przyśpieszenie reakcji chemicznej, po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy katalizatory homogeniczne, czyli będące w takiej samej fazie co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
substancja chemiczna, której dodatek do reakcji powoduje spowolnienie lub zatrzymanie reakcji chemicznej, po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy inhibitory homogeniczne, czyli będące w takiej samej fazie co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
zależność szybkości reakcji chemicznej od stężenia reagentów i temperatury, a w przypadku reakcji chemicznych przebiegającej w fazie gazowej, dodatkowo od ciśnienia
dział chemii fizycznej zajmujący się szybkością reakcji chemicznych w różnych warunkach ciśnienia, temperatury oraz stężenia i natury reagentów
promieniotwórczy izotop węgla; jego jądro atomowe zawiera protonów i neutronów
zmiana stężenia molowego substratów lub produktów w jednostce czasu
liczba cząsteczek biorąca udział w reakcji elementarnej
suma wykładników potęg w równaniu kinetycznym
współczynnik proporcjonalności w równaniu kinetycznym
inaczej funkcja wykładnicza; funkcja ciągła, rosnąca
Bibliografia:
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej. S**krypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
