Przeczytaj
Sformułowana przez Kelvina i Plancka pierwsza zasada termodynamiki opisuje bilans energetyczny procesów, ale nie określa kierunku procesu i nie podaje informacji o sposobie jego przebiegu (odwracalny, nieodwracalny, samorzutny, wymuszony). Samorzutnie przebiegają zarówno procesy endoenergetyczne (np. rozpuszczanie niektórych soli), jak i procesy egzoenergetyczne (np. rozpuszczanie stężonych kwasów w wodzie). Procesy samorzutne mogą zachodzić bez konieczności wykonania pracy na układzie, np. rozprężanie gazu do próżni, przepływ ciepła od ciała gorącego do zimnego. Natomiast, aby zaszedł proces niesamorzutny (wymuszony), trzeba do układu dostarczyć energię w postaci pracy wykonanej na układzie, np. sprężanie gazu lub przepływ ciepła z ciała zimnego do ciepłego w układzie lodówki.

Układ można przeprowadzić ze stanu początkowego do stanu końcowego w sposób odwracalny albo w sposób nieodwracalny. Proces odwracalny to inaczej proces równowagowy i występuje wtedy, kiedy za pomocą bardzo małej zmiany otoczenia można przeprowadzić proces odwrotny po tej samej drodze, ale w przeciwnym kierunku. Proces jest nieodwracalny, gdy niemożliwy jest powrót układu i otoczenia do stanu początkowego (stłuczona filiżanka).
Przykłady
Po doprowadzeniu do kontaktu cieplnego dwóch ciał o różnych temperaturach, ciepło zawsze przepływa od ciała o wyższej temperaturze do ciała o niższej temperaturze.
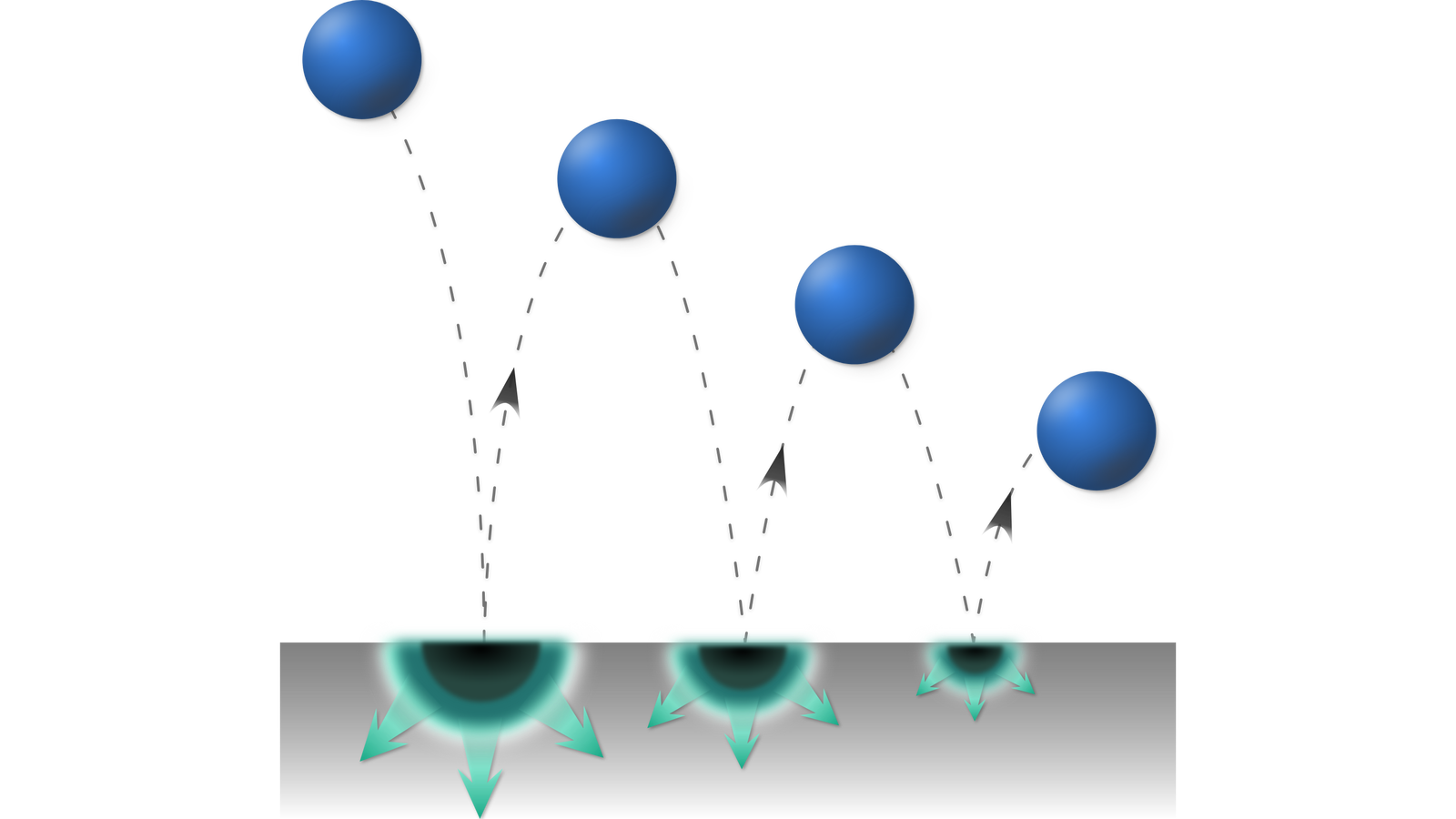
Gumowa lub stalowa kula, opuszczona na twardą powierzchnię, odbija się kilkakrotnie i ostatecznie nieruchomieje. Przy każdym odbiciu kulki część energii zostaje zamieniona na ciepło podłogi. Nigdy nie obserwujemy procesu odwrotnego, w którym kulka, początkowo spoczywająca na powierzchni, nagle zaczyna samoistnie (bez żadnej ingerencji z zewnątrz) podskakiwać nad powierzchnię.
Wykonujące drgania wahadło zatrzymuje się w stanie równowagi, po dostatecznie długim okresie czasu. Energia kinetyczna wahadła zamienia się na energię cieplną ruchu cząsteczek ośrodka. Nigdy nie obserwujemy sytuacji odwrotnej, tj. zamiany energii cieplnej na kinetyczną.
Na podstawie obserwacji doświadczalnych sformułowano zasadę termodynamiki, która pozwala na wnioskowanie o kierunku procesów. Treść zasady termodynamiki może być sformułowana na wiele sposobów, które ostatecznie są logicznie równoważne. Do często spotykanych stwierdzeń należą:
wszystkie procesy samorzutne zachodzą nieodwracalnie;
w procesach samorzutnych rośnie nieuporządkowanie układu i maleje jego zdolność do wykonywania pracy zewnętrznej;
nie jest możliwa całkowita zamiana ciepła na pracę;,
przepływ ciepła zachodzi od ciała cieplejszego do zimniejszego, nigdy inaczej;
zbudowanie perpetuum mobileperpetuum mobile drugiego rodzaju jest niemożliwe.
Entropia
Entropia () jest funkcją stanu, określającą, w kierunku jakim mogą zachodzić procesy w układzie izolowanym. W układzie izolowanym procesy mogą zachodzić tylko w kierunku wzrostu entropii ( zasada termodynamiki). W stanie równowagi entropia przyjmuje wartość stałą, maksymalną. Entropia utożsamiana jest również z nieuporządkowaniem układu. Im bardziej nieuporządkowany jest układ, im większy chaos, tym większa jest wartość entropii.
Wnioski płynące z zasady termodynamiki
Znak równości dotyczy procesów odwracalnych, a znak nierówności procesów nieodwracalnych.
Sumaryczne zmiany entropii dla układu i otoczenia w procesach odwracalnych są zerowe, czyli .
W procesach nieodwracalnych sumaryczne zmiany entropii dla układu i otoczenia są zawsze wielkością dodatnią .
Samorzutnie mogą w układzie przebiegać tylko takie procesy, które zwiększają sumaryczną wartość entropii dla układu i otoczenia.
Entropia układu izolowanego nie może maleć.
W procesie samorzutnym entropia układu nieizolowanego może maleć, jednak w procesie tym rośnie entropia otoczenia, a suma zmian entropii dla układu i otoczenia jest większa od zera.
Wzrost entropii towarzyszy zawsze zwiększaniu się stopnia nieuporządkowania układu. Wzrost entropii dla procesu nieodwracającego (spadająca filiżanka) oznacza, że w tych procesach układ ewoluuje zawsze do stanu, którego stan nieporządku położeń i prędkości cząstek jest większy.
Przy wzroście stopnia uporządkowania entropia układu maleje.
Wzrost entropii towarzyszy zawsze zwiększaniu się stopnia nieuporządkowania układu. Czy wiesz, że oznacza to, że układ uporządkowany, jakim jest życie, jest podtrzymywany kosztem pobierania energii z zewnątrz? zasada termodynamiki, określając kierunek zmian zachodzących w danym układzie izolowanym, określa jednocześnie nieodwracalność upływu czasu.
Słownik
układ, w którym niemożliwa jest wymiana materii i energii pomiędzy układem a otoczeniem
układ, w którym możliwa jest wymiana energii pomiędzy układem a otoczeniem, a niemożliwa jest wymiana materii
termodynamiczna funkcja stanu; miara stopnia nieuporządkowania układu i rozproszenia energii
część przestrzeni materialnej, będącej przedmiotem rozważań, pozostała część przestrzeni jest otoczeniem
maszyna, która wykonywałaby pracę bez pobierania energii z otoczenia (perpetuum mobile pierwszego rodzaju) lub całą dostarczoną energię (ciepło) zamieniałaby na pracę (perpetuum mobile drugiego rodzaju), perpetuum mobile pierwszego rodzaju będzie sprzeczne z zasadą termodynamiki, a perpetuum mobile drugiego rodzaju – z zasadą termodynamiki
Bibliografia
Atkins P. W., Chemia Fizyczna, Warszawa 2006.
Gumiński K., Termodynamika, Wydanie 3, Warszawa 1974.
Stauffer D., Stanley H. E., Od Newtona do Mandelbrota, Warszawa 1996.
Orear J., Fizyka, Warszawa 1993.