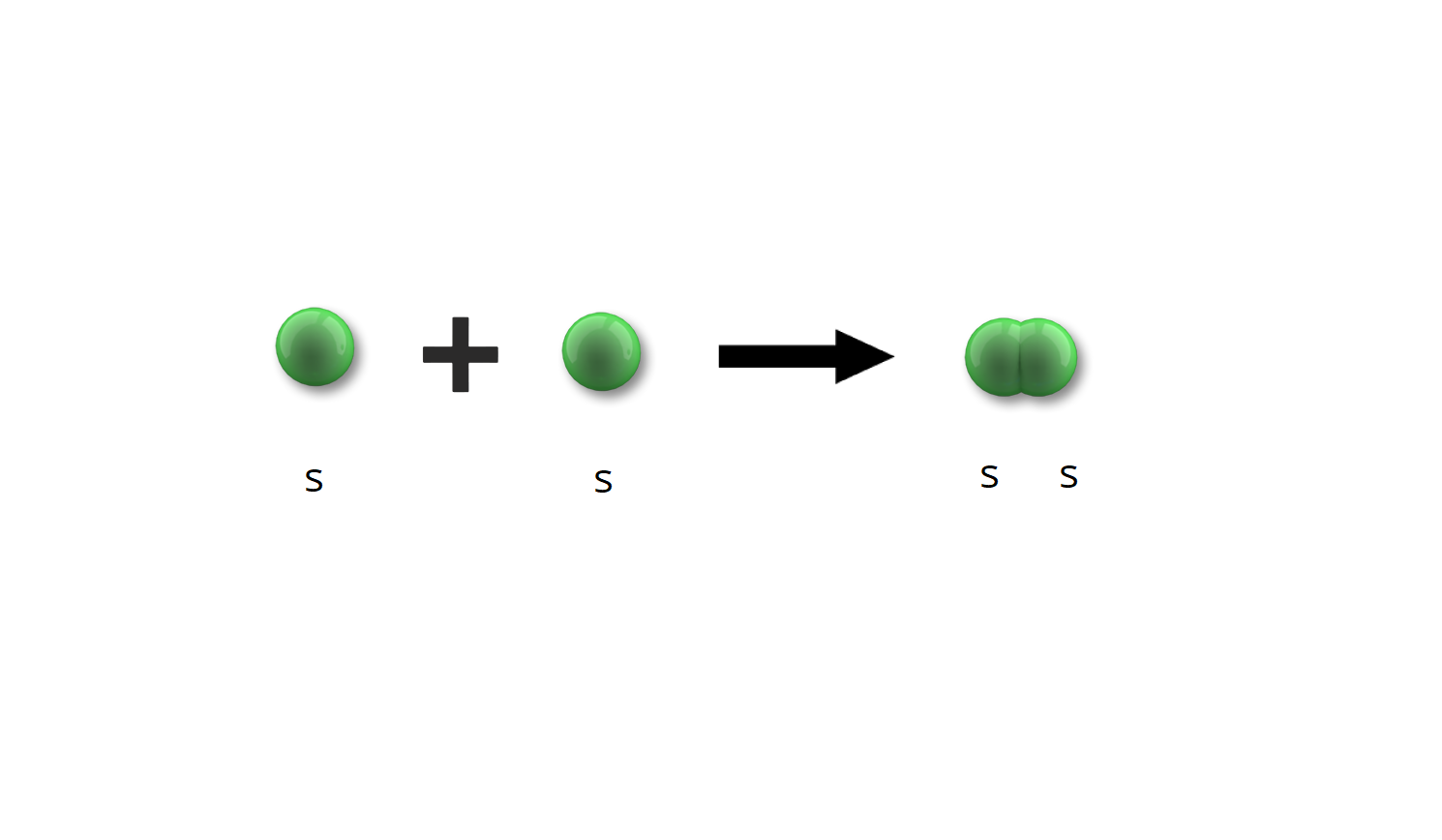Przeczytaj
Orbitale molekularne
Powstawanie wiązań pomiędzy atomami można wyjaśnić zgodnie z zasadami mechaniki kwantowejmechaniki kwantowej. Teoria kwantowa oparta na obliczeniach matematycznych zakłada, że wiązanie kowalencyjne powstaje w wyniku nakładania się orbitali atomowychorbitali atomowych. Powstający charakterystyczny rozkład gęstości elektronowej – orbital molekularny – określany jest jako wiązanie (czyt. sigma) lub wiązanie (czyt. pi), w zależności od sposobu nakładania się orbitali.
W atomie mogą występować orbitale , , , . Zgodnie z kwantową teorią wiązań chemicznych, orbital molekularny (cząsteczkowy) powstaje w wyniku zbliżenia i nałożenia się orbitali atomowych, które posiadają podobną energię i jednakową symetrię względem osi łączącej dwa jądra atomowe.
Czy orbitale, powstałe z nakładania się dwóch orbitali typu , będą takie same jak z dwóch orbitali typu ?
Zastanów się, jak powstaje np. cząsteczka wodoru.
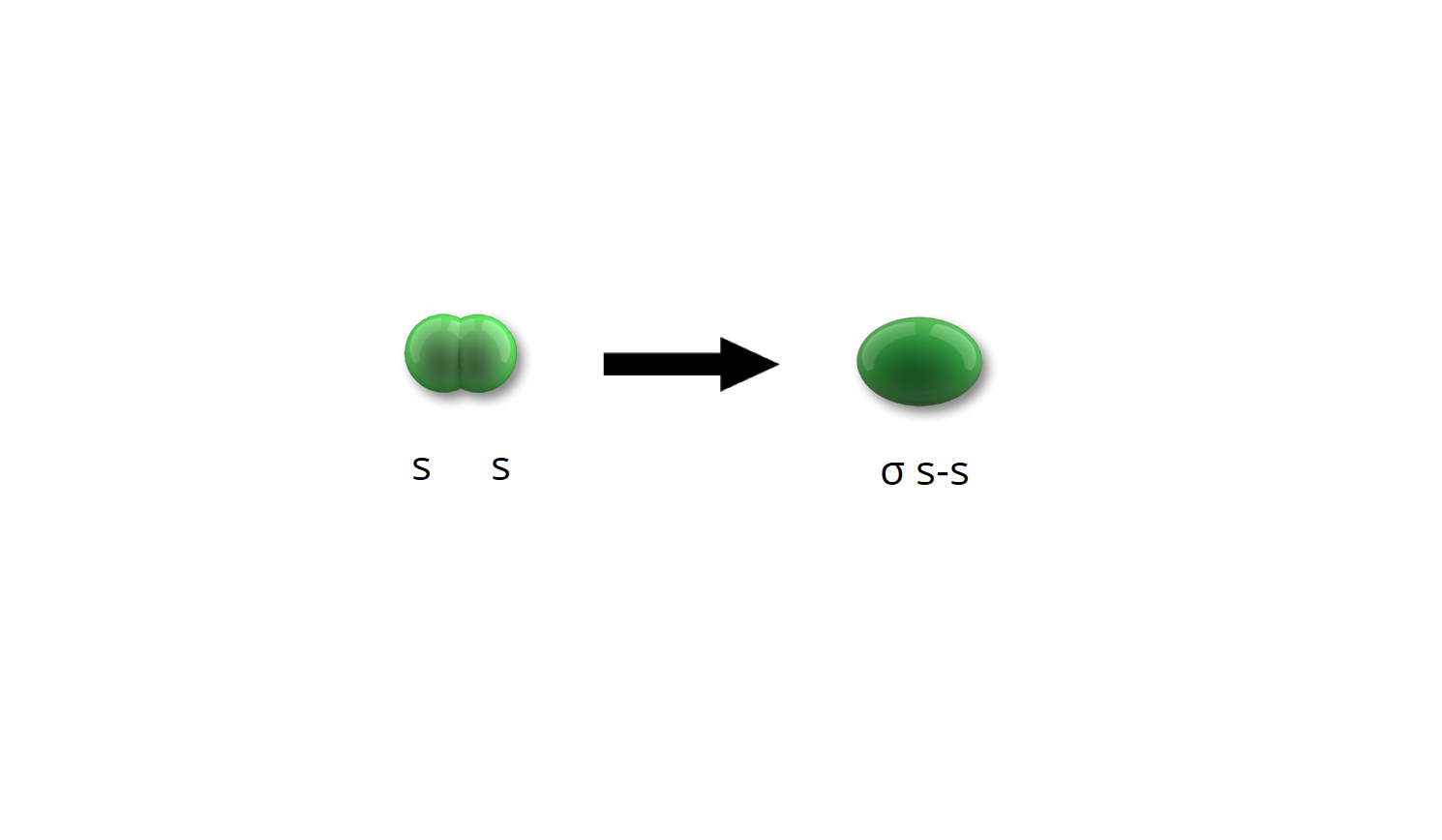
Cząsteczka wodoru () powstaje poprzez nałożenie się chmur elektronowych dwóch atomów wodoru. Elektron w atomie wodoru znajduje się na orbitalu . W wyniku zbliżania się do siebie obu chmur następuje ich nakładanie i zlanie w jedną chmurę, która obejmuje oba atomy. W taki sposób powstaje orbital molekularny obsadzony dwoma elektronami.
A co w przypadku, gdy niesparowane elektrony (zdolne do tworzenia wiązań) znajdują się wyłącznie na orbitalach typu ?
Z taką sytuacją mamy do czynienia w przypadku cząsteczki fluoru. Cząsteczka fluoru () powstaje poprzez nałożenie się chmur elektronowych dwóch atomów fluoru. Niesparowany elektron, zdolny do utworzenia wiązania pojedynczego, znajduje się w atomie fluoru na orbitalu . W wyniku zbliżania się do siebie obu chmur, następuje ich nakładanie. Powstaje jedna chmura elektronowa i tworzy się orbital molekularny obsadzony dwoma elektronami i o kształcie innym niż orbital .
Jaki będzie kształt orbitalu molekularnego, gdy chmury elektronowe będą pochodzić od orbitali o różnych kształtach?
Rozpatrzmy zatem powstawanie wiązania typu w kwasie fluorowodorowym (). Elektron w atomie fluoru znajduje się na orbitalu , a elektron w atomie wodoru – na orbitalu . Cząsteczka powstaje poprzez nałożenie się chmur elektronowych dwóch atomów (fluoru i wodoru). W wyniku zbliżania się do siebie obu chmur, następuje ich nakładanie. Tworzy się jedna chmura obejmująca oba atomy. W taki sposób powstaje orbital molekularny , obsadzony dwoma elektronami.
Warto zauważyć, że wiązania sigma tworzone są nie tylko przez orbitale atomowe, ale też przez orbitale zhybrydyzwoane, np. , czy , co ma miejsce chociażby w przypadku związków organicznych.
Cząsteczki, które posiadają wiązania , mają możliwość obrotu atomów wokół tego wiązania, co można zaobserwować np. w cząsteczce etanu. Jak powstają wiązania typu w tej cząsteczce?
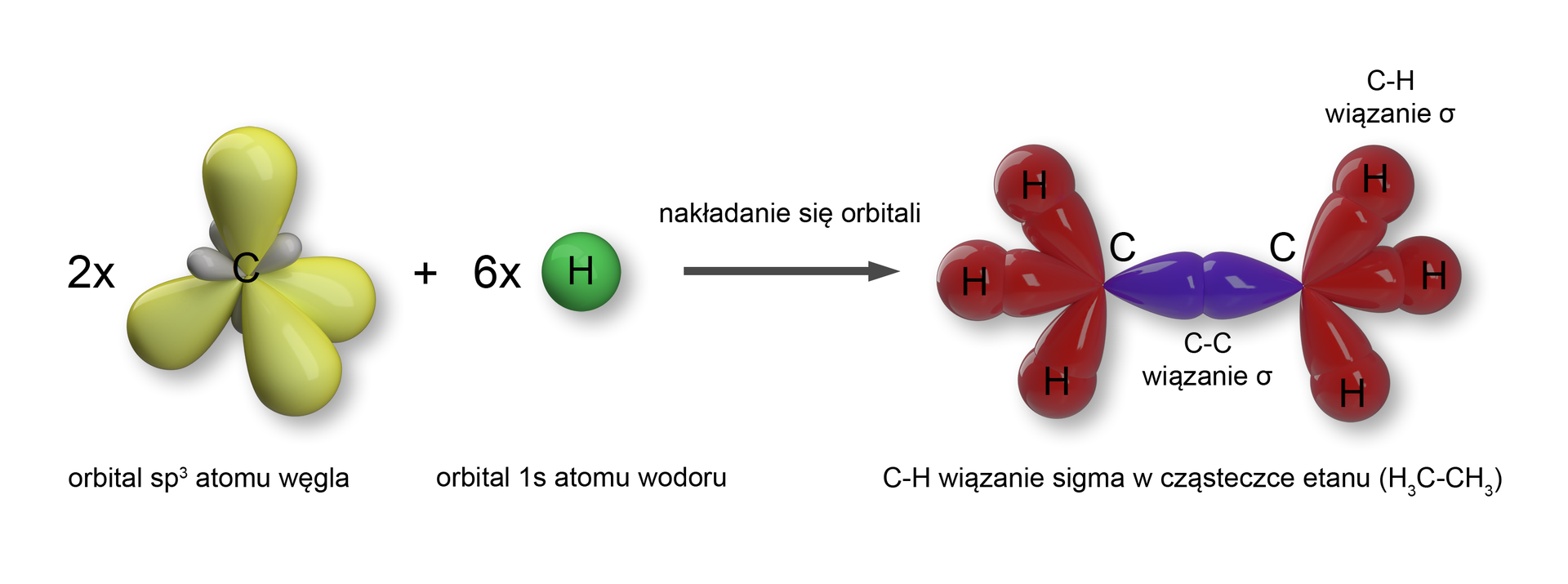
Wiązanie pojedyncze węgiel–węgiel w etanie powstaje poprzez nakładanie się pary orbitali zhybrydyzowanychorbitali zhybrydyzowanych atomów węgla. W ten sposób otrzymujemy pojedyncze wiązanie typu . Wiązanie to ma długość . Z kolei wiązania , pomiędzy atomem węgla a atomem wodoru, powstają przez nakładanie się orbitalu typu atomu węgla z orbitalem typu wodoru.
Ile wiązań sigma występuje w cząsteczce etanu?
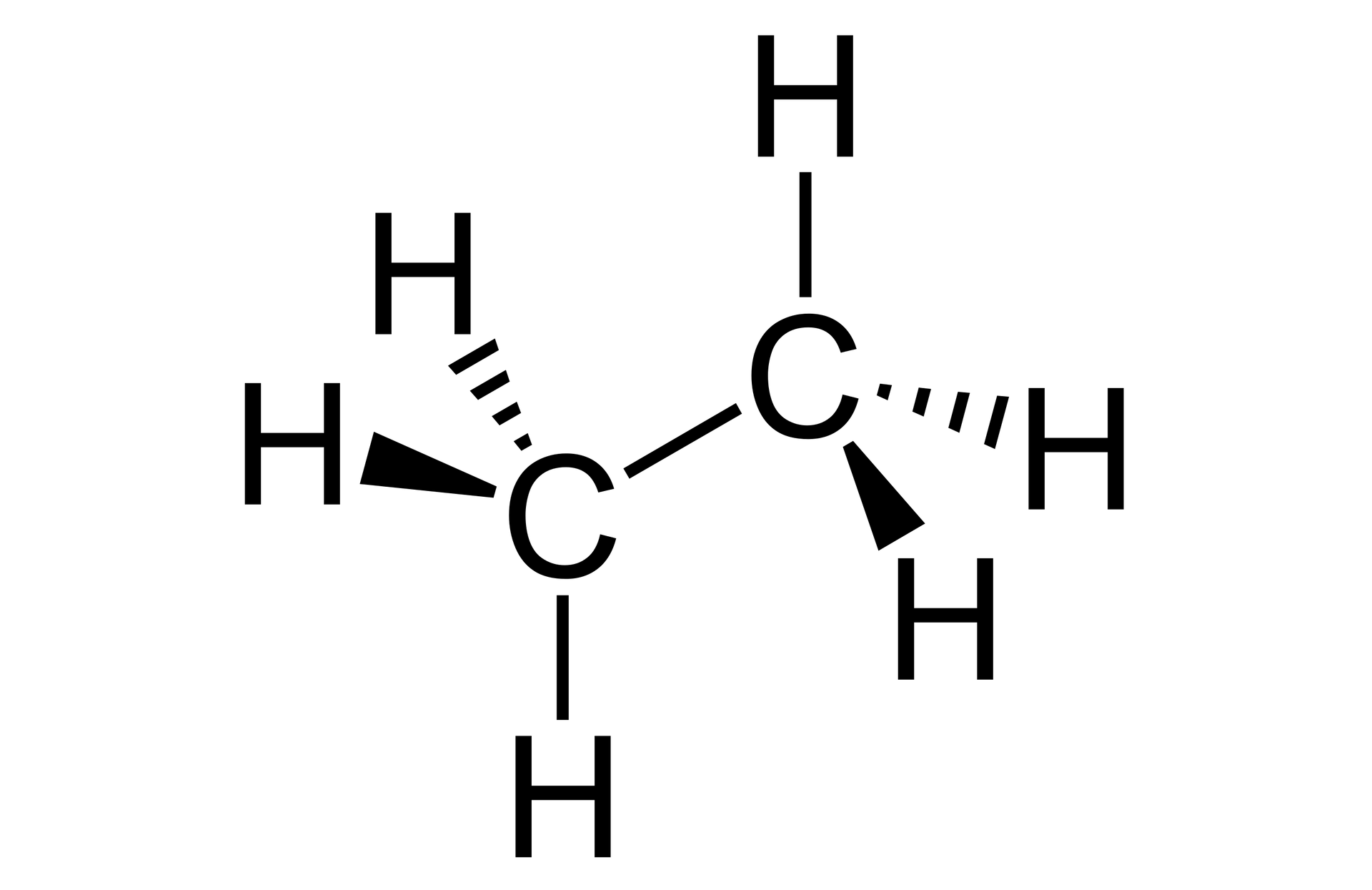
- 7
- 1
- 6
- 3
Wiązanie a wiązanie typu
Wiązania chemiczne można podzielić, biorąc pod uwagę liczbę elektronów, które łączą atomy. Wyróżniamy zatem:
wiązania pojedyncze – utworzone przez dwa elektrony – które są wiązaniami typu ;
wiązania wielokrotne (podwójne i potrójne) – utworzone przez więcej niż dwa elektrony – w których zawsze jedno z wiązań jest typu , a pozostałe (jedno lub dwa wiązania) to wiązania typu . Istotna różnica pomiędzy wiązaniem typu oraz wiązaniem typu to siła, z jaką wiążą się ze sobą atomy. Orbitale molekularne typu tworzą wiązania silniejsze od wiązań typu . Warto dodać, że wiązania typu powstają poprzez boczne nakładanie się orbitali atomowych, ale o tym dokładniej w innej części e‑podręcznika.
krotność wiązania pomiędzy atomami węglami | typ hybrydyzacji atomu węgla | rodzaj wiązań pomiędzy atomami węgla |
|---|---|---|
wiązanie pojedyncze, np. w cząsteczce etanu 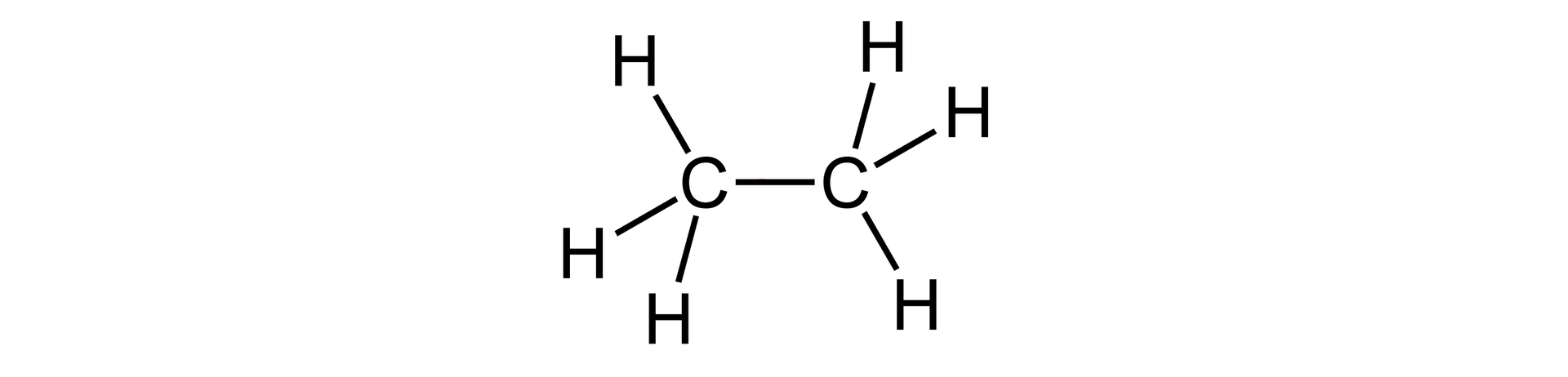 Wzór strukturalny etanu Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 1 wiązanie | |
wiązanie podwójne, np. w cząsteczce etenu 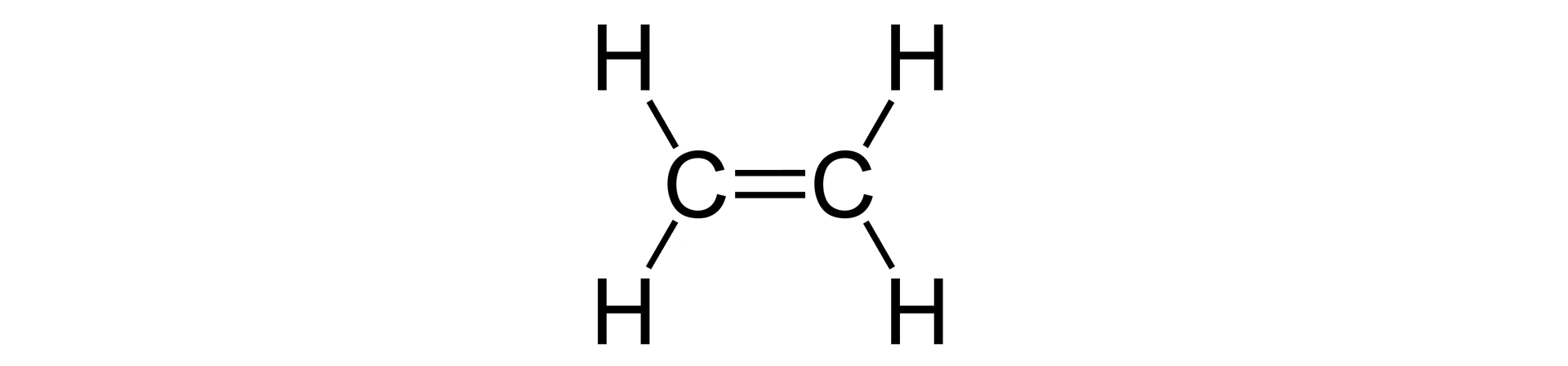 Wzór strukturalny etenu Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 1 wiązanie | |
wiązanie potrójne, np. w cząsteczce etynu  Wzór strukturalny etynu Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | 1 wiązanie |
Podsumowanie
Wiązanie jest wiązaniem utworzonym przez elektrony, które opisują kilka rodzajów orbitali molekularnych. Dla przykładu :
orbital molekularny – powstający poprzez czołowe nałożenie się dwóch orbitali (o kształcie sferycznym), występuje w cząsteczce .
orbital molekularny – powstający poprzez czołowe przenikanie się jednego orbitalu oraz jednego orbitalu , występuje w cząsteczce . Wiązanie , które tworzy ten typ orbitalu molekularnego, jest powszechne w związkach wodoru z pierwiastkami , i grupy układu okresowego.
orbital molekularny – powstający poprzez czołowe przenikanie się dwóch orbitali , tworzy wiązanie w cząsteczce .

Słownik
elektrony, które znajdują się na ostatniej (najbardziej zewnętrznej) powłoce atomu, tzw. powłoce walencyjnej
fundamentalna teoria fizyczna opisująca oddziaływanie mikroobiektów materii między sobą oraz z zewnętrznymi polami, głównie z polem elektromagnetycznym
funkcja falowa opisująca stan jednego elektronu w atomie (orbital atomowy) lub w cząsteczce (orbital molekularny, inaczej: cząsteczkowy)
powstają w przygotowaniu do tworzenia wiązania; są wynikiem mieszania się orbitali atomowych o różnych kształtach i energii
(łac. hybrida „mieszaniec”) w chemii kwantowej tworzenie kombinacji liniowych orbitali atomowych powłoki walencyjnej
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Czerwiński A., Czerwińska A., Jeziorna M., Kańska M., Chemia 3. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2004.
Encyklopedia PWN
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.