Przeczytaj
Twardość wody – rodzaje
Twardość wody związana jest w głównej mierze z występowaniem w wodzie soli wapnia i magnezu –twardość wapniowa (TIndeks dolny CaCa) i magnezowa (TIndeks dolny MgMg). Wyróżnia się także twardość węglanową (przemijającą) oraz twardość niewęglanową (trwałą). Twardość węglanowa (TIndeks dolny węglanowawęglanowa) jest spowodowana występowaniem w wodzie wodorowęglanów wapnia i magnezu. Twardość niewęglanowa (TIndeks dolny niewęglanowaniewęglanowa) związana jest z występowaniem w wodzie innych soli wapnia i magnezu, m.in. chlorków, azotanów, siarczanów.
Ogólną twardość wody TIndeks dolny ogog można zdefiniować na dwa sposoby.
Laboratoryjne oznaczanie twardości wody
Laboratoryjnie twardość wody można oznaczyć stosując miareczkowanie roztworem EDTA o znanym stężeniu. EDTA to kwas etylenodiaminotetraoctowy, nazywany także kwasem wersenowym. Związek ten tworzy z większością kationów, m.in. z kationami i , kompleksy w stosunku 1 : 1.
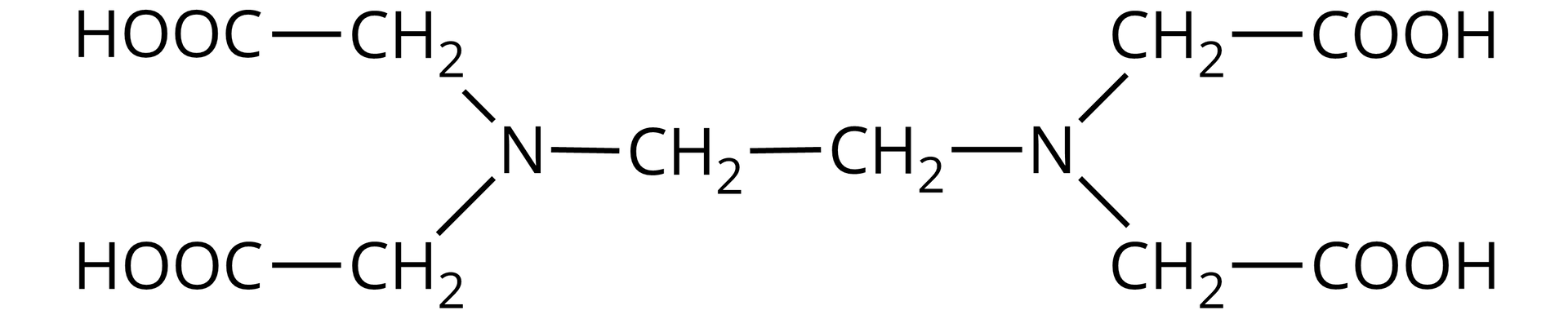
Kompleksy EDTA z jonami wapnia i magnezu są bezbarwne, dlatego miareczkowanie prowadzi się w obecności wskaźnika. Wskaźnik tworzy z oznaczanymi w próbce wody jonami barwne kompleksy. W oznaczaniu kationów wapnia i magnezu jako wskaźnik stosuje się czerń eriochromową T. Przy pH ≈ 10, czerń eriochromowa T tworzy z jonami i kompleksy o barwie czerwonej. Kompleksy wskaźnika z oznaczonymi jonami są mniej trwałe niż kompleksy z EDTA. W trakcie miareczkowaniamiareczkowania badanej próbki roztworem EDTA, kationy wapnia i magnezu łączą się z EDTA w trwały kompleks. Po skompleksowaniu przez EDTA wszystkich jonów wapnia i magnezu, czerń eriochromowa T zostaje uwolniona - przyjmuje niebieską barwę. Stąd po skompleksowaniu przez EDTA wszystkich jonów i obserwuje się zmianę barwy z czerwonej na niebieską. Znając objętość zużytego roztworu EDTA, można wyznaczyć twardość ogólną wody.

Oznaczanie twardości ogólnej
Wykonanie:
Napełnij biuretę roztworem kwasu wersenowego o stężeniu = 0,02 (do kreski oznaczonej 0 cmIndeks górny 33).
Do trzech kolb stożkowych o pojemności 250 cmIndeks górny 33 odmierz cylindrem miarowym 100 cmIndeks górny 33 badanej wody.
Do każdej kolby dodaj 5 cmIndeks górny 33 buforu amonowego (do uzyskania pH ≈ 10), a następnie szczyptę wskaźnika - czerni eriochromowej T (roztwory zabarwią się na czerwono).
Badane roztwory wody miareczkuj roztworem kwasu wersenowego dodając go kroplami z biurety (do roztworów w kolbach stożkowych). Po każdym dodaniu kropli EDTA, zawartość kolby należy zamieszać.
Miareczkowanie prowadź do zmiany barwy roztworu z czerwonej na niebieską.
Na biurecie odczytaj objętość użytego roztworu kwasu wersenowego z dokładnością do 0,05 cmIndeks górny 33. Wynik odpowiada sumarycznej zawartości jonów wapnia i magnezu w badanej próbce wody.
Obliczanie twardości ogólnej wody
Twardość ogólną badanej wody można obliczyć ze wzoru:
gdzie:
– twardość ogólna wody
– średnia wartość objętości roztworu EDTA uzyskana z trzech miareczkowań [cmIndeks górny 33]
– stężenie roztworu EDTA użytego do miareczkowania
– objętość badanej wody użytej do oznaczenia twardości [cmIndeks górny 33]
Twardość ogólna wody równa jest zawartości jonów wapnia i magnezu w badanej próbce. Ze względu na to, że kwas wersenowy tworzy z jonami kompleksy w stosunku 1 : 1, oznacza to, że liczba moli EDTA równa się liczbie moli jonów . Liczbę moli EDTA można wyznaczyć z iloczynu użytej w miareczkowaniu objętości kwasu wersenowego oraz stężenia EDTA . W celu wyznaczenia stężenia oznaczanych jonów należy liczbę moli jonów (czyli liczbę moli EDTA) podzielić przez objętość badanej próbki.
Stężenie oznaczanych jonów to twardość ogólna wody TIndeks dolny ogog. Jednostką twardości wody jest . Aby uzyskać tą jednostkę należy całe równanie pomnożyć przez 1000. Skąd ta wartość? Otóż, 1 mol to 1000 mmoli.
Z tych rozważań wynika, że końcowy wzór na twardość ogólną wody ma postać:
Oznaczanie ogólnej twardości wody oligoceńskiej, wodociągowej oraz przefiltrowanej o objętości 100 cmIndeks górny 33
Oblicz twardość ogólną wody TIndeks dolny ogog, jeżeli średnia wartość objętości 0,02 roztworu EDTA uzyskana z trzech miareczkowań wynosi:
dla wody oligoceńskiej 10,5 cm3
dla wody wodociągowej 12,5 cm3
dla wody przefiltrowanej 5,5 cm3
Laboratoryjne oznaczanie twardości ogólnej wody wykazało, że w tym przypadku woda oligoceńska oraz woda wodociągowa to woda średnio twarda. Otrzymane wartości mieszczą się w zakresie 2‑3,5 w skali twardości wody. Natomiast woda przefiltrowana to woda miękka, ponieważ zgodnie ze skalą twardości wody mieści się w zakresie 1‑2 .
Oznaczanie twardości wapniowej
Oznaczając twardość wapniową określa się stężenie jonów wapnia w badanej próbce wody. Badany roztwór należy zalkalizować poprzez dodanie roztworu wodorotlenku sodu do osiągnięcia pH ≈ 12. W tych warunkach strąca się wodorotlenek magnezu , w roztworze pozostają jony wapnia . Powstały osad nie przeszkadza w oznaczeniu zawartości jonów wapnia.
W celu oznaczenia zawartości jonów w badanej wodzie jako wskaźnik stosuje się mureksyd. Tworzy on z jonami wapnia nietrwały kompleks o różowej barwie. Po dodatku kwasu wersenowego, jony wapnia tworzą trwalszy kompleks łącząc się z EDTA. Mureksyd zostaje uwolniony od jonów . Wolny wskaźnik barwi się na fiołkowo (fioletowo).

Wykonanie:
Napełnij biuretę roztworem kwasu wersenowego o stężeniu = 0,02 (do kreski oznaczonej 0 cmIndeks górny 33).
Do trzech kolb stożkowych o pojemności 250 cmIndeks górny 33 odmierz cylindrem miarowym 100cmIndeks górny 33 badanej wody.
Do każdej kolby dodaj 3 cmIndeks górny 33 roztworu o stężeniu 0,2 , a następnie szczyptę wskaźnika – mureksydu (roztwory zabarwią się na różowo).
Badane roztwory wody miareczkuj roztworem kwasu wersenowego dodając go kroplami z biurety (do roztworów w kolbach stożkowych). Po każdym dodaniu kropli EDTA, zawartość kolby należy zamieszać.
Miareczkowanie prowadź do zmiany barwy roztworu z różowej na fiołkową.
Na biurecie odczytaj objętość użytego roztworu kwasu wersenowego z dokładnością do 0,05 cmIndeks górny 33. Wynik odpowiada zawartości jonów wapnia w badanej próbce wody.
Obliczanie twardości wapniowej
Kwas wersenowy tworzy z jonami wapnia kompleks w stosunku 1 : 1. Zatem liczba moli EDTA równa się liczbie moli jonów wapnia nIndeks dolny EDTAEDTA=nIndeks dolny jjIndeks dolny onów wapnia Indeks dolny konieconów wapnia. Liczbę moli EDTA można wyznaczyć z iloczynu użytej w miareczkowaniu objętości kwasu wersenowego oraz stężenia EDTA.W celu wyznaczenia stężenia oznaczanych jonów wapnia należy liczbę liczbę moli EDTA podzielić przez objętość badanej próbki.
Stężenie oznaczanych jonów wapnia to twardość wapniowa wody TIndeks dolny CaCa. Aby uzyskać jednostkę twardości wapniowej wody (mmol/dmIndeks górny 33) należy całe równanie pomnożyć przez 1000. Skąd ta wartość? Otóż, 1 mol to 1000 mmoli.
Twardość wapniową badanej wody można obliczyć ze wzoru:
gdzie:
– twardość wapniowa wody
– średnia wartość objętości roztworu EDTA uzyskana z trzech miareczkowań [cmIndeks górny 33]
– stężenie roztworu EDTA użytego do miareczkowania
– objętość badanej wody użytej do oznaczenia twardości [cmIndeks górny 33]
Oznaczanie twardości wapniowej wody wodociągowej o objętości 100 cmIndeks górny 33
Oblicz twardość wapniową wody wodociągowej, jeżeli średnia wartość objętości 0,02 roztworu EDTA uzyskana z trzech miareczkowań wynosi 9 cmIndeks górny 33.
Rozwiązanie
Odpowiedź
Twardość wapniowa wody wodociągowej wynosi 1,8 .
Oznaczanie twardości magnezowej
Mając wyznaczoną twardość ogólną wody oraz twardość wapniową wody, można wyznaczyć twardość magnezową.
Oblicz twardość magnezową wody wodociągowej. Dane dotyczące twardości ogólnej wody wodociągowej uzyskasz z Przykładu 1, zaś twardości wapniowej z Przykładu 2.
Rozwiązanie
Odpowiedź
Twardość magnezowa wody wodociągowej wynosi 0,7 .
Słownik
technika polegająca na dodawaniu z biurety roztworu o znanym stężeniu do naczynia zawierającego roztwór badany; pozwala określić stężenie badanej substancji
Bibliografia
Minczewski J., Marczenko Z., Chemia analityczna. Chemiczne metody analizy ilościowej 2, Warszawa 2009.
Woda Oligoceńska, woda z kranu czy woda z filtra?, online: http://smacznawoda.pl/woda_oligocenska.php?menu=6&lp=5, dostęp: 29.04.2021.
https://akwa‑filtry.pl/twardosc‑wody/