Przeczytaj
Podział tlenków azotu
Azot tworzy z tlenem kilka tlenków, w których występuje na kilku różnych stopniach utlenieniastopniach utlenienia. Tlenki azotu mają charakter kwasowy albo obojętny, w zależności od stopnia utlenienia azotu w związku, co prezentuje poniższy schemat.

Tlenek azotu(I) (tlenek diazotu),
W temperaturze pokojowej jest to bezbarwny gaz o słodkawym zapachu i smaku, kiedyś stosowany jako środek znieczulający (gaz rozweselający) w zabiegach dentystycznych.
Otrzymywany w wyniku łagodnego ogrzewania azotanu(V) amonu ():
Rozkłada się z wydzieleniem tlenu, dzięki czemu podtrzymuje palenie. nie reaguje z wodą, ale się w niej rozpuszcza, tworząc roztwór obojętny. Tlenek diazotu należy do głównych gazów cieplarnianych. Będąc trzecim najważniejszym długotrwałym gazem cieplarnianym przyczynia się do powstawania dziury ozonowej i efektu cieplarnianego.
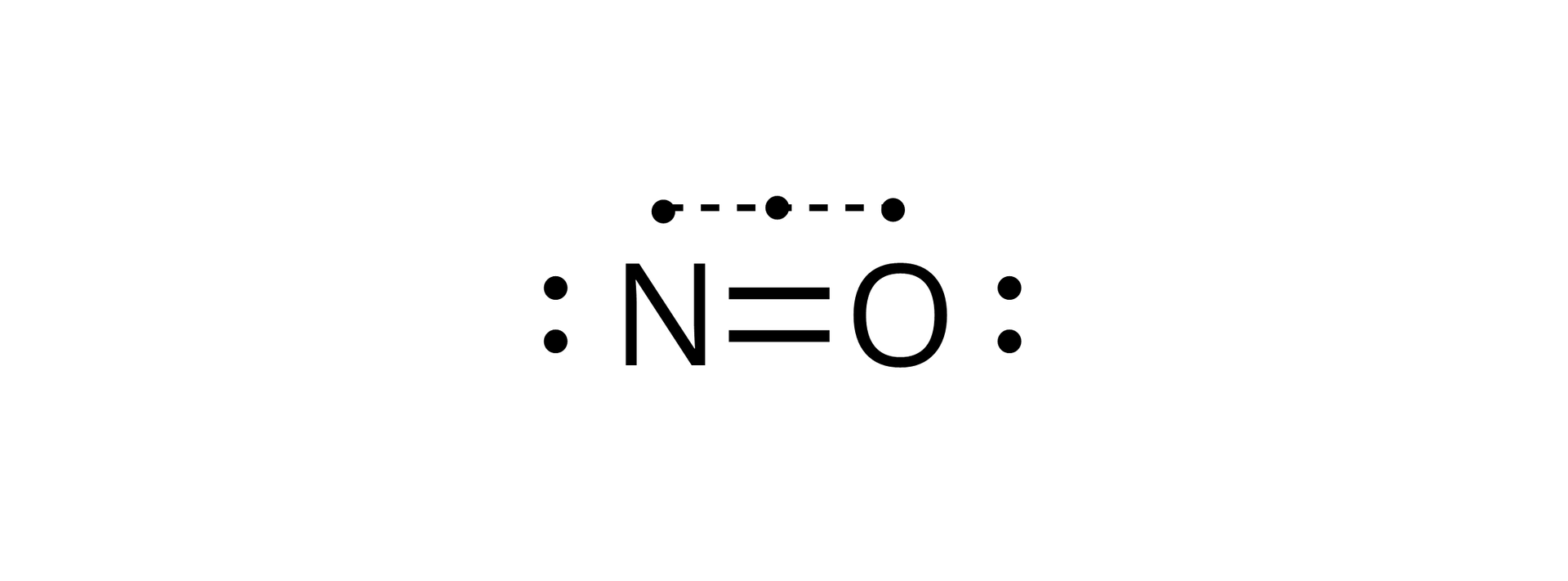
Tlenek azotu(II) (monotlenek azotu),
Jest to bezbarwny gaz, trudny do skroplenia (temperatura wrzenia –151°C). Łatwo utlenia się do , wraz z którym stanowi produkt przejściowy w produkcji kwasu azotowego(V). Z uwagi na jeden niesparowany elektron na atomie azotu jest rodnikiemrodnikiem niestabilnym i bardzo reaktywnym.
W powietrzu samorzutnie reaguje z tlenem, tworząc trujący tlenek azotu(IV).
W stanie ciekłym i stałym tlenek ten tworzy dimerydimery, co zmniejsza jego reaktywność.
Tlenek azotu(II) można otrzymać na drodze bezpośredniej syntezy z pierwiastków w wysokiej temperaturze, możliwej do osiągnięcia podczas wytworzenia łuku elektrycznego.

Na skalę przemysłową można otrzymać metodą katalitycznego spalania amoniaku (tzw. metoda Ostwalda).
W warunkach laboratoryjnych otrzymywany jest z kwasu azotowego(III). Kwas ten jest stabilny w roztworach rozcieńczonych. W miarę wzrostu jego stężenia lub na skutek ogrzewania, rozkłada się na kwas azotowy(V), tlenek azotu(II) oraz wodę.
Tlenek azotu(II) można również otrzymać, działając rozcieńczonym kwasem azotowym(V) na wiórki miedzi.

Tlenek azotu(II) odgrywa ważną rolę w organizmach żywych. Zbadano, że jest produktem przemiany materii w komórkach bakterii. W wyniku jego działania dochodzi do rozkurczu mięśni gładkich naczyń krwionośnych; ponadto hamuje zlepianie się płytek krwi, ma wpływ na funkcje ośrodkowego układu nerwowego (m.in. na procesy uczenia, pamięci, mechanizm drgawek, procesy neurodegeneracyjne). Leki, będące donorami , stosowane w walce z chorobami serca, jak dusznica bolesna, niewydolność mięśnia sercowego, wpływają rozkurczająco na naczynia krwionośne, obniżają ciśnienie tętnicze krwi. Za wyjaśnienie roli w układzie sercowo‑naczyniowym w 1998 r. Nagrodę Nobla otrzymali: R. Furchgott, L.J. Ignarro i F. Murad.
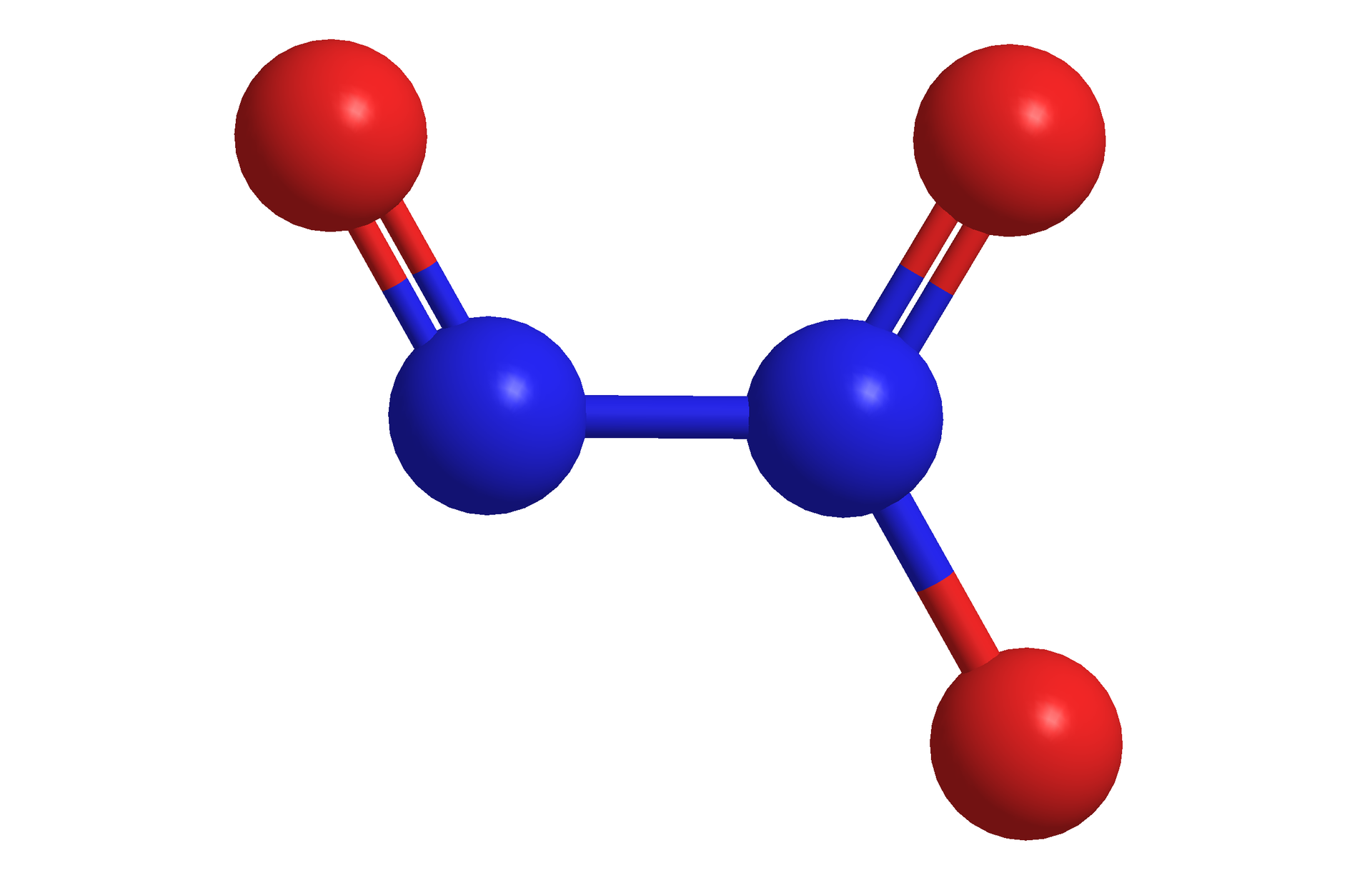
Tlenek azotu(III) (tritlenek diazotu),
Należy do tlenków bardzo nietrwałych, z tego powodu w postaci czystej nie znajduje żadnych praktycznych zastosowań.
Można go otrzymać w postaci intensywnie niebieskiej cieczy, w temperaturze niższej niż -13,5°C, w reakcji:
W temperaturze wyższej niż -13,5°C tlenek azotu(III) częściowo się rozkłada na i , przez co barwa zmienia się na jasnożółtą.
Jest bezwodnikiem kwasu azotowego(III).
Tlenek azotu(IV) (ditlenek azotu) –
Jest to brunatny gaz o charakterystycznym zapachu. Jest dobrze rozpuszczalny w wodzie.
Na skalę techniczną otrzymuje się go po zmieszaniu tlenku azotu(II) i tlenu, zgodnie z równaniem reakcji:
Innymi sposobami tlenek ten można otrzymać w wyniku rozkładu stężonego kwasu azotowego(V), redukcji miedzi za pomocą stężonego kwasu azotowego(V) albo w wyniku rozkładu termicznego azotanu(V) ołowiu(II), zgodnie z przedstawionymi równaniami reakcji:
Tlenek azotu(IV) jest tlenkiem kwasowym i w reakcji z wodą tworzy równomolową mieszaninę kwasu azotowego(III) i kwasu azotowego(V).
Tlenek azotu(IV) w temperaturze poniżej 147°C spontanicznie dimeryzuje, tworząc dimer – gaz o słomkowej barwie:
Ze spadkiem temperatury stopień dimeryzacji rośnie.

Tlenek azotu(IV) powoduje podrażnienie układu oddechowego, oczu i kaszel. Ze względu na właściwości utleniające, powoduje utlenienie zawartego w hemoglobinie do , w efekcie czego hemoglobina traci zdolność do przenoszenia tlenu. Odpowiada on także za barwę smogu.
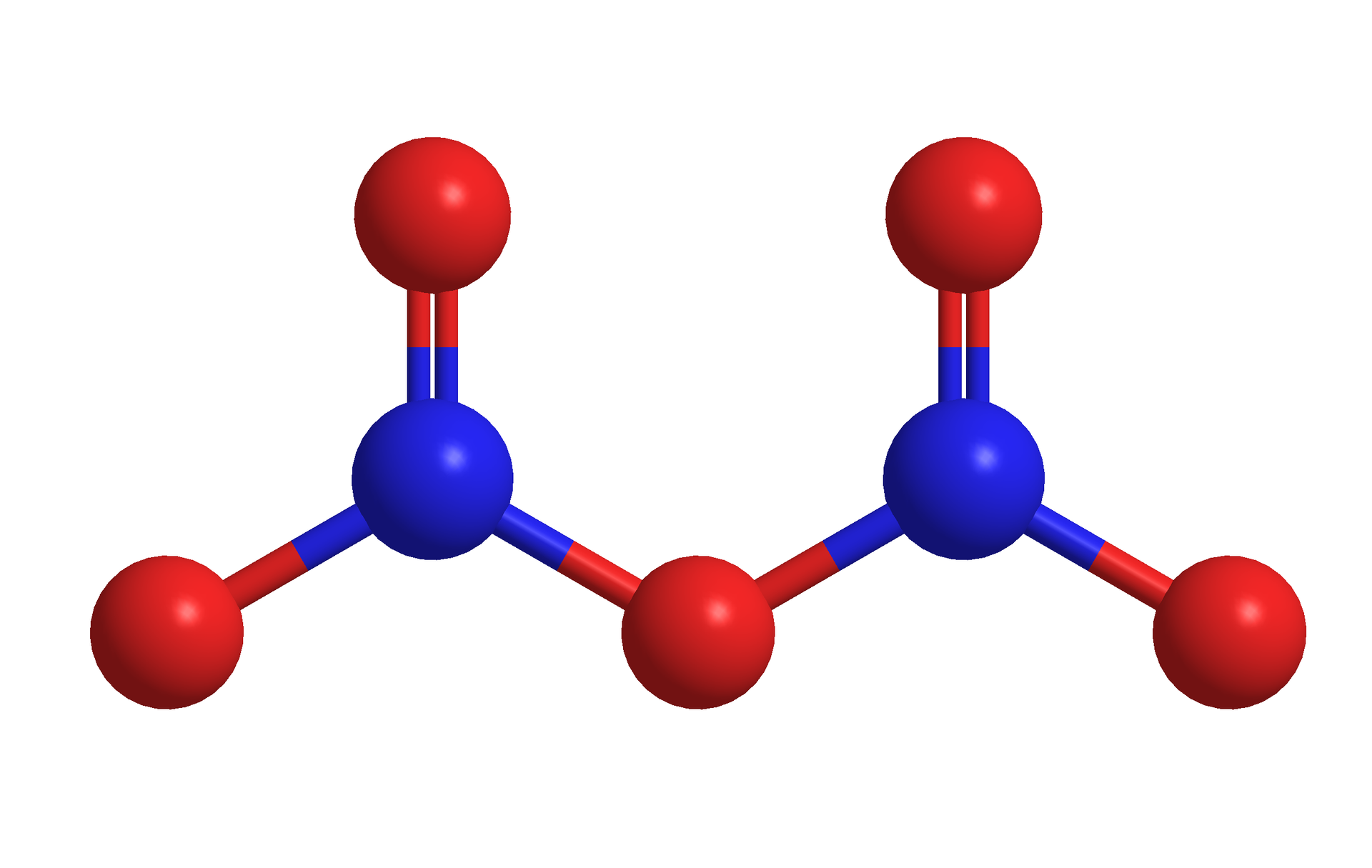
Tlenek azotu(V) (pentatlenek diazotu) –
W temperaturze pokojowej przyjmuje formę białych kryształków rozpuszczalnych w wodzie.
Powstaje przez odwodnienie kwasu azotowego(V) za pomocą tlenku fosforu(V) w temperaturze pokojowej. Równanie reakcji otrzymywania tlenku azotu(V):
Jest związkiem nietrwałym, rozkładającym się spontanicznie w temperaturze pokojowej do dwutlenku azotu i tlenu. Związek ten reaguje gwałtownie z wodą, jest bezwodnikiem kwasu azotowego. Ze względu na jego nietrwałość nie znajduje on w formie czystej praktycznych zastosowań.
Oprócz tlenków, opisanych w tekście, w pewnych warunkach można otrzymać:
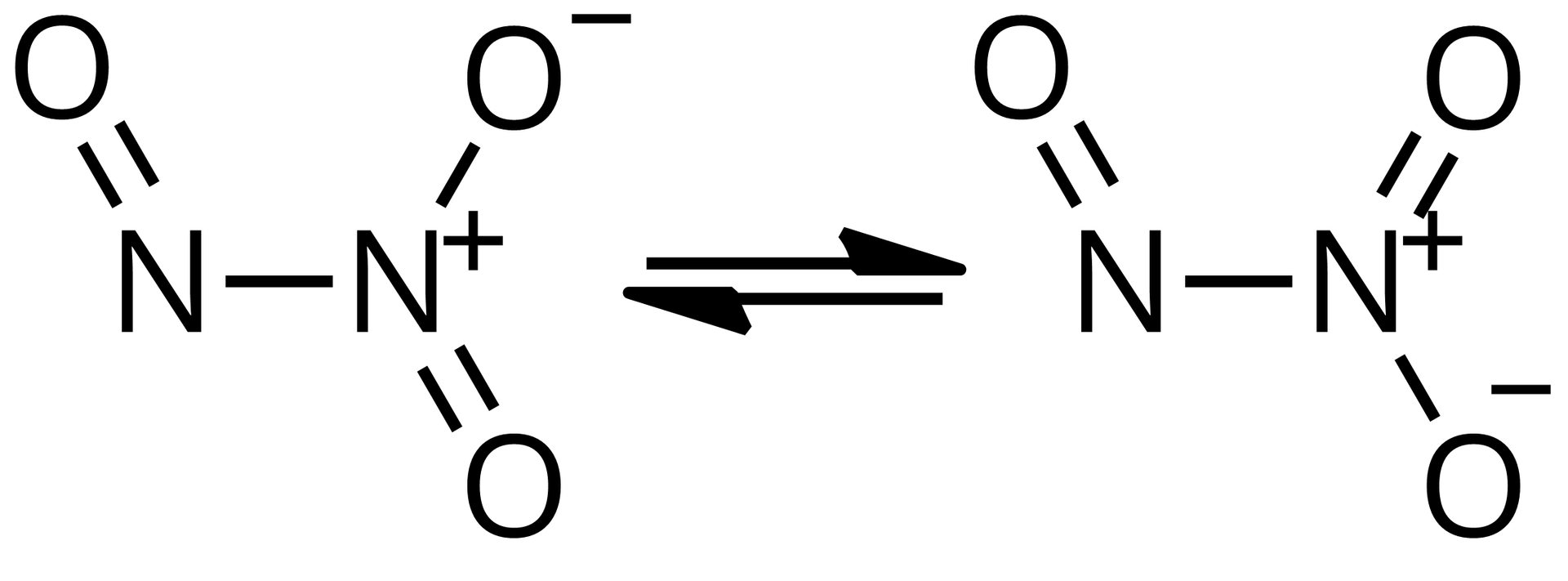
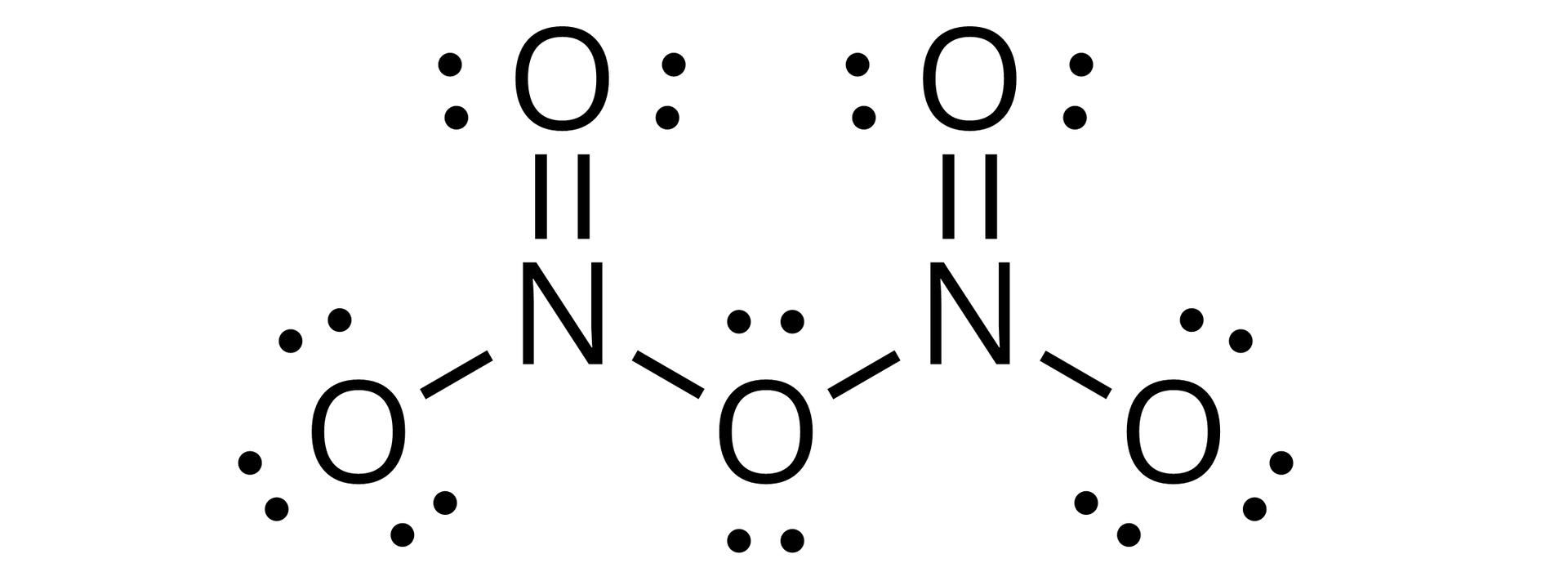
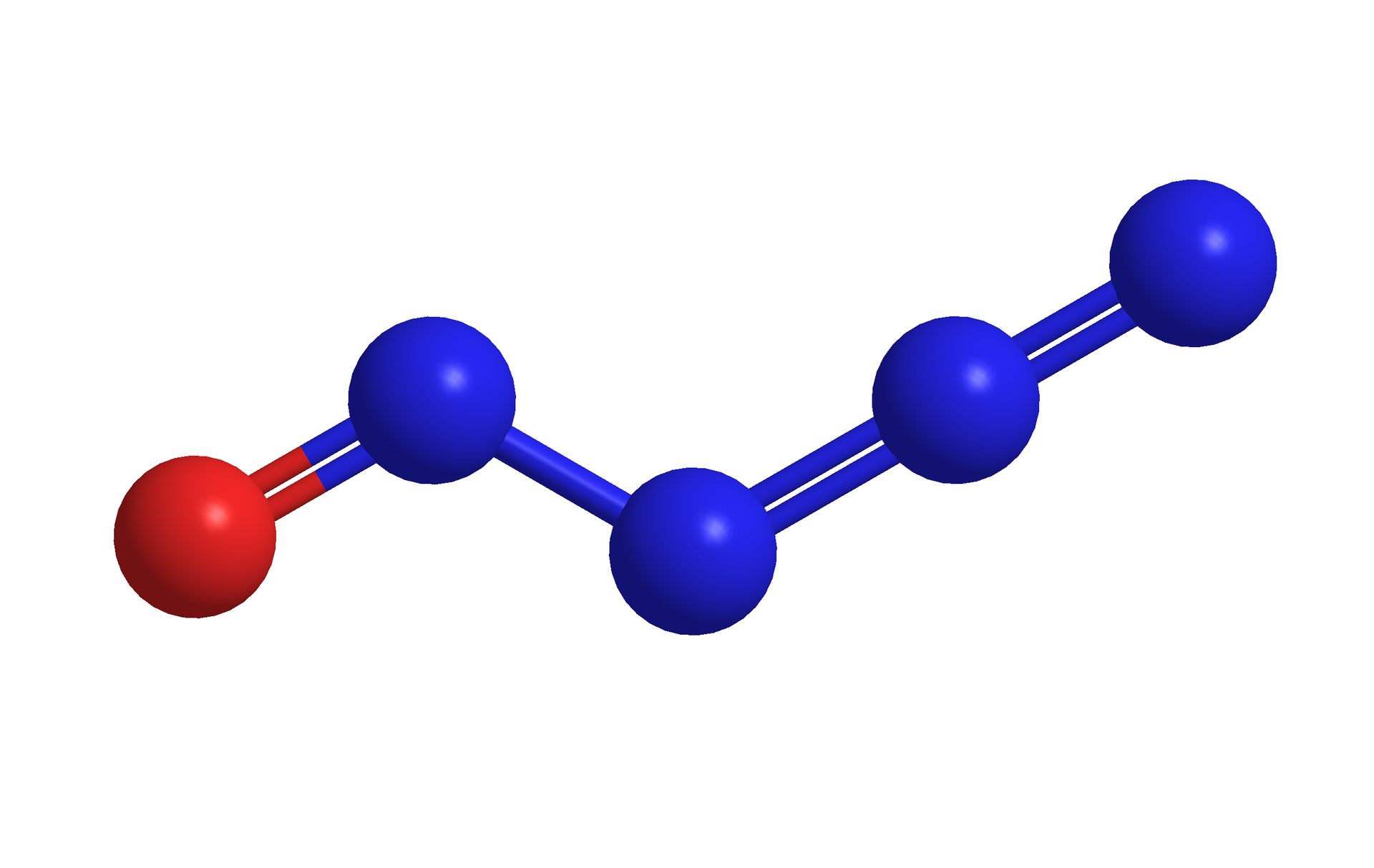
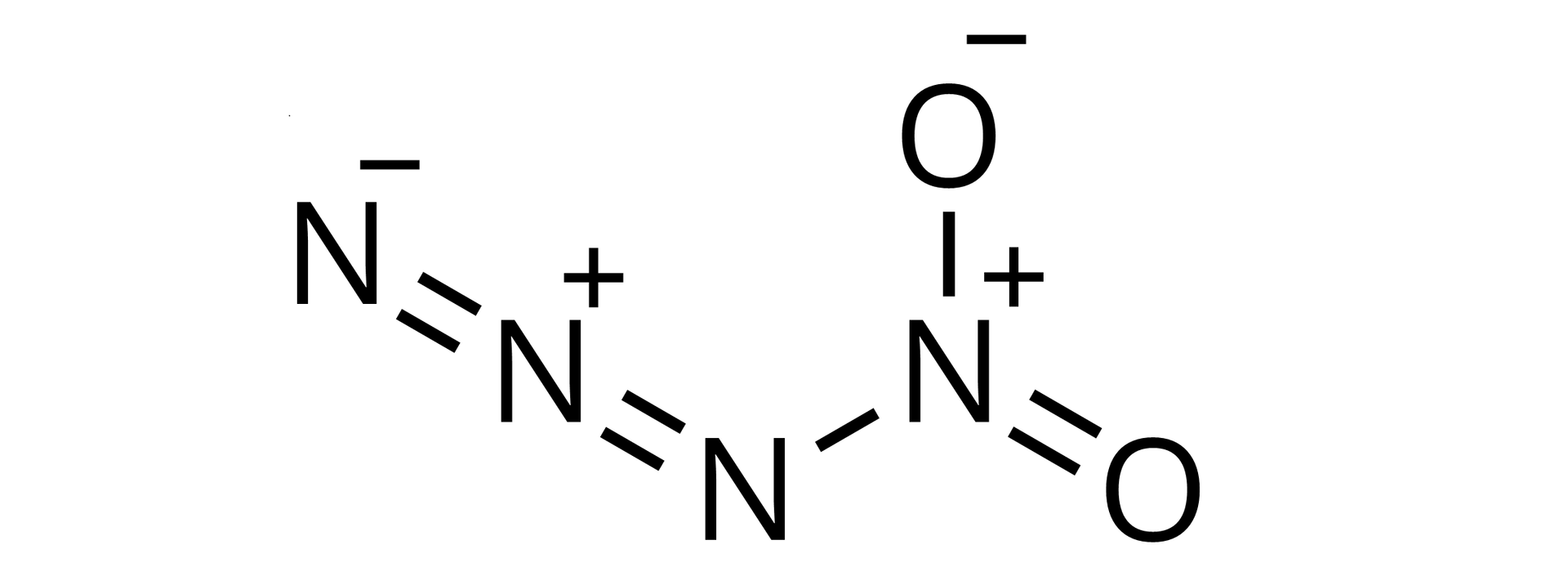
1. Azydek nitrozylu – trwały w temperaturze poniżej -33°C. Po raz pierwszy syntezę nitrozyladyzu opisano w 1958 r. Otrzymano go w reakcji azydku sodu z chlorkiem nitrozylu, w temperaturze poniżej −50°C.
2. Azydek nitroilu - trwały w temperaturze poniżej -10°C.
Słownik
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego, wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
cząsteczka utworzona w wyniku połączenia się dwóch takich samych cząsteczek prostych (monomerów)
atom, cząsteczka lub jon, zawierający co najmniej jeden niesparowany elektron
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, Tom 2, Warszawa 2010.
Klapötke T.M., Schulz A., Tornieporth‑Oetting C., Studies of the Reaction Behavior of Nitryl Compounds Towards Azides: Evidence for Tetranitrogen Dioxide, NIndeks dolny 44OIndeks dolny 22, Chem. Ber. 127 (1994) 2181–2185.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum - poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.