Przeczytaj
Hydraty
HydratyHydraty (inaczej wodziany) to związki uwodnione. Słowo „hydrat” jest terminem stosowanym w chemii zarówno nieorganicznej, jak i organicznej.
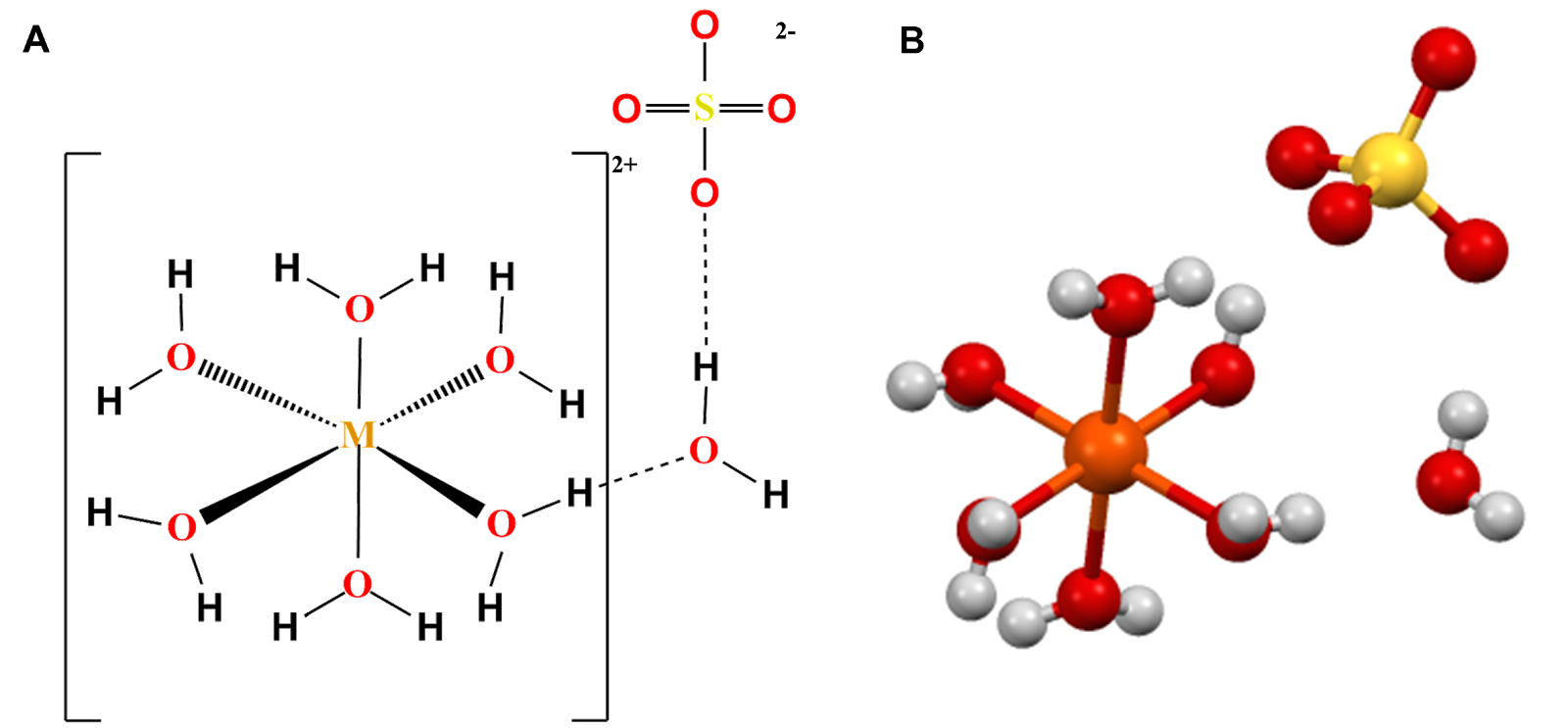
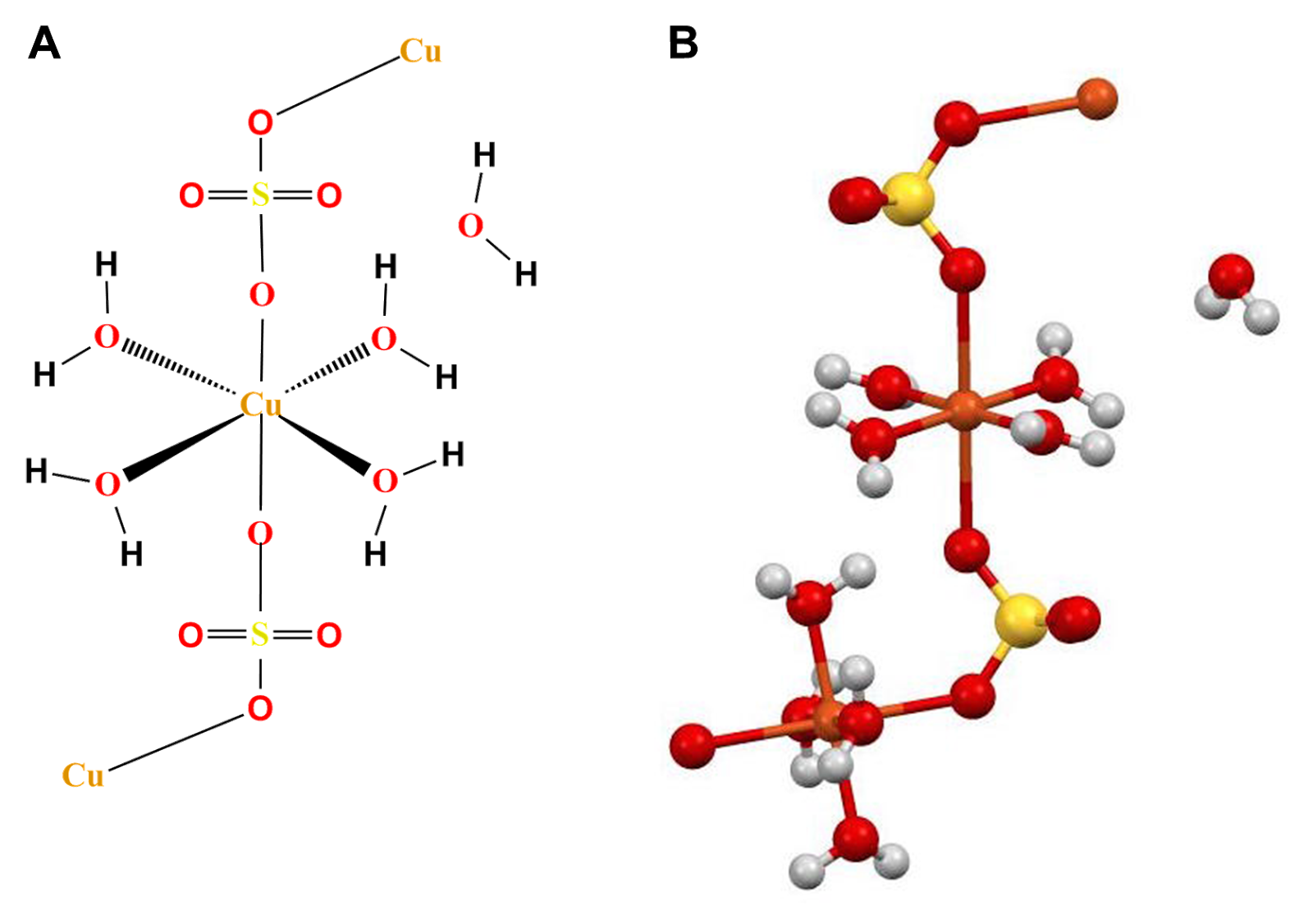
Tzw. sole uwodnione, jak wszystkie sole o budowie jonowej, są zbudowane z kationu metalu (jonu centralnego) oraz anionu reszty kwasowej. Dodatkowo w swojej sieci krystalicznejsieci krystalicznej zawierają cząsteczki wody, zwane wodą krystalizacyjnąwodą krystalizacyjną. Ze względu na obecność cząsteczek wody w sieci krystalicznej, można się spotkać z takimi określeniami hydratów jak wodziany czy też sole uwodnione. Cząsteczki wody w hydratach mogą być związane na różne sposoby: przyłączone do kationu i anionów soli za pomocą wiązań wodorowych, przyłączone wiązaniem koordynacyjnym do jonu centralnego lub pochłonięte (zamknięte) wewnątrz sieci krystalicznej. Hydraty powstają w wyniku pochłonięcia wody przez substancje higroskopijnesubstancje higroskopijne lub w trakcie krystalizacji z roztworów wodnych.
Poza solami hydraty tworzą również niektóre związki organiczne – takie jak na przykład kofeina, niektóre wodorotlenki – przykładowo wodorotlenek baru oraz chlor i brom krystalizując w niskiej temperaturze z ich wodnych roztworów i .
Co oznacza kropka we wzorze hydratu?
Nazwy systematyczne hydratów tworzy się, podając nazwę systematyczną związku chemicznego, następnie dodaje się pauzę i wyraz „woda” oraz (w nawiasie okrągłym) stosunek liczby moli soli do liczby moli cząstczek wody w tym związku.
Wzór sumaryczny hydratu:
Nazwa systematyczna: siarczan() miedzi() — woda (), co czytamy jako: siarczan() miedzi() woda jeden do pięć.
Kropka we wzorze nie ma nic wspólnego ze znakiem mnożenia. W podanym przykładzie oznacza, że na mol siarczanu() miedzi() w sieci krystalicznej przypada moli cząsteczek wody.
Ta sama substancja może tworzyć kilka hydratów, np. węglan sodu tworzy m.in. hydraty:
jednowodny (), węglan sodu — woda ();
siedmiowodny (), węglan sodu — woda ();
dziesięciowodny (), węglan sodu — woda ().
Przykłady hydratów
Barwy hydratów
Bezwodny chlorek kobaltu() – , ma barwę niebieską. Chłonąc wodę z powietrza, przechodzi w hydrat o barwie różowej, a następnie w inny hydrat , o czerwonym zabarwieniu. W laboratoriach używane są papierki kobaltowe, które służą do wykrywania obecności wody w różnych preparatach. Jest to możliwe, gdyż pod wpływem wilgoci papierek zmienia barwę z niebieskiej na różową lub czerwoną.

Wykonaj doświadczenie, podczas którego zbadasz właściwości hydratu siarczanu() miedzi() – woda(). W tym celu wsyp do probówki niewielką ilość hydratu. Następnie zawartość probówki ogrzej w płomieniu palnika. Próbkę hydratu nanieś na jedno szkiełko zegarkowe, a na drugie otrzymany w wyniku ogrzewania produkt. Porównaj ze sobą obie substancje. Zanotuj obserwacje i wyciągnij wnioski. Na koniec na otrzymany w wyniku ogrzewania produkt nanieś kilka kropli wody. Zapisz obserwacje i wnioski.
Zaprojektuj doświadczenie, podczas którego można zbadać właściwości hydratu siarczanu() miedzi() – woda(). W tym celu należy wsypać do probówki niewielką ilość hydratu. Następnie zawartość probówki trzeba ogrzać w płomieniu palnika. Próbkę hydratu nanieść na jedno szkiełko zegarkowe, a na drugie otrzymany w wyniku ogrzewania produkt. Zanotuj przewidywane obserwacje i wyciągnij wnioski. Na koniec na otrzymany w wyniku ogrzewania produkt należy nanieść kilka kropli wody. Zapisz obserwacje i wnioski.
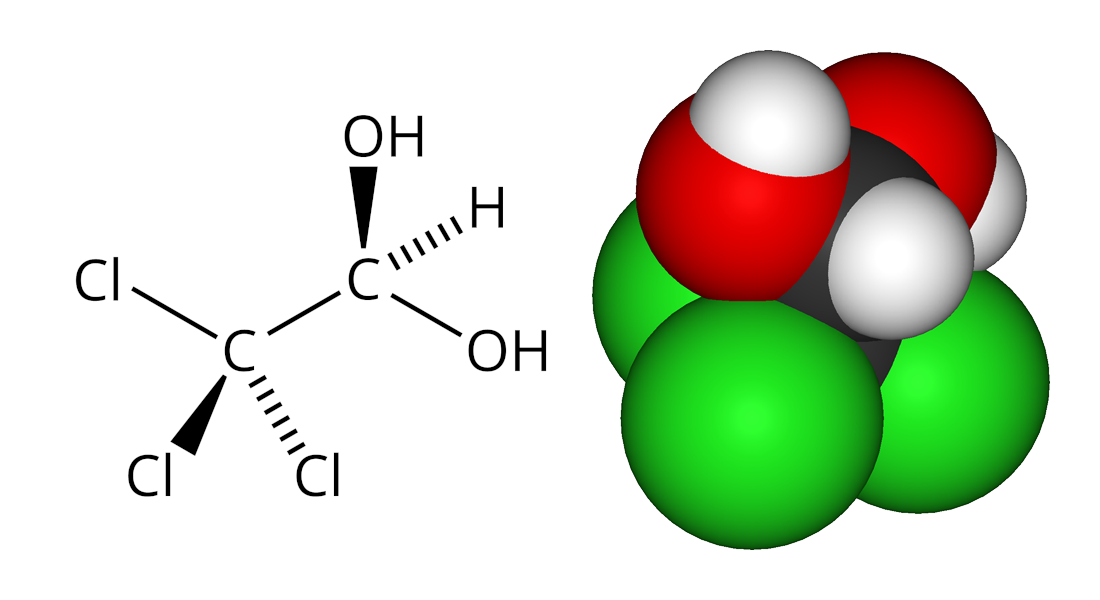
W chemii organicznej hydratem jest każdy związek chemiczny otrzymany na skutek reakcji addycjiaddycji wody. Przykładem jst wodzian chloralu, który powstaje na skutek addycji cząsteczki wody do aldehydu trichlorooctowego (chloralu).
Słownik
związki uwodnione (inaczej wodziany), zawierające cząsteczki wody wbudowane w sieć krystaliczną
substancje zdolne do pochłaniania wody oraz pary wodnej
charakterystyczny dla danego kryształu układ jonów, atomów lub cząsteczek
uwodnione sole siarczanowe() metali dwuwartościowych
woda występująca w postaci oddzielnych cząsteczek w kryształach hydratów
(łac. additio „dodawanie”) reakcja przyłączania; polega na przyłączaniu atomów lub cząsteczek związku chemicznego z utworzeniem cząsteczki jednego produktu (adduktu)