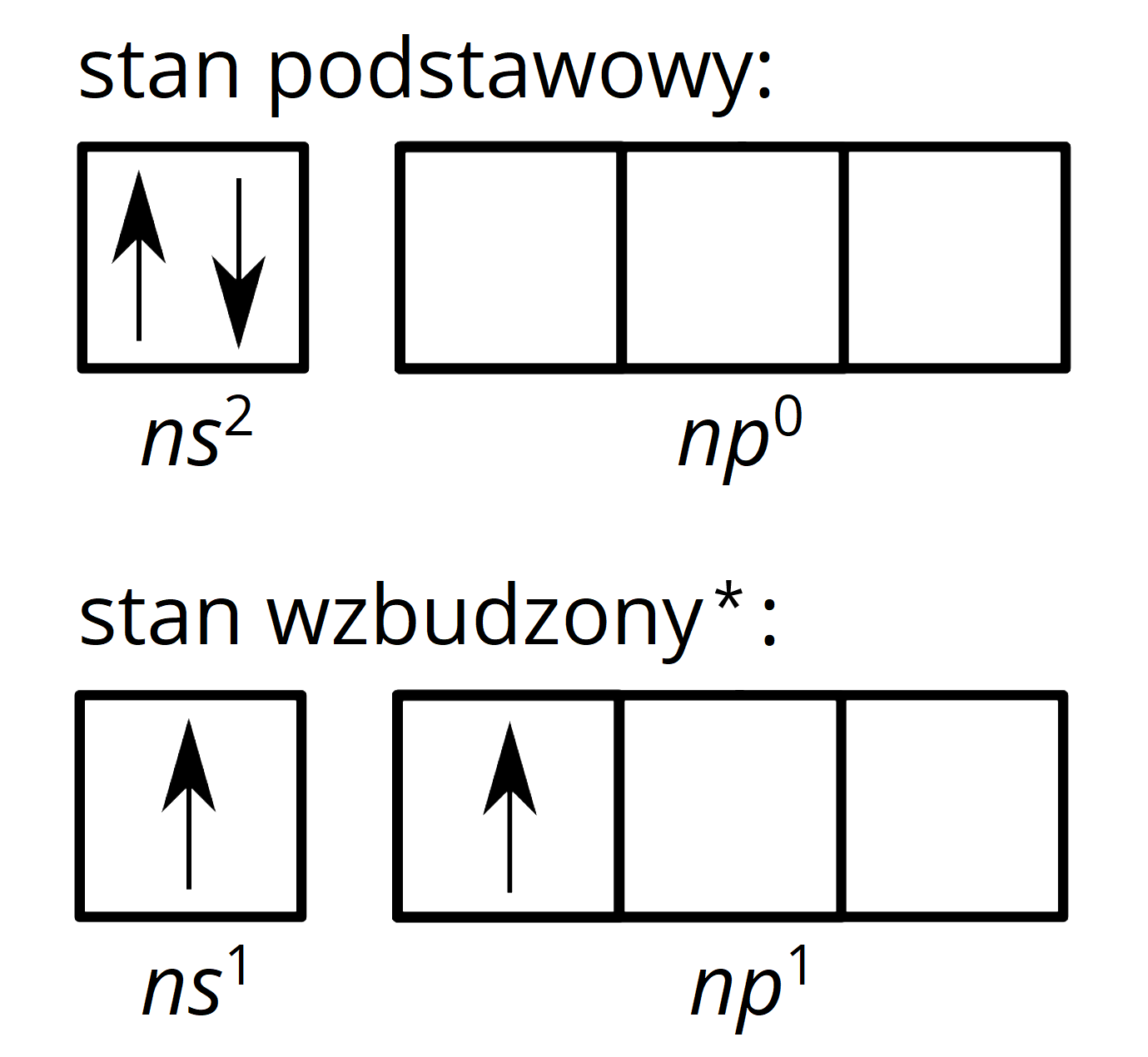Przeczytaj
Kiedy powstają orbitale typu ?
Pierwszy aspekt, który należy ująć przy omawianiu zjawiska hybrydyzacjihybrydyzacji typu , to rodzaj oraz ilość orbitaliorbitali atomowych. Orbitale „mieszają się” i tworzą nowe, tzw. orbitale zhybrydyzowaneorbitale zhybrydyzowane. Jak podają źródła, w hybrydyzacji typu dochodzi do wymieszania jednego orbitalu typu oraz jednego orbitalu typu , w wyniku czego powstają dwa zhybrydyzowane orbitale typu .
Patrząc na powyższe równanie, warto odpowiedzieć na kilka pytań...
Jaka powinna być konfiguracja elektronowa atomu w stanie podstawowymstanie podstawowym i stanie wzbudzonymstanie wzbudzonym, aby orbitale wymieszały się w zaprezentowany powyżej sposób?
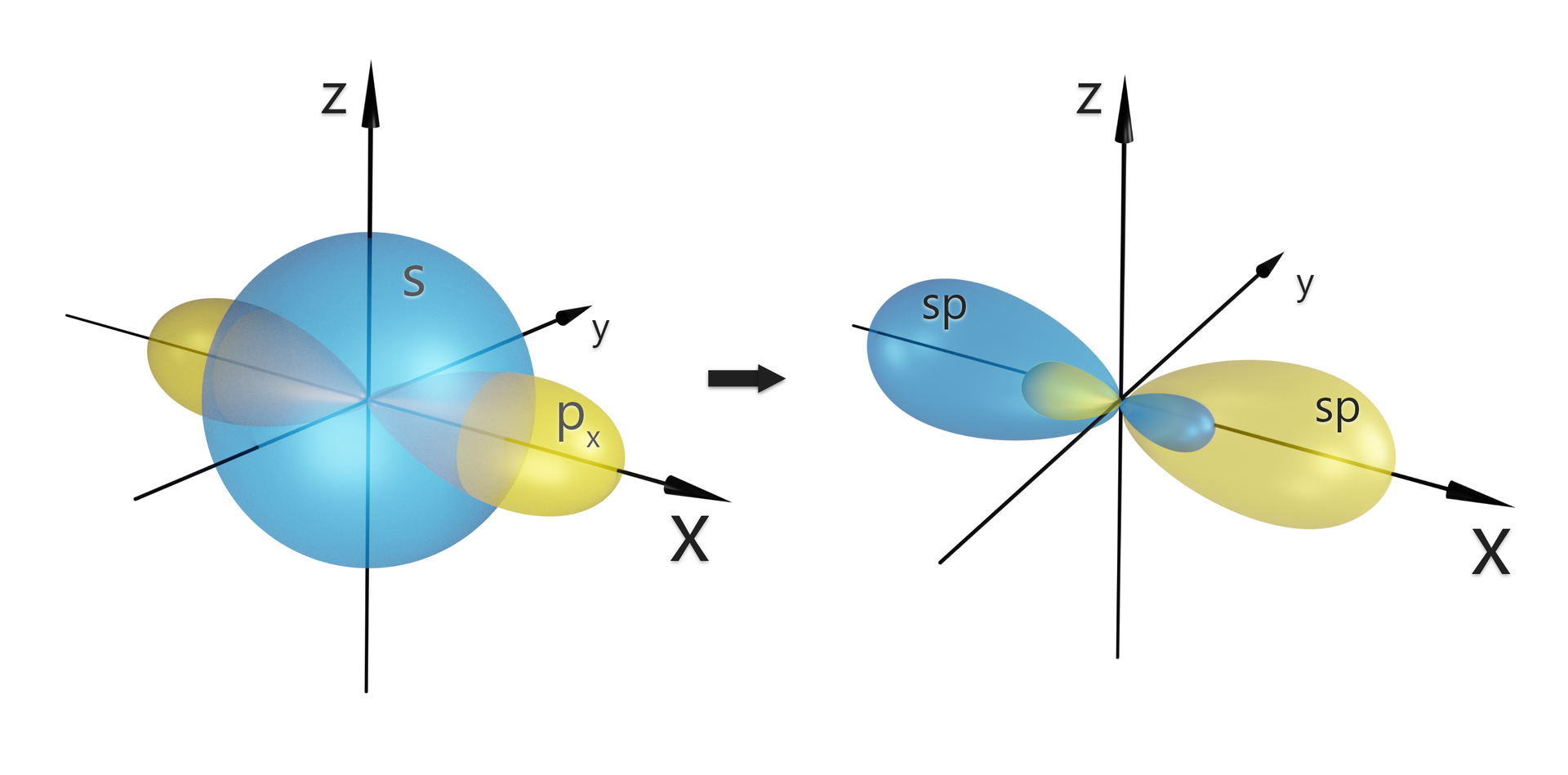
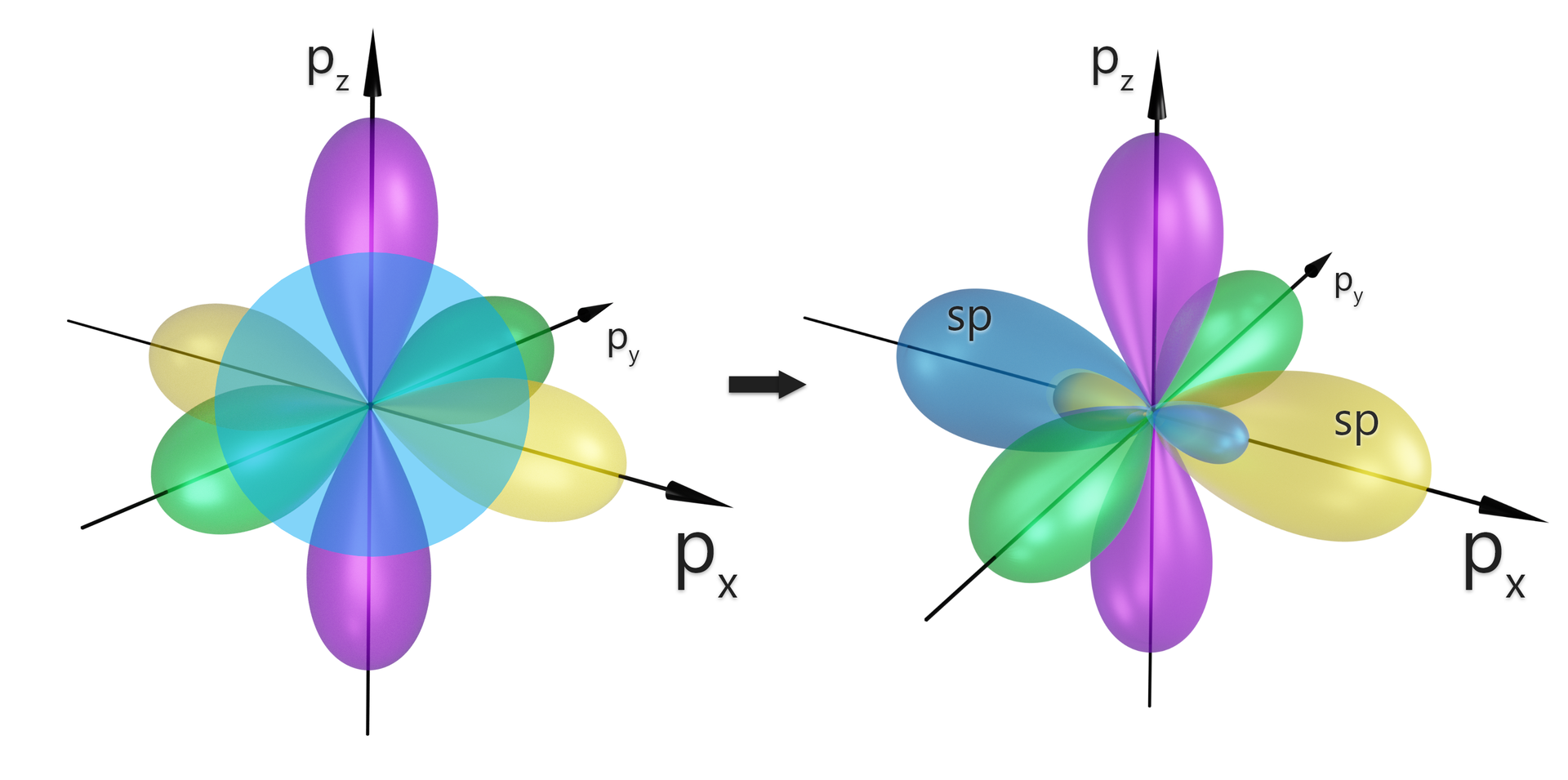
Jak ukazano na rysunkach, hybrydyzacji ulegają orbital oraz orbital , zawierające elektrony w stanie wzbudzonym. Dwa orbitale typu ( i ) pozostają niezhybrydyzowane.
Hybrydyzacja... i co dalej?
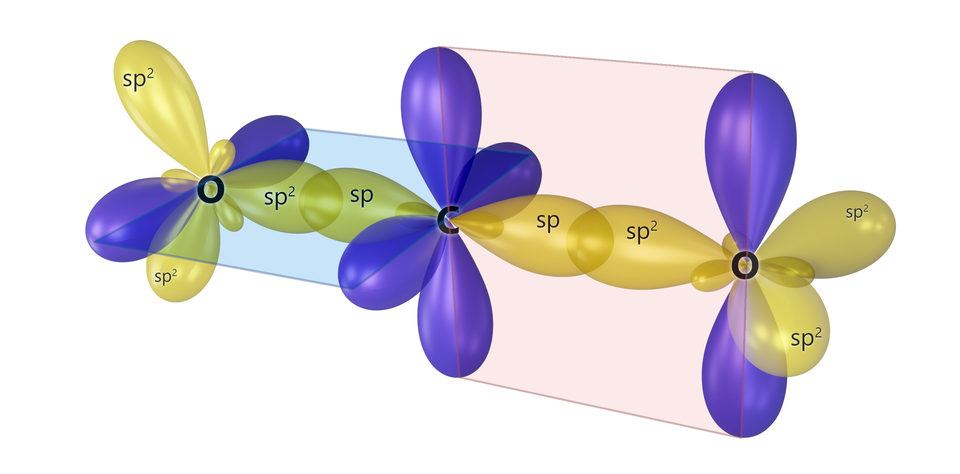
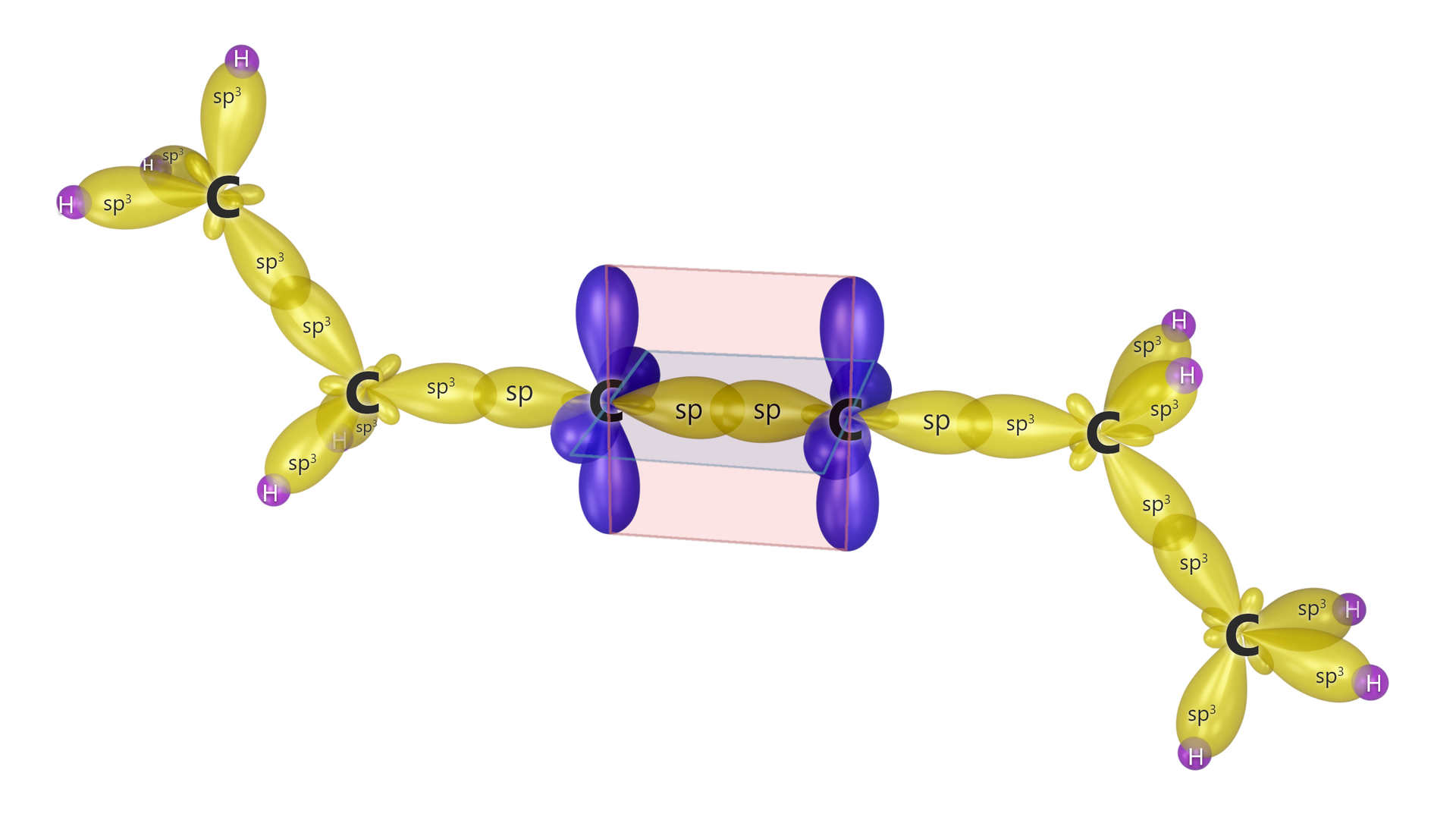
Orbitale, które znajdują się w stanie wzbudzonym, ulegają hybrydyzacji, tworząc dwa orbitale zhybrydyzowane (hybrydy) typu . Powstałe dwa orbitale typu , o jednakowym kształcie i energii, zorientowane są względem siebie pod kątem , a ich budowę określa się jako liniową (dygonalnądygonalną). Takie ułożenie orbitali względem siebie jest wynikiem dążenia do zminimalizowania elektrostatycznego odpychaniaelektrostatycznego odpychania chmur elektronowych.
Orbitale typu w różnych cząsteczkach
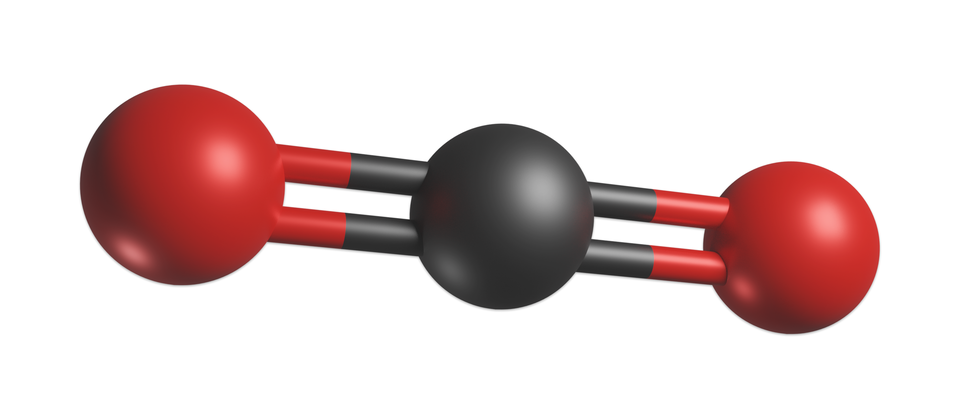
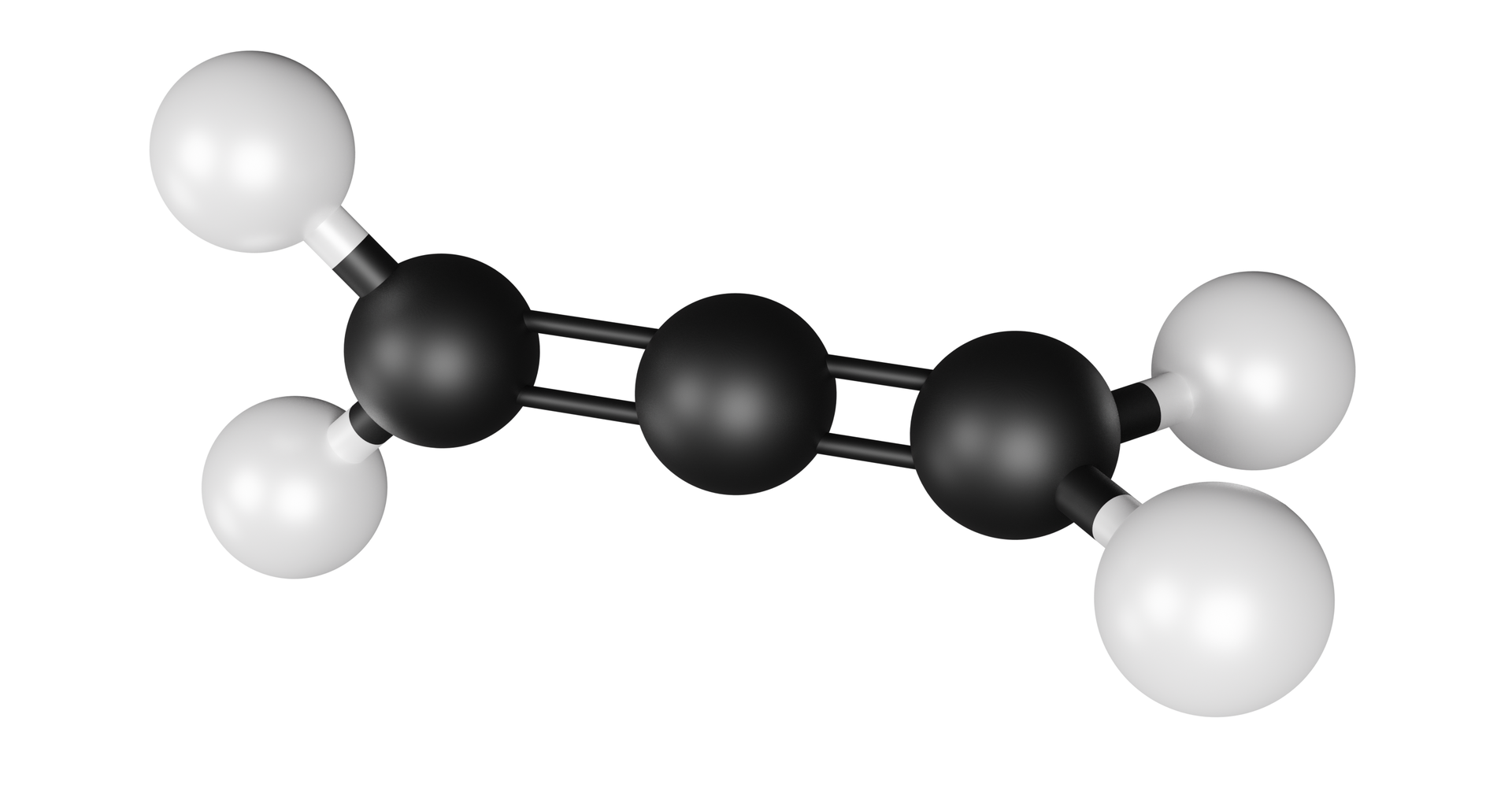
Prawidłowy kształt cząsteczki tlenku węgla(), uwzględniający efekt hybrydyzacji, przedstawiony jest poniżej.
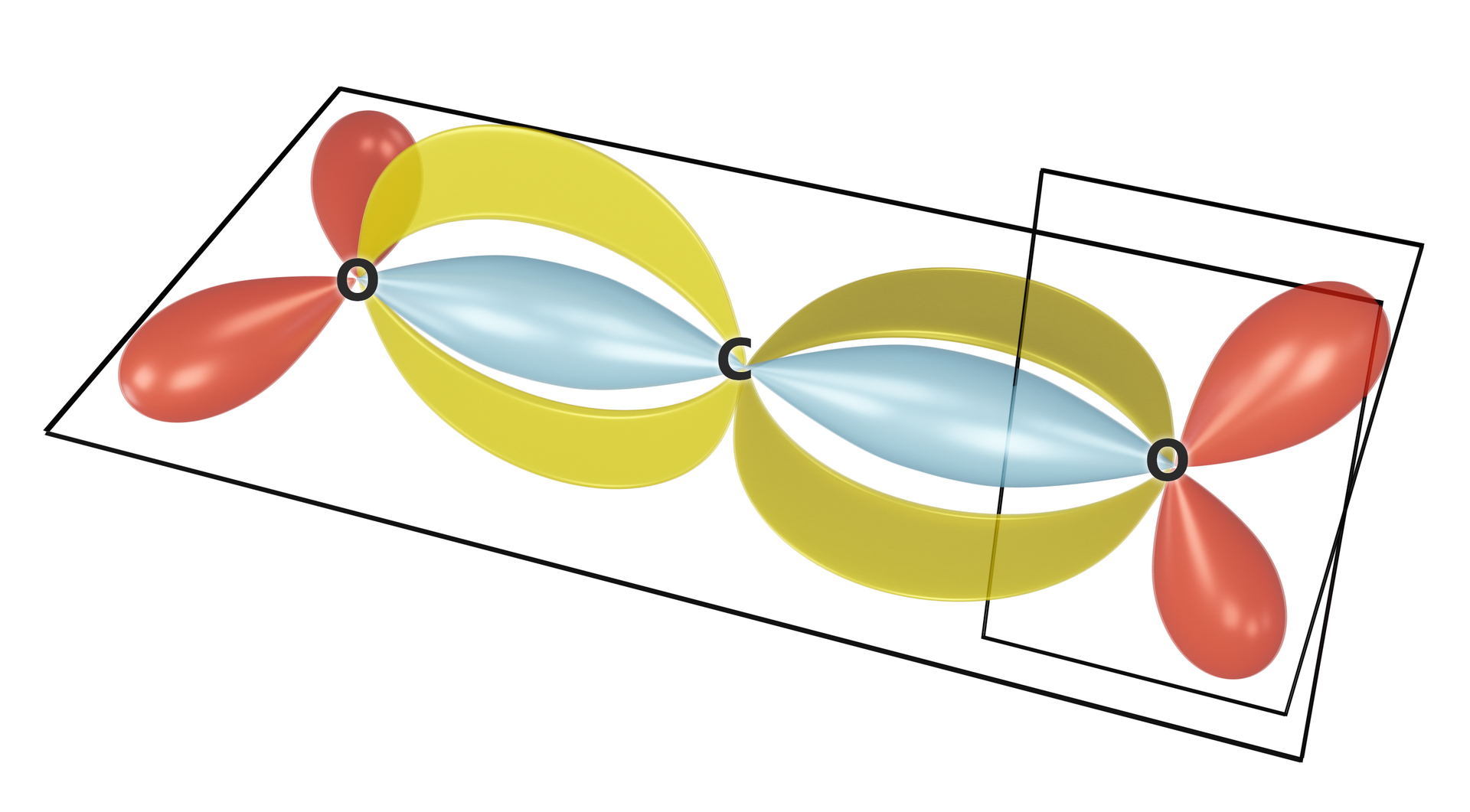
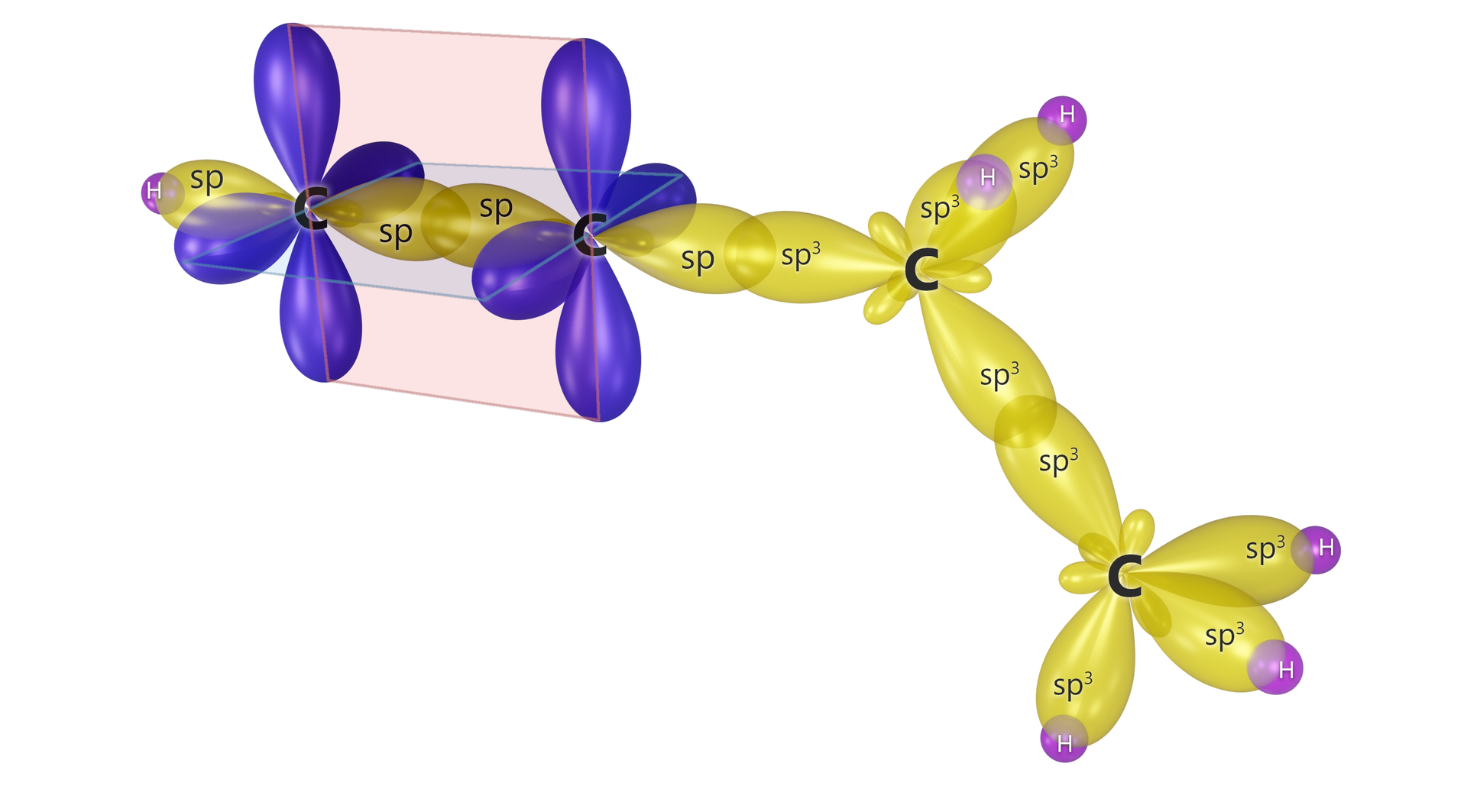
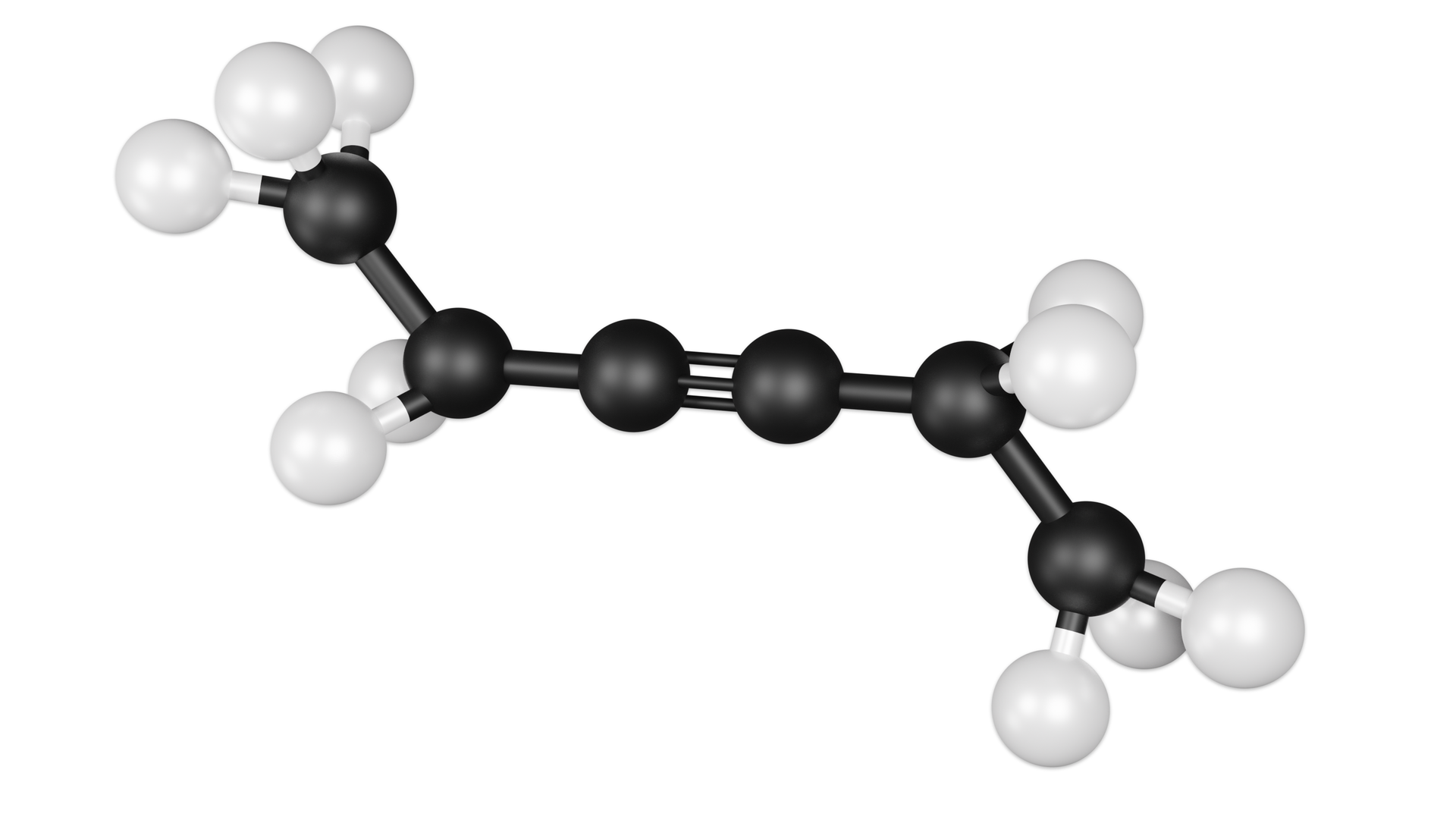
Powstawanie wiązań kowalencyjnych, za pomocą hybrydyzacji typu , można wyjaśnić nie tylko w cząsteczce , ale także w wielu typach cząsteczek nieorganicznych oraz organicznych. Orbitale mają związek z właściwościami i strukturą wiązania potrójnego (spotykanego m.in. w związkach węgla) oraz budową allenówallenów (galeria mediów poniżej).
Modele cząsteczek alkinów i allenów- efekty hybrydyzacji
Jak wynika z powyższych modeli, kąt między wiązaniami w układach oraz jest równy . Dzieje się tak, ponieważ orbitale leżą w jednej linii.
Przykłady związków nieorganicznych, w których atom centralnyatom centralny związku przyjmuje hybrydyzację , to np. , . W cząsteczkach tych, podobnie jak w związkach organicznych, wyraźnie zaznacza się liniowość wiązań.
Konfiguracja elektronowa powłoki walenycyjnej atomu magnezu ma postać . Elektron z powłoki zostaje wzbudzony, czego efektem jest zajęcie pustego orbitalu . Rozkład elektronów w stanie wzbudzonym na powłoce walencyjnej przyjmuje postać . Orbitale oraz ulegają hybrydyzacji, tworząc dwa orbitale typu . Orbitale te zwracają się do siebie czołowo i tworzą wiązania z orbitalami dwóch atomów wodoru przez nakładanie typu -. Sytuację tę przedstawiono na poniższym rysunku.
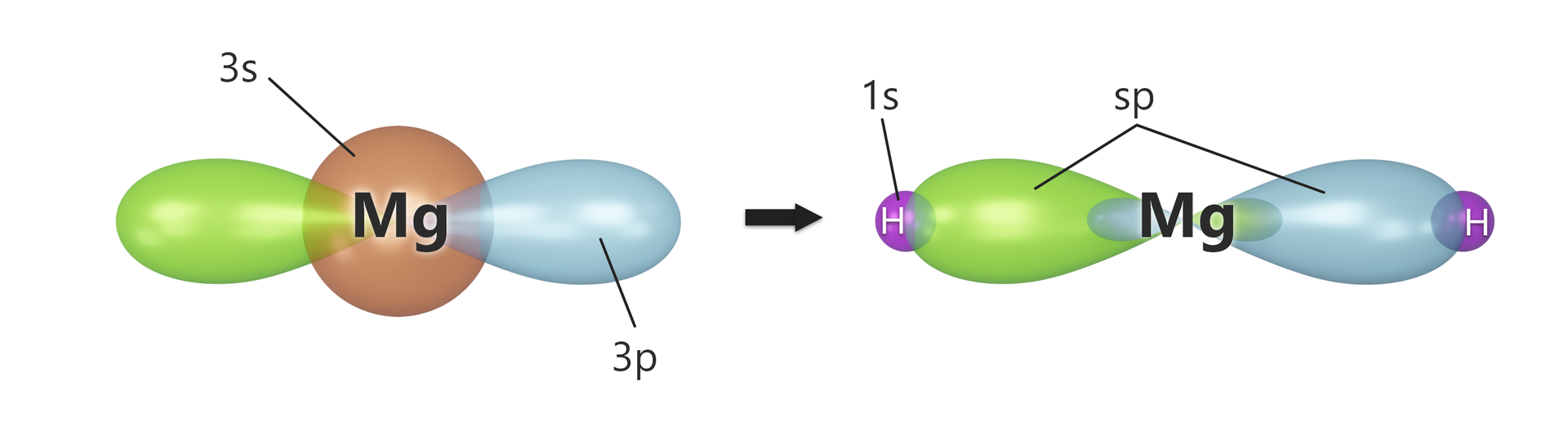
Powstawanie orbitali zhybrydyzowanych typu pomaga wyjaśnić, dlaczego cząsteczki mają budowę liniową. Ten typ hybrydyzacji występuje w przypadku:
atomów posiadających tylko dwa elektrony walencyjne (np. druga grupa w układzie okresowym) – dwa orbitale typu pozostają puste i nie ulegają hybrydyzacji (np. atom berylu w );
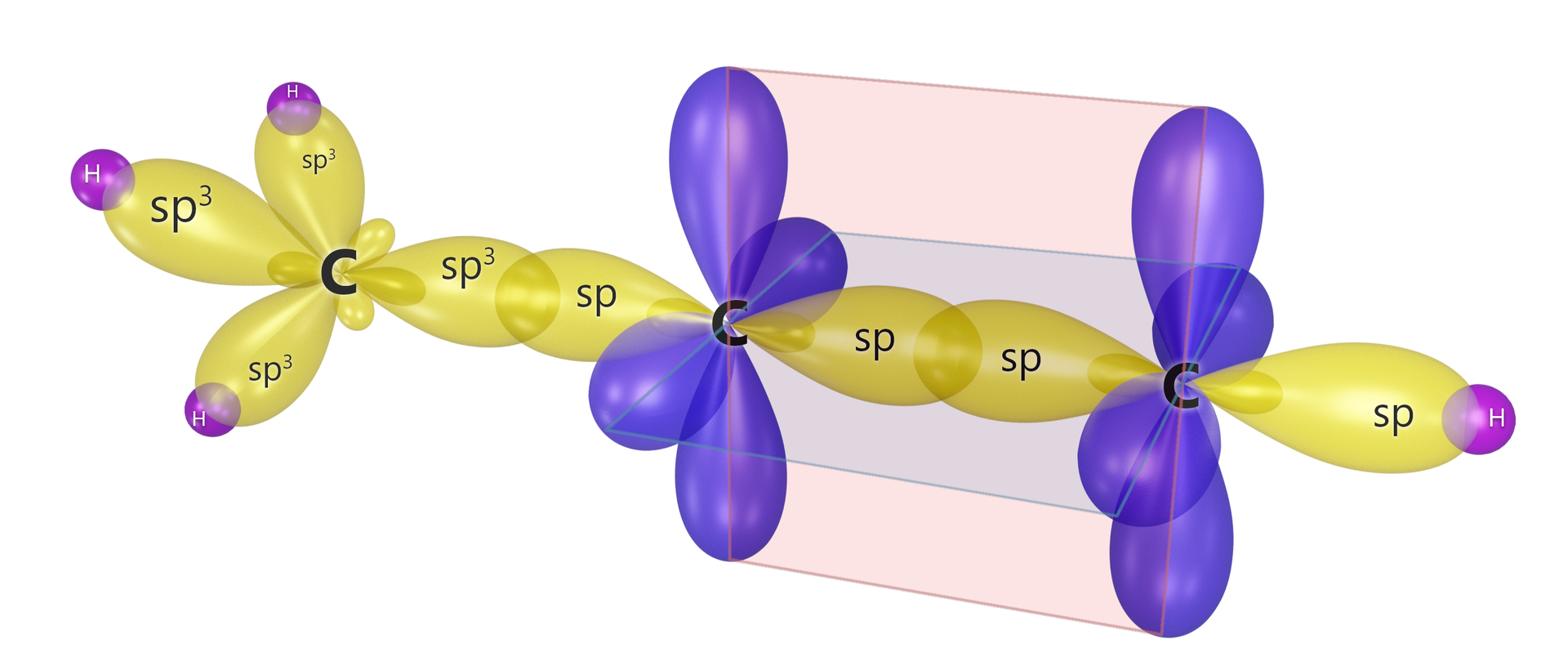
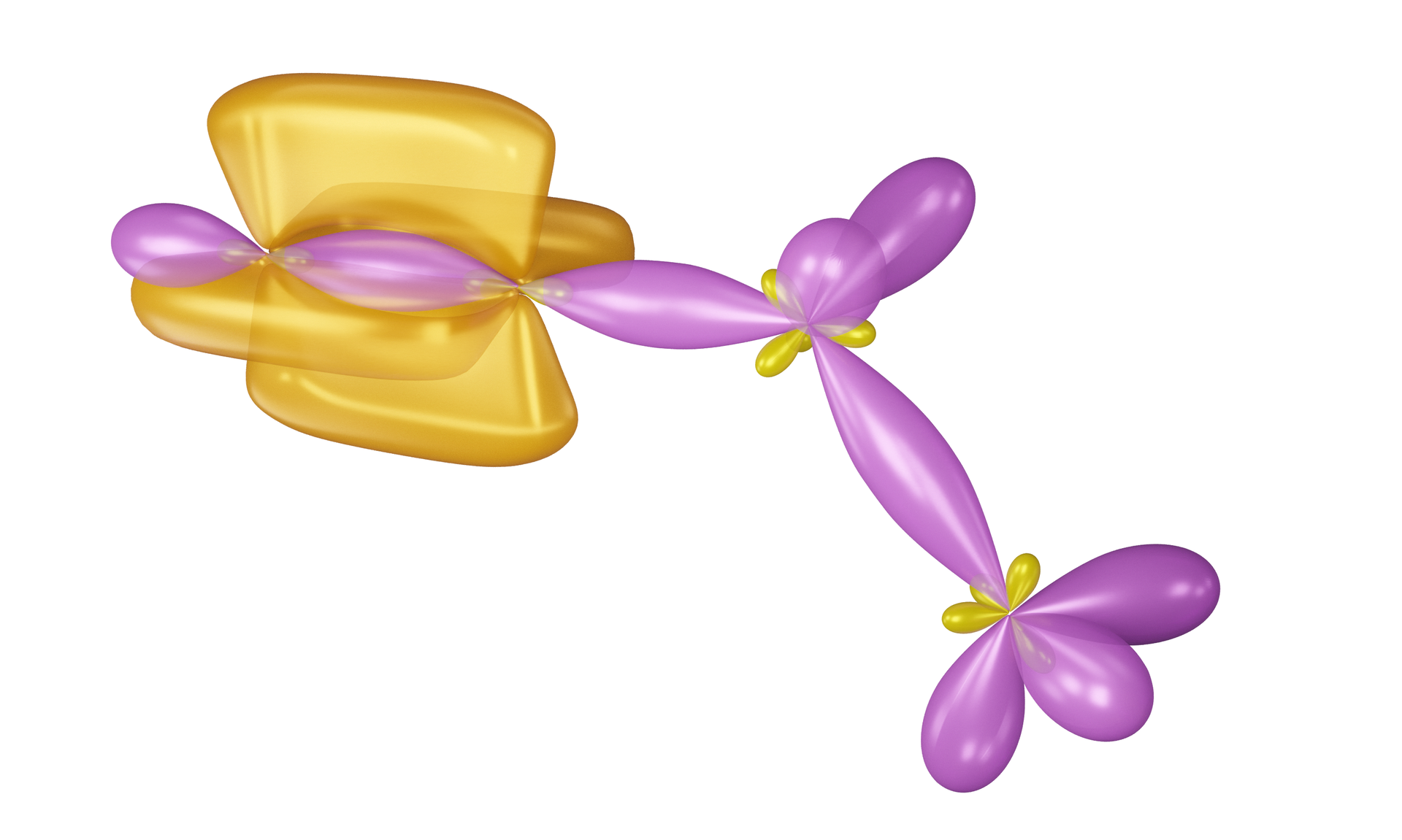
gdy występuje wiązanie potrójne, do utworzenia wiązania potrójnego wymagane jest łącznie sześć elektronów (dwa elektrony do utworzenia wiązania i cztery elektrony do utworzenia dwóch wiązań ) – wiązanie powstaje z nałożenia zhybrydyzowanych orbitali atomów (np. atomy węgla w acetylenie, ; atomy azotu w cząsteczce ), natomiast połowicznie obsadzone orbitale obu atomów nakładają się bocznie, w wyniku czego powstają dwa wiązania ;
gdy występują dwa podwójne wiązania przy jednym atomie (np. propadien), atom centralny tworzy dwa wiązania podwójne (dwa wiązania i dwa wiązania ), a do utworzenia jednego wiązania podwójnego potrzeba łącznie czterech elektronów (dwa do utworzenia wiązania i dwa do utworzenia wiązania : wiązanie powstaje z nałożenia zhybrydyzowanych orbitali Indeks górny 22 i , natomiast połowicznie obsadzone orbitale dwóch atomów węgla nakładają się bocznie, w wyniku czego powstają dwa wiązania ; kąt między wiązaniami utworzonymi przez trzy atomy węgla wynosi .
Słownik
funkcja falowa, opisująca stan jednego elektronu, zależna od współrzędnych określających jego położenie w atomie (orbital atomowy) i w cząsteczce (orbital molekularny, orbital cząsteczkowy)
równocenne pod względem kształtu i energii orbitale atomowe, będące wynikiem mieszania się orbitali atomowych o różnych kształtach i energii
stan, w którym elektrony rozmieszczone są w taki sposób, aby atom posiadał najmniejszą energię
każdy stan elektronu o energii wyższej od energii stanu podstawowego; jest wynikiem przejścia elektronu (po pobraniu energii) z podpowłoki o niższej energii na podpowłokę o energii wyższej; jeśli atom znajduje się w stanie wzbudzonym, dopisywany jest przy nim symbol gwiazdki (*)
inaczej geometria liniowa orbitali zhybrydyzowanych typu ; typ geometrii, w której kąt między wiązaniami wynosi
rodzaj oddziaływania elektrostatycznego, w którym ciała o jednoimiennym ładunku elektrycznym („” lub „” ) wzajemnie się odpychają
(łac. hibrida „mieszaniec”) zabieg matematyczny z udziałem odpowiednich orbitali walencyjnych atomu centralnego cząsteczki, umożliwiający interpretację kształtu cząsteczki; efektem hybrydyzacji jest utworzenie zestawu orbitali zhybrydyzowanych
najczęściej atom znajdujący się w geometrycznym centrum cząsteczki, otoczony przez inne atomy lub grupy atomów (często określane jako tzw. ligandy)
związki pochodzenia organicznego, w których jeden z atomów węgla jest związany wiązaniami podwójnymi z dwoma innymi atomami węgla
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Chang R, Williams College, Chemistry, 10th edition, 2010.
Czerwiński A., Czerwińska A., Jeziorna M., Kańska M., Chemia 3. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2004.
Encyklopedia PWN
Hassa R., Mrzigod A., Mrzigod J., Sułkowski W., Chemia 1. Podręcznik i zbiór zadań w jednym, Warszawa 2003.
Litwin M., Styka‑Wlazło Sz., Szymońska J.,To jest chemia 1, Warszawa 2013.
Morrison R. T., Boyd R. N., Chemia organiczna, t. 1, Warszawa 1985.
Patrick G. L., Chemia organiczna krótkie wykłady, tłum. Zbigniew Zawadzki, Warszawa 2013.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.
Wade L.G, Jr. Withman College, Organic Chemistry, 8th edition, 2013.