Przeczytaj
Kwas azotowy()

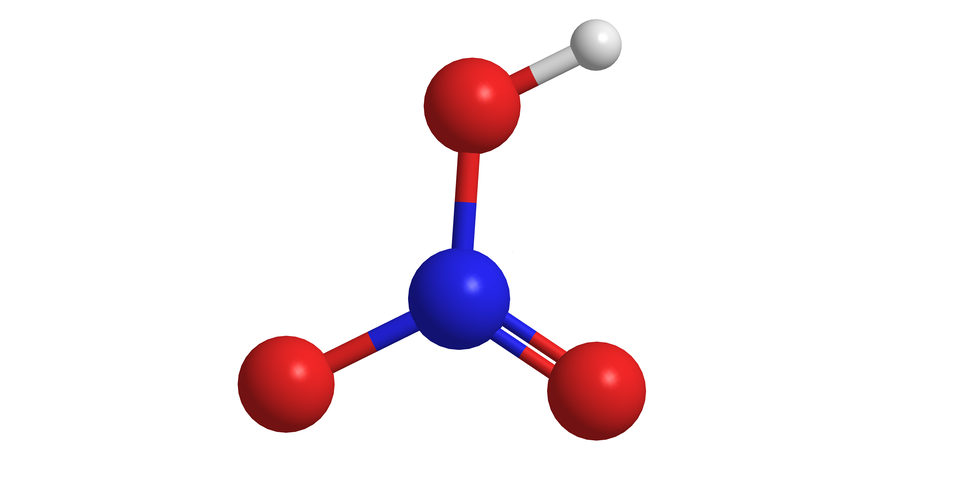
Kwas azotowy() jest bezbarwną cieczą. Gęstość stężonego kwasu azotowego() jest większa niż gęstość wody w temperaturze pokojowej. W postaci stężonej najczęściej spotyka się go jako roztwór około . Omawiany kwas jest określany również jako „dymiący”, ponieważ po otwarciu butelki wydobywają się obłoki brunatnego gazu. Kwas
azotowy() jest nietrwały i w wyniku dłuższego przechowywania ulega reakcji rozkładu, co przedstawia poniższe równanie reakcji:
Światło i podwyższona temperatura wpływają na przyspieszenie reakcji rozkładu kwasu.
Kwas azotowy() należy do kwasów silnie utleniającychkwasów silnie utleniających oraz jest jednym z najsilniejszych kwasów tlenowych. W temperaturze jego stała dysocjacjistała dysocjacji wynosi . Równanie dysocjacji kwasu azotowego():
Kwas azotowy() jest substancją żrącą, która powoduje m.in. poparzenia na skórze w postaci żółtych plam. Jest to efekt zajścia reakcji ksantoproteinowej – pod wpływem stężonego zachodzi nitrowanie pierścieni benzenowych białek i powstaje połączenie o barwie żółtej.

- działanie żrące na skórę, kat. zagrożeń , , ; poważne uszkodzenie oczu, kat. zagrożenia ;
- toksyczność ostra, kat. zagrożeń , , ;
- działanie utleniające.

Kwas azotowy() jest jednym z najważniejszych surowców w przemyśle chemicznym. Substancja ta znajduje zastosowanie w produkcji m.in.: nawozów sztucznych, barwników, leków, tworzyw sztucznych oraz materiałów wybuchowych.
Azotany()
Sole kwasu azotowego(), czyli azotany(), były dawniej określane jako saletry. Wszystkie popularne sole kwasu azotowego() są rozpuszczalne w wodzie.
– azotan() potasu, saletra potasowa lub indyjska.

Saletra potasowa znajduje zastosowanie m.in. jako nawóz mineralny, składnik czarnego prochu strzelniczego czy konserwant w przemyśle spożywczym do konserwacji mięsa.
– azotan() sodu, saletra sodowa lub chilijska.
Saletra sodowa jest białą, krystaliczną substancją stałą. Sól ta znajduje zastosowanie m.in. jako nawóz mineralny w produkcji materiałów wybuchowych, utleniaczutleniacz stałych paliw rakietowych, a także jako konserwant w przemyśle spożywczym.
– azotan() wapnia, saletra wapniowa lub norweska.
Saletra wapniowa jest białą, krystaliczną substancją stałą. Znajduje zastosowanie m.in. jako nawóz mineralny.
– azotan() amonu, saletra amonowa.
Saletra amonowa to białe lub prawie białe, higroskopijne ciało stałe. Bardzo dobrze rozpuszcza się w wodzie. Azotan amonu ma właściwości utleniające.
Saletry wykazują właściwości utleniającewłaściwości utleniające. Tę cechę wykorzystali Chińczycy, którzy mieszali sól kwasu azotowego() z węglem drzewnym i siarką. W ten sposób otrzymali czarny proch strzelniczy.
Kwas azotowy()
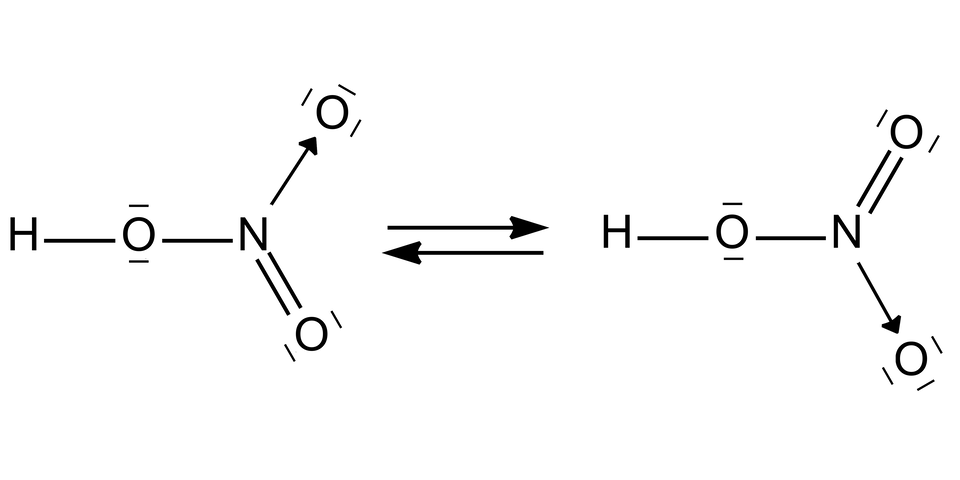
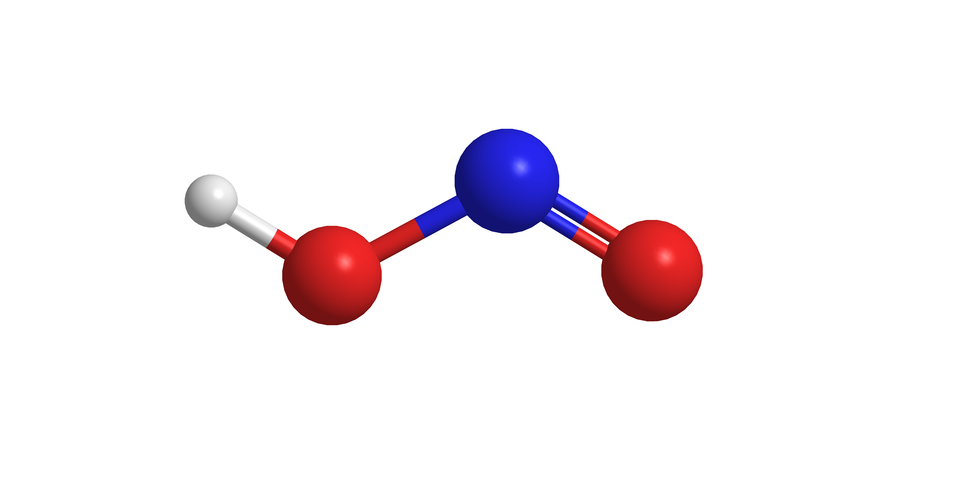
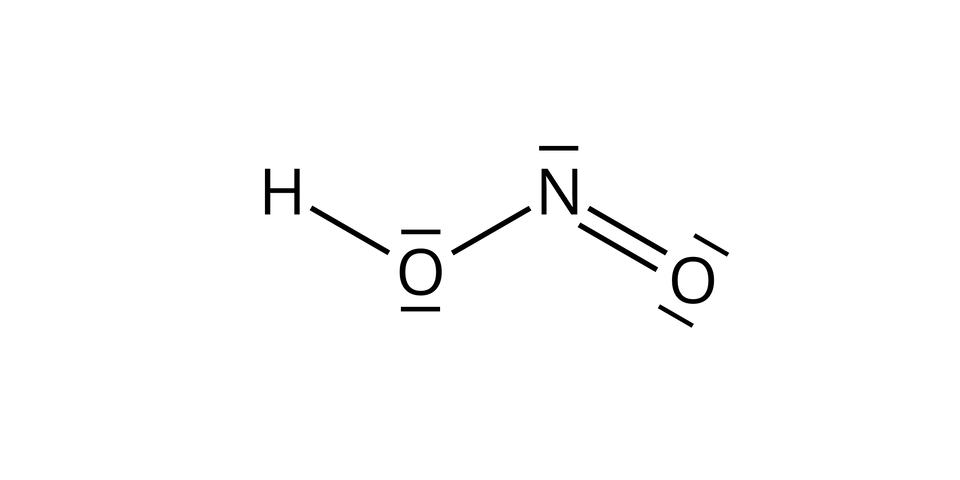
Kwas azotowy() należy do słabych kwasów. Jego stała dysocjacji wynosi . Równanie dysocjacji kwasu azotowego():
Kwas azotowy() jest nietrwałym kwasem tlenowym. W wyniku zatężania ulega reakcji rozkładu, wg poniższego równania reakcji:
Omawiany kwas jest trwały w rozcieńczonym, wodnym roztworze. Zarówno kwas azotowy(), jak i jego sole wpływają negatywnie na organizm człowieka. Kwas działa mutagenniemutagennie.
W wyniku kolizji, poduszki powietrzne w autach są wypełniane azotem, który powstaje dzięki reakcji rozkładu m.in. azydku sodu (). Mieszanina reakcyjna składa się z azydku sodu (), azotanu() potasu oraz tlenku krzemu(). Jeśli będzie miało miejsce zderzenia auta, w ułamku sekundy zajdą reakcje opisane poniższymi równaniami reakcji chemicznych.
Powstały w pierwszej reakcji sód reaguje z azotanem() potasu, przez co tworzy się azot oraz tlenki sodu i potasu, które następnie reagują z tlenkiem krzemu(), tworząc bezpieczne krzemiany.

Jednym z najważniejszych związków azotu i zarazem jednym z najsilniejszych kwasów nieorganicznych jest kwas azotowy(). Znajduje liczne i różnorodne zastosowania. Podobnie jego sole, tzw. saletry, stosowane są na wielu różnych płaszczyznach, głównie jako nawozy azotowe. Innym związkiem jest nietrwały kwas azotowy(). Zarówno on, jak i jego sole działają negatywnie na organizm człowieka.
Słownik
mają zdolność utleniania metali o dodatnim potencjale standardowym dzięki redukcji atomu centralnego reszty kwasowej; są to np kwas azotowy() oraz kwas siarkowy() stężony
(łac. mutatio „zmiana”, gr. genѐtēs „rodzic”, „ojciec” od gr. gѐnesis „narodzenie, pochodzenie”) działanie powodujące zmiany (mutacje) w materiale genetycznym
stała równowagi chemicznej procesu dysocjacji elektrolitycznej, jest charakterystyczna dla danego elektrolitu; jej wartość jest bezwymiarowa
(fr. oxygéne, dosłownie „kwasoród”, „tlen”) substancja, która utlenia inną substancję, sama redukując się; utleniacz przyjmuje elektrony, przez co jego atom obniża swój stopień utlenienia
zdolność substancji do utleniania innej substancji przy redukowaniu samej siebie; substancja, posiadająca takie właściwości, przyjmuje elektrony innej substancji, przez co obniża swój stopień utlenienia; substancja, posiadająca właściwości utleniające, jest nazywana utleniaczem
Bibliografia
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska – Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik dla Liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2002.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne Kompendium Chemii, Warszawa 2007.
Litwin M., Styka – Wlazło S., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2018.
Pazdro K. M., Chemia. Pierwiastki i związki nieorganiczne, Warszawa 2012.