Przeczytaj
Mocne i słabe kwasy
Mocne kwasy występują w roztworach wodnych w postaci praktycznie całkowicie zdysocjowanej. Oznacza to, że zdecydowana większość cząsteczek kwasu rozpada się na jony, a liczba form niezdysocjowanych jest tak mała, że zazwyczaj można ją pominąć. Stopień dysocjacji (alfa) mocnych kwasów jest zbliżony lub praktycznie równy .
Słabe kwasy dysocjują w wodzie w niewielkim stopniu. Jeżeli dla stężenia stopień dysocjacji danego kwasu , określa się go jako bardzo słaby kwas.
Gdzie:
– stężenie początkowe (stężenie cząsteczek wprowadzonych);
– stężenie cząstek zdysocjowanych.
Przypomnijmy, że dla kwasu jednoprotonowego, o wzorze ogólnym (gdzie to reszta kwasowa kwasu tlenowego lub beztlenowego), stopień dysocjacji można wyrazić jako:
Moc kwasów
Moc kwasów pierwiastków położonych w tym samym okresie układu okresowego
Zazwyczaj moc kwasów tlenowychkwasów tlenowych rośnie wraz ze wzrostem elektroujemności atomu centralnego, np. dla pierwiastków położonych w okresie:
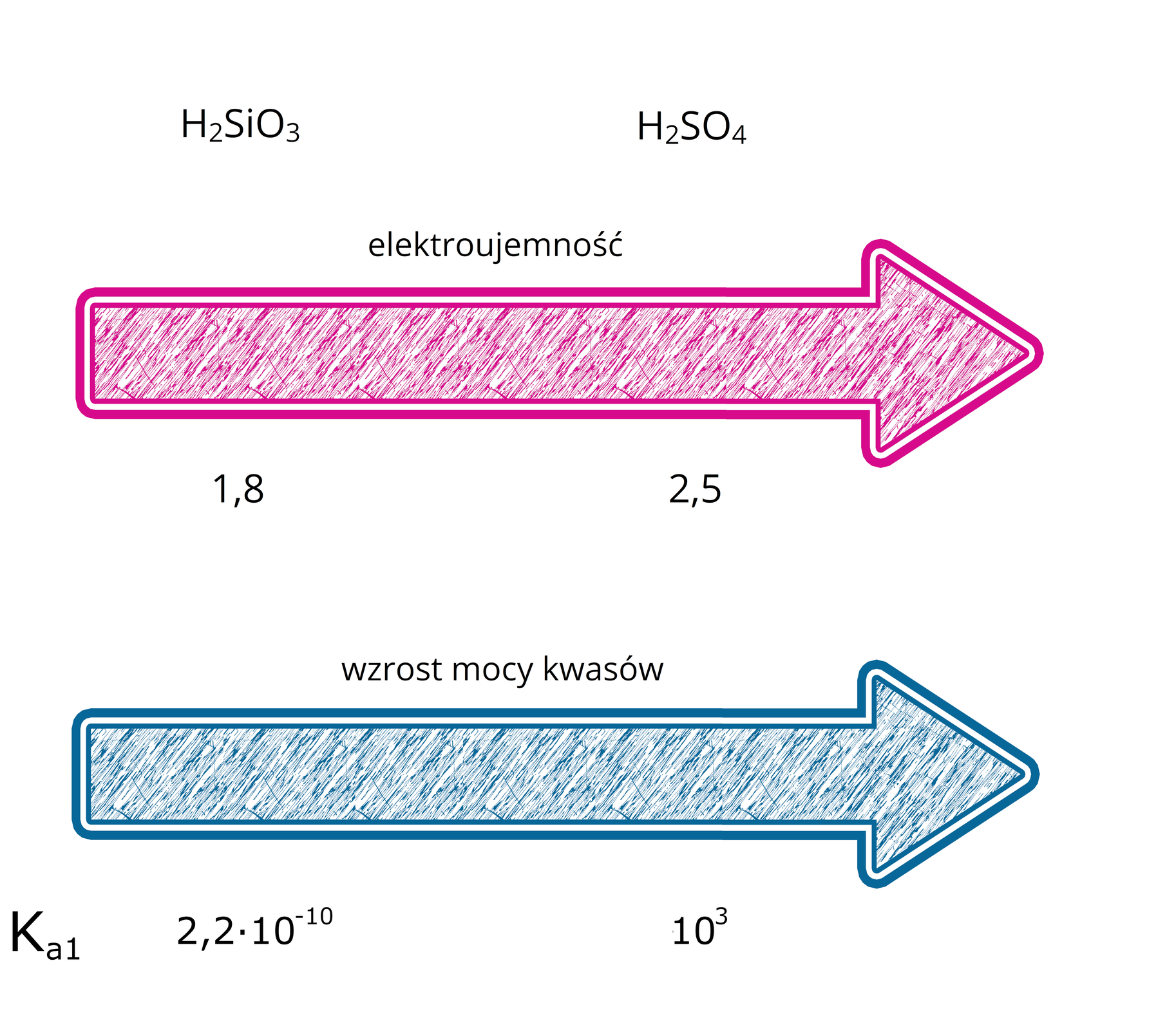
Moc kwasów pierwiastków położonych w tej samej grupie układu okresowego
Dla pierwiastków położonych w grupie, im bardziej elektroujemny atom centralny kwasu, tym silniejszy kwas:

Bardziej elektroujemne atomy centralne mocniej przyciągają elektrony od atomu tlenu, a ten z kolei od tworzącego z nim wiązanie atomu wodoru, co ułatwia oderwanie (oddysocjowanie) kationu wodoru.
Atomy jodu czy też atomy bromu słabiej przyciągają elektrony (większy promień atomowy, mniejsza elektroujemność), dlatego kwas chlorowy() jest mocniejszy od bromowego(), a bromowy() od jodowego().

Moc kwasów tego samego pierwiastka jako atomu centralnego
Jeżeli dany pierwiastek tworzy kilka kwasów jako atom centralny występujący na różnym stopniu utlenienia, to moc kwasów rośnie wraz ze wzrostem stopnia utlenienia atomu centralnego. Atom centralny na wyższym stopniu utlenienia mocniej przyciąga elektrony od atomu tlenu, a ten z kolei od tworzącego z nim wiązanie atomu wodoru, co ułatwia oderwanie (oddysocjowanie) kationu wodoru.
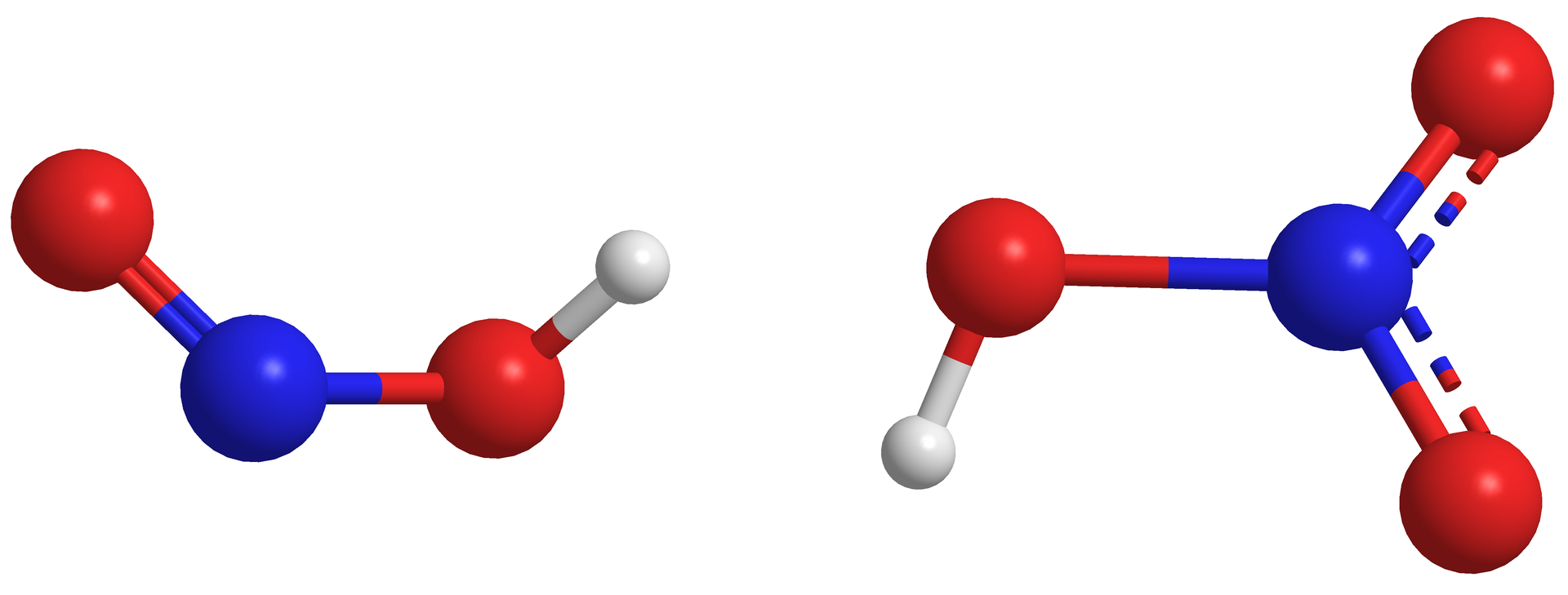
Przykładowo, kwas azotowy() jest kwasem słabszym od kwasu azotowego():
Wśród kwasów chlorowych najsłabszy jest kwas chlorowy(), a najmocniejszy – kwas chlorowy():

Jak sprawdzić moc kwasu?
Moc kwasów decyduje o wartości pH roztworu tego kwasu. Dla dwóch roztworów kwasów o tych samych stężeniach niższe pH będzie wykazywało zawsze roztwór kwasu mocniejszego.
Mocne kwasy wypierają słabsze kwasy z ich soli, np.:
Kwas węglowy jest nietrwały, rozkłada się na wodę i tlenek węgla(), czyli w praktyce równanie powyższej reakcji powinniśmy zapisać jako:
Efekt wyparcia kwasu słabszego – węglowego, przez mocniejszy kwas azotowy() z jego soli, będzie widoczny w postaci wydzielającego się gazowego .
Użytecznym wskaźnikiem mocy kwasów jest stała dysocjacji (stała ta nie zależy od stężenia).
Czym jest stała dysocjacji?
Dysocjacja elektrolitówelektrolitów słabych jest reakcją odwracalną i można ją opisać, stosując tzw. stałą dysocjacji elektrolitycznej. Stała dysocjacjiStała dysocjacji jest równa stosunkowi iloczynu stężeń jonów powstających w procesie dysocjacji do stężenia cząsteczek niezdysocjowanych, pozostających w roztworze w momencie ustalenia stanu równowagi.
Dla słabego kwasu o wzorze :
Gdzie:
, , – stężenia równowagowe.
Im większa jest wartość stałej dysocjacji, tym większa jest moc kwasu.
Jeżeli kwas dysocjuje wieloetapowo, to każdy etap opisuje się innym równaniem i wyrażeniem na stałą dysocjacji.
Stała dysocjacji a moc kwasów
Podział kwasów tlenowych na kwasy mocne i słabe:
Kwasy mocne | Stała dysocjacji | Kwasy słabe | Stała dysocjacji |
|---|---|---|---|
Słownik
kwas nieorganiczny, który zawiera co najmniej jeden atom tlenu połączony z atomem centralnym kwasu, np. kwas siarkowy()
zależy od tego, jaka część cząstek substancji występuje w roztworze w formie zdysocjowanej; elektrolity mocne ulegają całkowitej dysocjacji i występują w roztworze wyłącznie w postaci jonów
stosunek liczby moli drobin związku chemicznego, które uległy dysocjacji do łącznej liczby moli drobin tego związku, wprowadzonych do roztworu
równa jest stosunkowi iloczynu stężeń jonów powstających w procesie dysocjacji do stężenia drobin niezdysocjowanych
termin określający zdolność kwasu do dysocjacji
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2020.
Ciba J., Poradnik chemika analityka, Warszawa 1989, s. 118.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002.
Hejwowska S., Marcinkowski R., Staluszka J., Chemia 3, Gdynia 2007.