Przeczytaj
Co to są kwasy?
Kwasy to związki chemiczne, które definiowane są na wiele sposobów. Klasyfikacji dokonuje się na podstawie danej teorii. Na przykład wg teorii Arrheniusa kwasy to substancje, które w roztworze wodnym dysocjują na kation wodoru i anion reszty kwasowej. Z kolei wg teorii Brønsteda–Lowry’ego są donorami (dawcami) protonów, a według teorii Lewisa kwasy przyjmują parę elektronową. Jednak wszystkie znane kwasy nieorganiczne oznaczane są następującym wzorem ogólnym:
Gdzie oznacza resztę kwasową, a – indeks stechiometryczny, oznaczający ilość atomów wodoru w cząsteczce kwasu.
Jeżeli pod literą kryje się grupa atomów zawierająca – poza innymi pierwiastkami – atom tlenu, wówczas kwas określa się jako tlenowy, tzw. oksokwas. Natomiast jeżeli stanowi atom niemetalu, kwas jest beztlenowy.
- Nazwa kategorii: Reszta kwasowa [italic]R[/]
- Nazwa kategorii: atom niemetalu
- Nazwa kategorii: kwas beztlenowy Koniec elementów należących do kategorii atom niemetalu
- Nazwa kategorii: grupa atomów zawierająca tlen oraz przynajmniej jeden inny pierwiastek chemiczny
- Nazwa kategorii: kwas tlenowy Koniec elementów należących do kategorii grupa atomów zawierająca tlen oraz przynajmniej jeden inny pierwiastek chemiczny
- Elementy należące do kategorii Reszta kwasowa [italic]R[/]
- Elementy należące do kategorii atom niemetalu
- Elementy należące do kategorii grupa atomów zawierająca tlen oraz przynajmniej jeden inny pierwiastek chemiczny
Kwasy beztlenowe
Kwasy beztlenoweKwasy beztlenowe to wodne roztwory wodorków niemetali, należących do 16. oraz 17. grupy układu okresowego.
Wzór kwasu | Nazwa kwasu |
|---|---|
kwas siarkowodorowy | |
kwas selenowodorowy | |
kwas tellurowodorowy | |
kwas fluorowodorowy | |
kwas chlorowodorowy (zwyczajowa nazwa: kwas solny) | |
kwas bromowodorowy | |
kwas jodowodorowy |
Wzory elektronowe kreskowe przedstawia się w następujący sposób:

Niektóre z kwasów beztlenowych są zbudowane z innych niemetali i mają bardziej złożoną budowę, np. kwas cyjanowodorowy () oraz kwas tiocyjanowy (inaczej kwas rodanowodorowy ), w związku z tym posiadają następujące wzory elektronowe kreskowe:

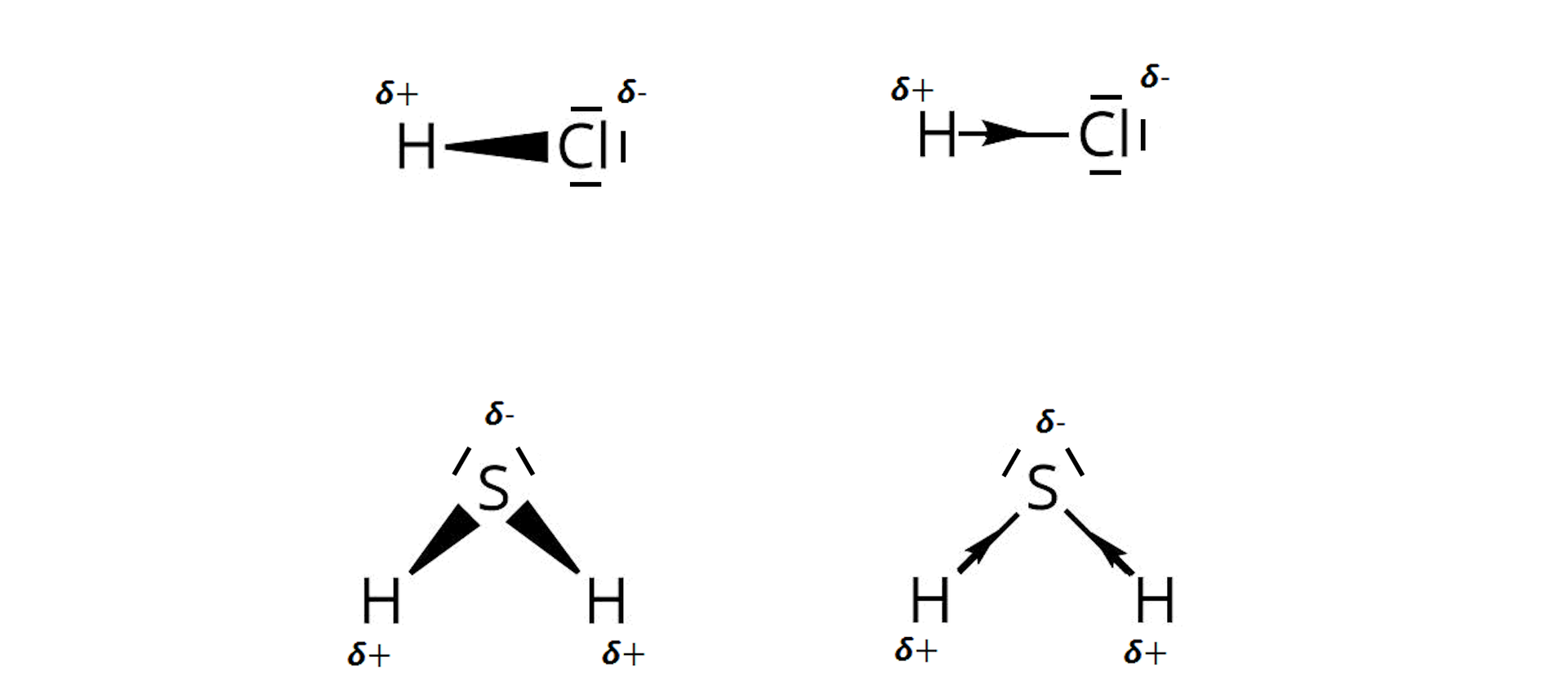
Ze względu na różnicę elektroujemności pomiędzy atomami, w kwasach beztlenowych pomiędzy atomem (atomami) wodoru a atomem niemetalu występują wiązania kowalencyjne spolaryzowane:
Kwasy tlenowe
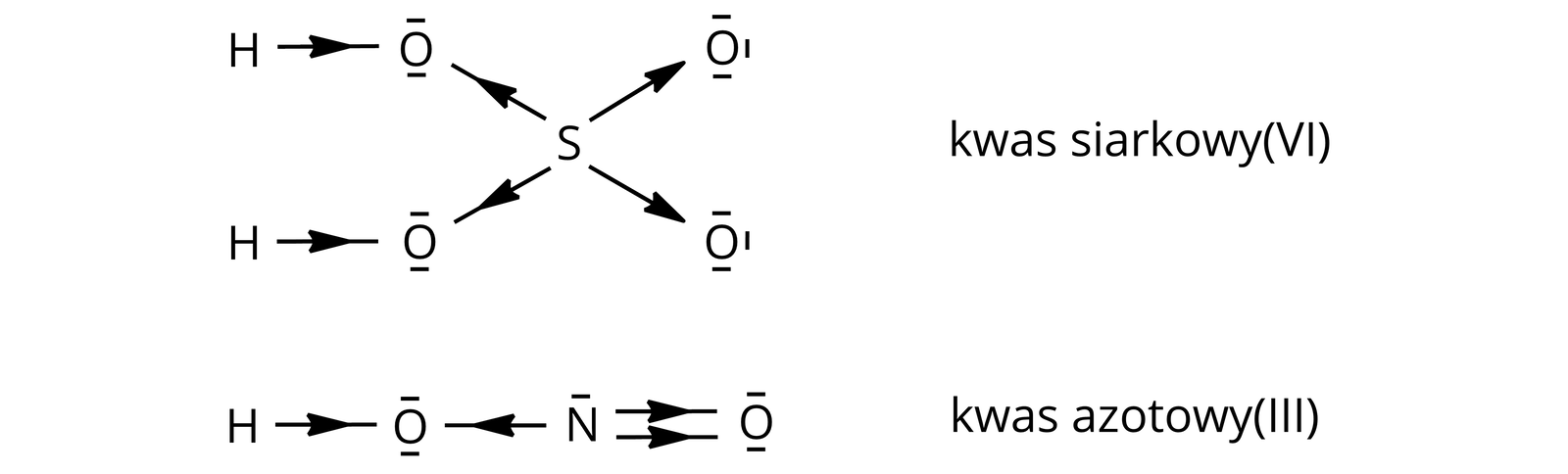
Kwasy tlenowe (oksokwasy)Kwasy tlenowe (oksokwasy) zawierają przynajmniej jeden atom wodoru, związany z atomem tlenu, oraz atom (atomy) innego pierwiastka chemicznego. Pierwiastkami chemicznymi w kwasach tlenowych są zazwyczaj niemetale, ale również metale na wysokich stopniach utlenienia, np. lub , które stanowią atomy centralne w cząsteczkach kwasów.
Wzór kwasu | Nazwa kwasu |
|---|---|
| kwas siarkowy() |
kwas azotowy() | |
kwas azotowy() | |
kwas chlorowy() | |
kwas chlorowy() | |
kwas chlorowy() | |
kwas chlorowy() | |
kwas jodowy() | |
kwas fosforowy() | |
kwas arsenowy() | |
| kwas węglowy |
kwas ortokrzemowy | |
kwas metakrzemowy | |
kwas ortoborowy | |
kwas chromowy() | |
kwas dichromowy() | |
kwas manganowy() |
Słownik
kwasy, które w reszcie kwasowej nie posiadają atomu tlenu; najczęściej wodne roztwory wodorków niemetali
kwasy, które w reszcie kwasowej posiadają atom tlenu
Bibliografia
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.