Przeczytaj
Jakie rodzaje hybrydyzacji z udziałem orbitali typu d wyróżniamy?
Ideą hybrydyzacjihybrydyzacji jest to, że orbitaleorbitale o różnej energii mieszają się dając orbitale zhybrydyzowaneorbitale zhybrydyzowane o tej samej energii. Hybrydyzacji mogą ulegać orbitale walencyjne podpowłoki typu s, p i d. W zależności od liczby i typu orbitali typu d biorących udział w hybrydyzacji, można wyróżnić kilka rodzajów hybrydyzacji:
- hybrydyzacja pentagonalna,
- hybrydyzacja heksagonalna,
- hybrydyzacja heptagonalna.
Czy hybrydyzacji z udziałem orbitali typu d ulegają atomy wszystkich pierwiastków?
Skoro w tworzenie wiązań mogą być zaangażowane orbitale typu d, to można przypuszczać, że jedynie atomy pierwiastków, które posiadają pustą lub częściowo zapełnioną podpowłokę d, takiej hybrydyzacji ulegają. Jeżeli spojrzymy na układ okresowy pierwiastków chemicznych, to zauważymy, że w hybrydyzacji z udziałem orbitali d nie biorą udziału atomy pierwiastków należących do okresów od 1 do 2.
Hybrydyzacja typu w cząsteczce .
Hybrydyzacja typu pozwala wyjaśnić powstawanie wiązań w cząsteczce .
Jeden z elementów, który warto omówić w tym typie hybrydyzacji to rodzaj oraz liczba orbitali atomowych, które „mieszają się” tworząc nowe orbitale, tzw. orbitale zhybrydyzowaneorbitale zhybrydyzowane (hybrydy). W hybrydyzacji typu dochodzi do wymieszania jednego orbitalu typu s, trzech orbitali typu p (, , ) oraz jednego orbitalu typu d, w wyniku czego powstaje pięć zhybrydyzowanych orbitali typu . Można to zapisać w postaci równania:
Krok 1. Stan podstawowyStan podstawowy
W stanie podstawowym atom siarki () posiada konfigurację elektronową:
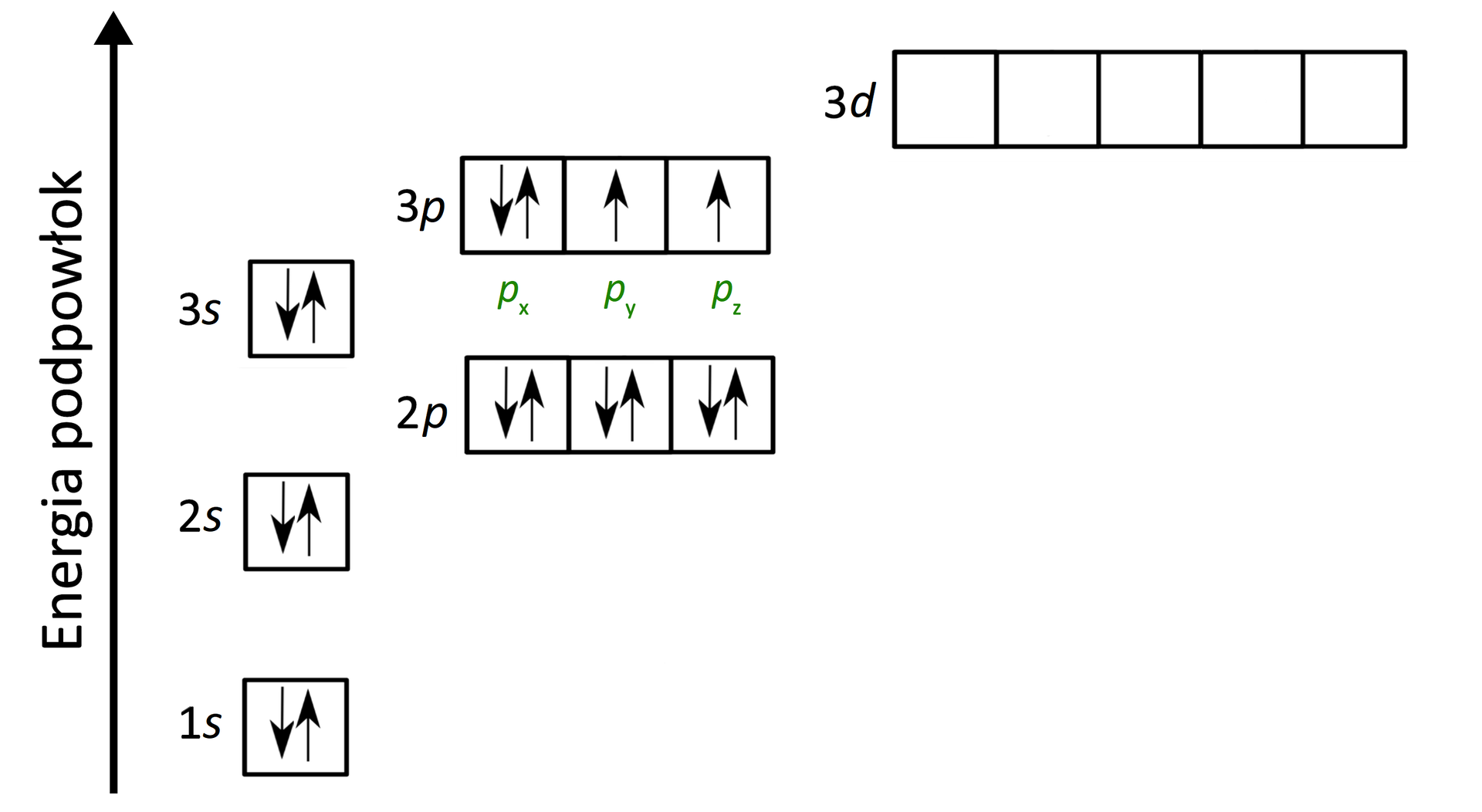
Jeżeli spojrzymy na diagram energetyczny orbitali atomowych, to zauważymy, że na powłoce trzeciej znajdują się trzy podpowłoki - 3s, 3p oraz 3d. Co ważne, podpowłoka typu jest nieobsadzona przez elektrony.
Krok 2. Stan wzbudzonyStan wzbudzony
Aby w cząsteczce czterofluorku siarki (), atom siarki utworzył wiązania kowalencyjne z atomami fluoru, musi posiadać cztery niesparowane elektrony. W związku z tym musi nastąpić wzbudzenie elektronu z niższego poziomu energetycznego na wyższy. W wyniku wzbudzenia atomu siarki, na podpowłoce 3p pozostały trzy elektrony walencyjne, a czwarty jest na podpowłoce .
W I (pierwszym) stanie wzbudzonym atom siarki () posiada konfigurację elektronową:

Krok 3. HybrydyzacjaHybrydyzacja
W kolejnym kroku hybrydyzacji ulegają 1 orbital s, 3 orbitale p oraz 1 orbital d.
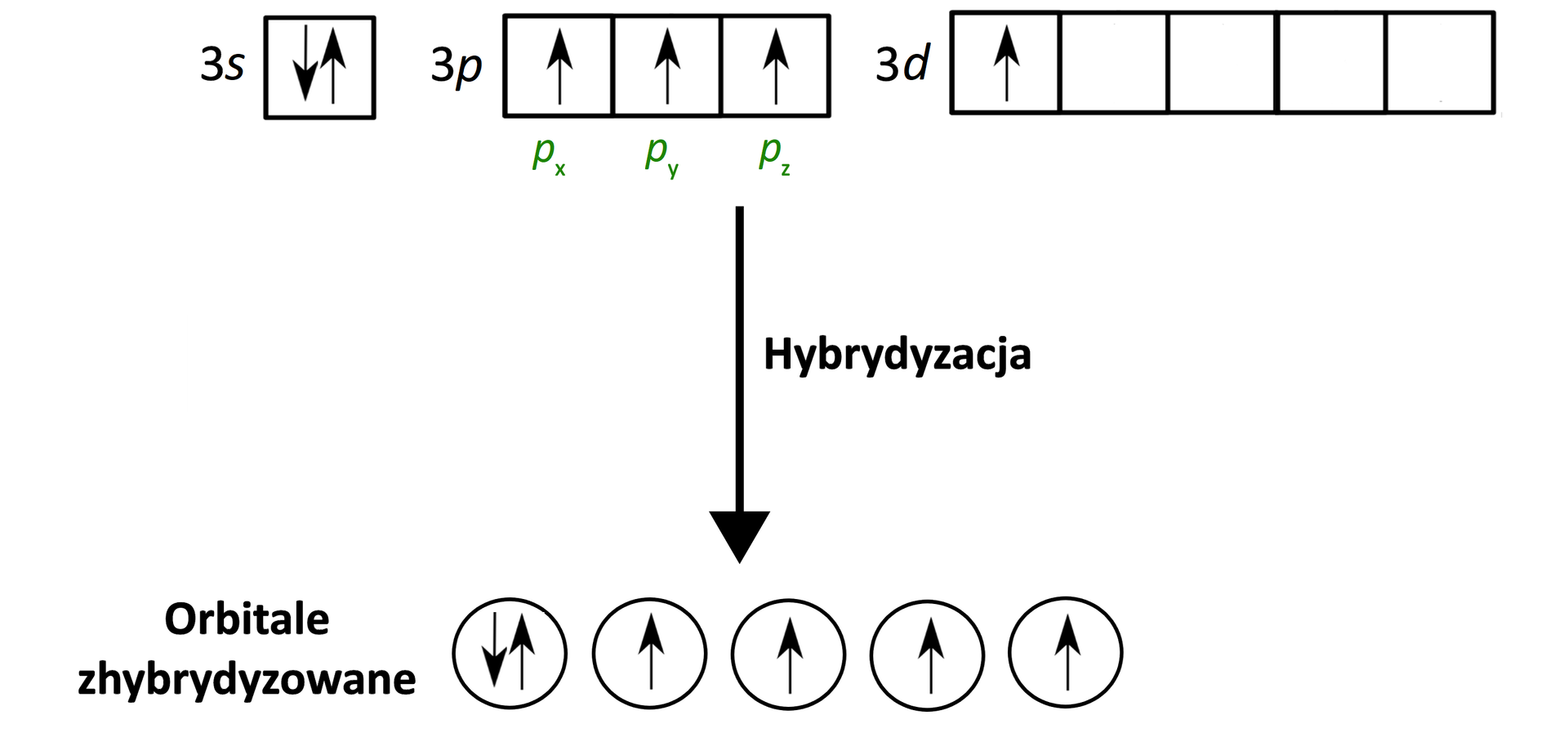
Efektem hybrydyzacji jest utworzenie pięciu równocennych orbitali zhybrydyzowanych typu .
Cztery niesparowane elektrony walencyjne atomu siarki (cztery hybrydy ) tworzą cztery pary wiążące z niesparowanym elektronem walencyjnym każdego z czterech atomów fluoru, natomiast piąty orbital zhybrydyzowany zawiera wolną parę elektronową.

Hybrydyzacja typu w cząsteczce
W przeciwieństwie do cząsteczki tetrafluorku siarki , atom siarki w heksafluorku siarki musi mieć hybrydyzację .
Aby utworzyć sześć wiązań z atomami fluoru, atom siarki musi posiadać 6 niesparowanych elektronów walencyjnych na sześciu równocennych orbitalach zhybrydyzowanych. W związku z tym w hybrydyzacji muszą uczestniczyć dwa orbitale typu d, a nie jeden.
W hybrydyzacji typu dochodzi do wymieszania jednego orbitalu typu s, trzech orbitali typu p (, , ) oraz dwóch orbitalu typu d, w wyniku czego powstaje sześć zhybrydyzowanych orbitali typu . Można to zapisać w postaci równania:
Krok 1. Stan podstawowy
W stanie podstawowym atom siarki () posiada konfigurację elektronową:

Jeżeli spojrzymy na diagram energetyczny orbitali atomowych, to zauważymy, że na powłoce trzeciej znajdują się trzy podpowłoki - 3s, 3p oraz 3d. Co ważne, podpowłoka typu 3d jest nieobsadzona przez elektrony.
Krok 2. Stan wzbudzony
Aby w cząsteczce heksafluorku siarki (), atom siarki utworzył wiązania kowalencyjne z atomami fluoru, musi posiadać sześć niesparowanych elektronów. W związku z tym musi nastąpić wzbudzenie elektronów z podpowłoki 3s na podpowłokę 3d. W wyniku wzbudzenia atomu siarki, na podpowłoce 3p pozostały trzy elektrony walencyjne, a napodpowłoce 3d.
W II (drugim) stanie wzbudzonym atom siarki () posiada konfigurację elektronową:
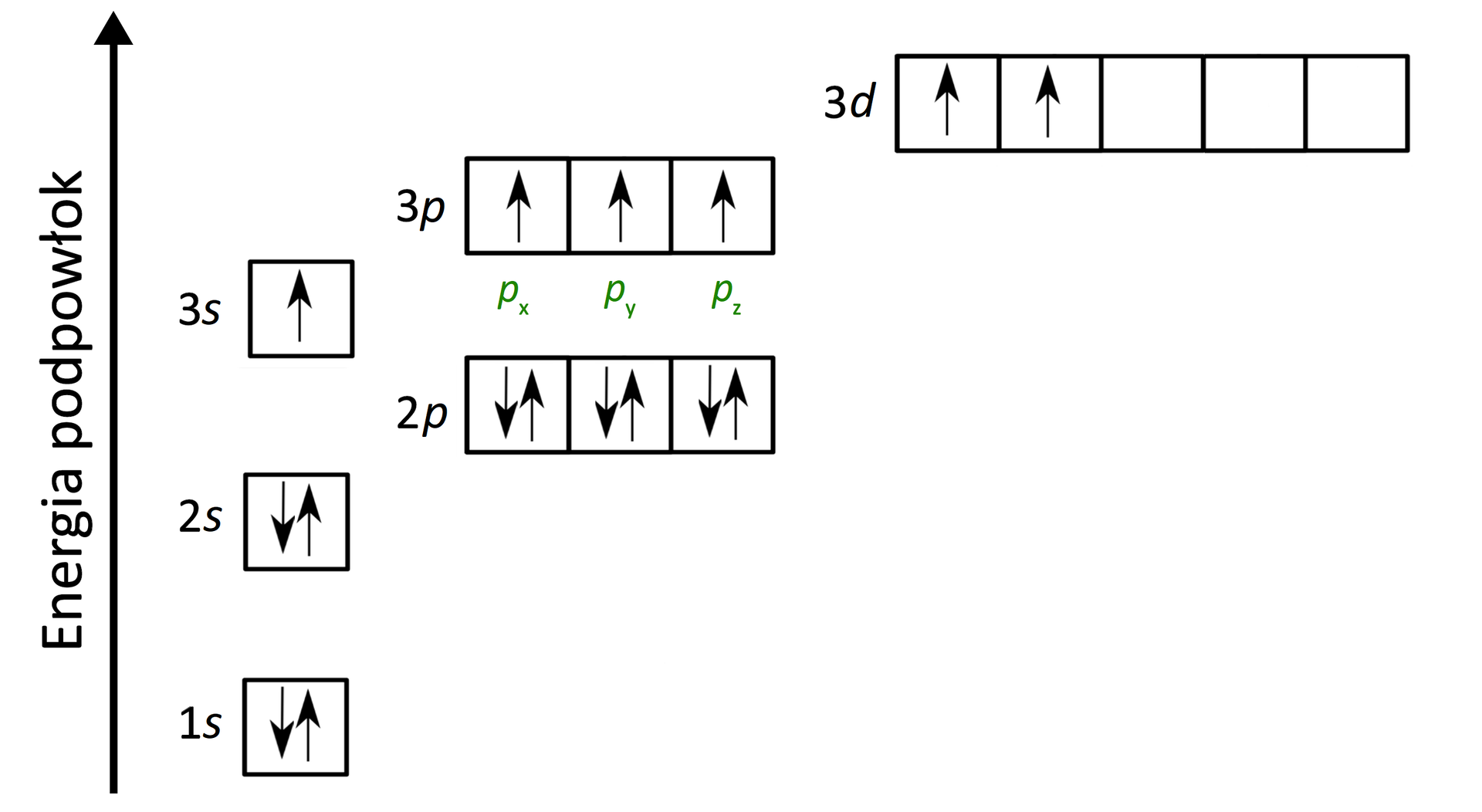
Krok 3. Hybrydyzacja
W kolejnym kroku hybrydyzacji ulegają 1 orbital s, 3 orbitale p oraz 2 orbitale d.
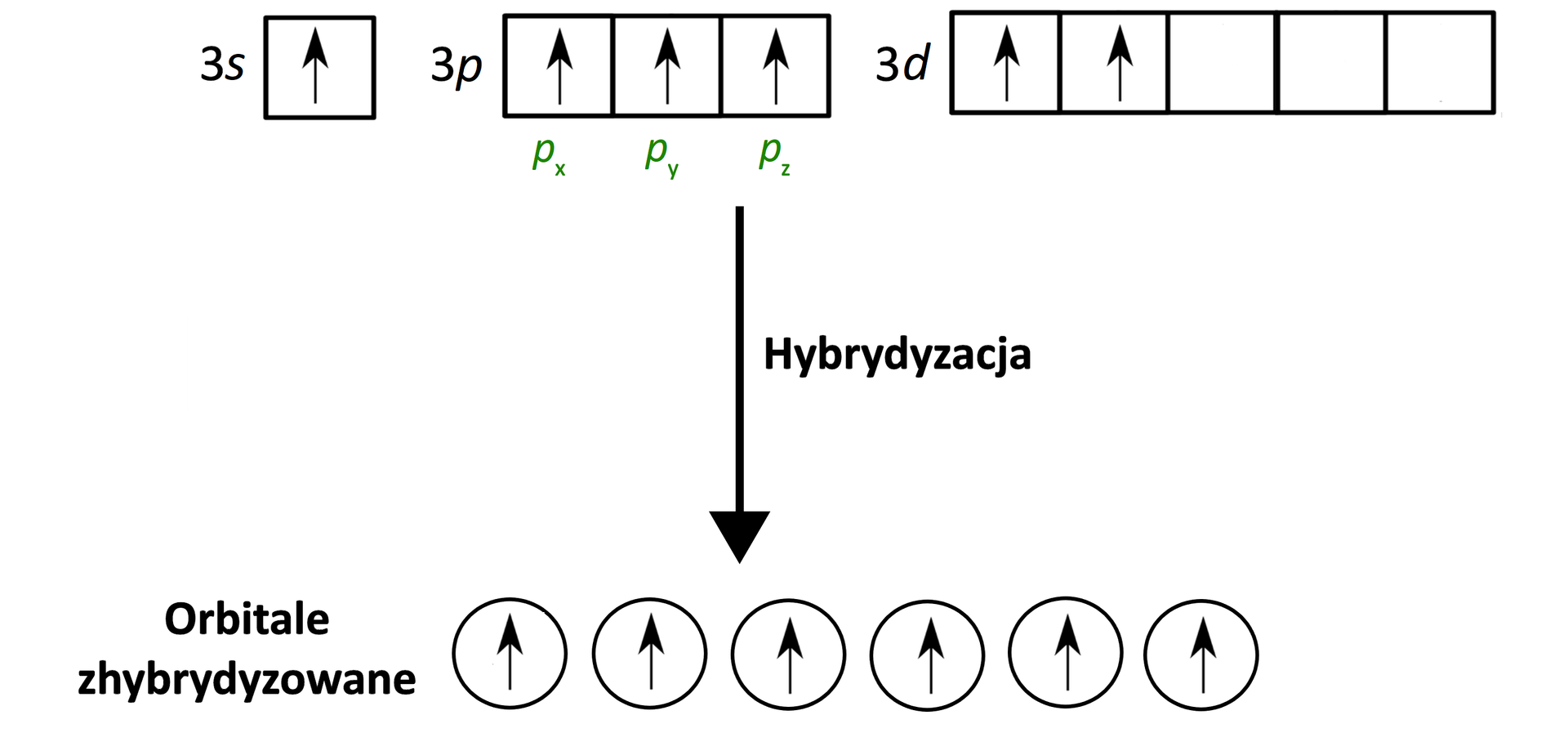
Efektem hybrydyzacji jest utworzenie sześciu równocennych orbitali zhybrydyzowanych typu .
Sześć niesparowanych elektronów walencyjnych atomu siarki (sześć hybryd ) tworzy sześć par wiążących z niesparowanym elektronem walencyjnym każdego z sześciu atomów fluoru, przez co cząsteczka przyjmuje kształt oktaedru.

Do roku 2006 jednym z zastosowań związku o wzorze było napełnianie poduszek butów sportowych pewnej marki obuwniczej. W plastikowej kieszeni powietrznej przymocowanej do pięty producenci obuwia umieszczali heksafluorek siarki, dzięki czemu obuwie stabilizowało stopę podczas biegania. Z uwagi na fakt, że gaz ten został ogłoszony przez ekologów gazem szkodliwym (cieplarnianym) wycofano go z użycia. Zamiast nim buty wypełniano powietrzem.
Słownik
(łac. hybrida „mieszaniec”) zabieg matematyczny z udziałem odpowiednich orbitali walencyjnych atomu centralnego cząsteczki umożliwiający interpretację kształtu cząsteczki; efektem hybrydyzacji jest utworzenie zestawu orbitali zhybrydyzowanych
funkcja falowa, opisująca stan jednego elektronu, zależna od współrzędnych określających jego położenie w atomie (orbital atomowy) i w cząsteczce (orbital molekularny, orbital cząsteczkowy)
równocenne pod względem kształtu i energii orbitale atomowe będące wynikiem mieszania się orbitali atomowych o różnych kształtach i energii
stan, w którym elektrony rozmieszczone są w taki sposób, aby atom posiadał najmniejszą energię
każdy stan elektronu o energii wyższej od energii stanu podstawowego; jest wynikiem przejścia elektronu (po pobraniu energii) z podpowłoki o niższej energii na podpowłokę o energii wyższej; jeśli atom znajduje się w stanie wzbudzonym, dopisywany jest przy nim symbol gwiazdki (*)
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Czerwiński A., Czerwińska A., Jeziorna M., Kańska M., Chemia 3. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2004.
Encyklopedia PWN
Kaznowski K., Pazdro K M., Chemia. Podręcznik dla liceów i techników. Zakres rozszerzony, Warszawa 2019.
Lee J. D., Zwięzła chemia nieorganiczna, tłum. J. Kuryłowicz, Warszawa 1997, wyd. 5.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pazdro K., Zbiór zadań z chemii dla szkół ponadgimnazjalnych, Warszawa 2003.
A Brief History of Nike Air, 2019, online: https://news.nike.com/news/history-of-nike-air, dostęp: 05.02.2022.