Przeczytaj
Wiązanie donorowo‑akceptorowe
Najczęściej, gdy dwa atomy tworzą cząsteczkę i uwspólniają swoje elektrony, tworząc wiązanie pojedyncze, każdy z nich do wspólnej pary daje po jednym elektronie. Nie zawsze musi tak być, bowiem wspólna para elektronowa może w całości pochodzić od jednego atomu, zwanego donorem. Drugi atom, który przyjmuje parę elektronową, uzupełniając jednocześnie własną powłokę walencyjną, zwany jest akceptorem. Wiązanie, które powstaje między donorem a akceptorem nazywane jest wiązaniem donorowo–akceptorowymwiązaniem donorowo–akceptorowym (koordynacyjnym).
Powstawanie wiązania donorowo‑akceptorowego
Cząsteczka amoniaku składa się z trzech atomów wodoru i jednego atomu azotu. Każdy atom wodoru łączy się wiązaniem pojedynczym z atomem azotu – wiązanie powstaje w wyniku uwspólnienia po jednym elektronie atomu wodoru i jednym elektronie atomu azotu. W ten sposób powstają trzy wiązania kowalencyjne. Na atomie azotu obecna jest wolna para elektronowa. Wzór elektronowy (Lewisa) kropkowy cząsteczki amoniaku przedstawiono poniżej:
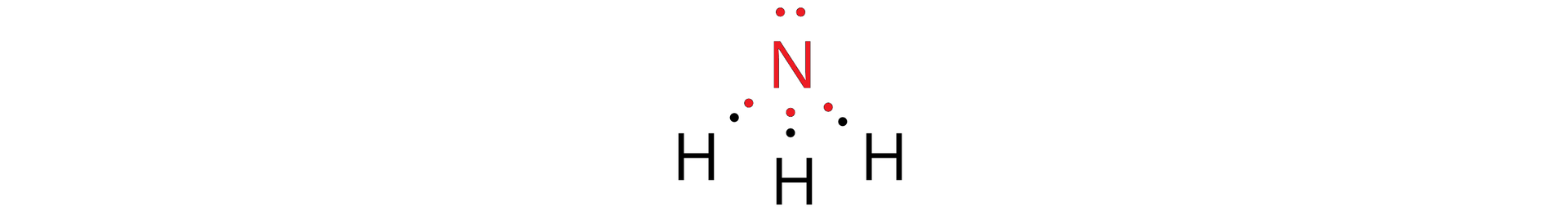
W roztworze wodnym, pomiędzy cząsteczkami amoniaku i wody, występują oddziaływania wodoroweoddziaływania wodorowe, które mogą doprowadzić do przemieszczenia się w jednym momencie dwóch elektronów tworzących wiązanie na atom tlenu cząsteczki wody. Dzięki temu powstaje anion wodorotlenkowy. Oddziaływania wodorowe mogą również prowadzić do utworzenia nowego wiązania kowalencyjnego , w wyniku czego otrzymujemy kation amonowy .
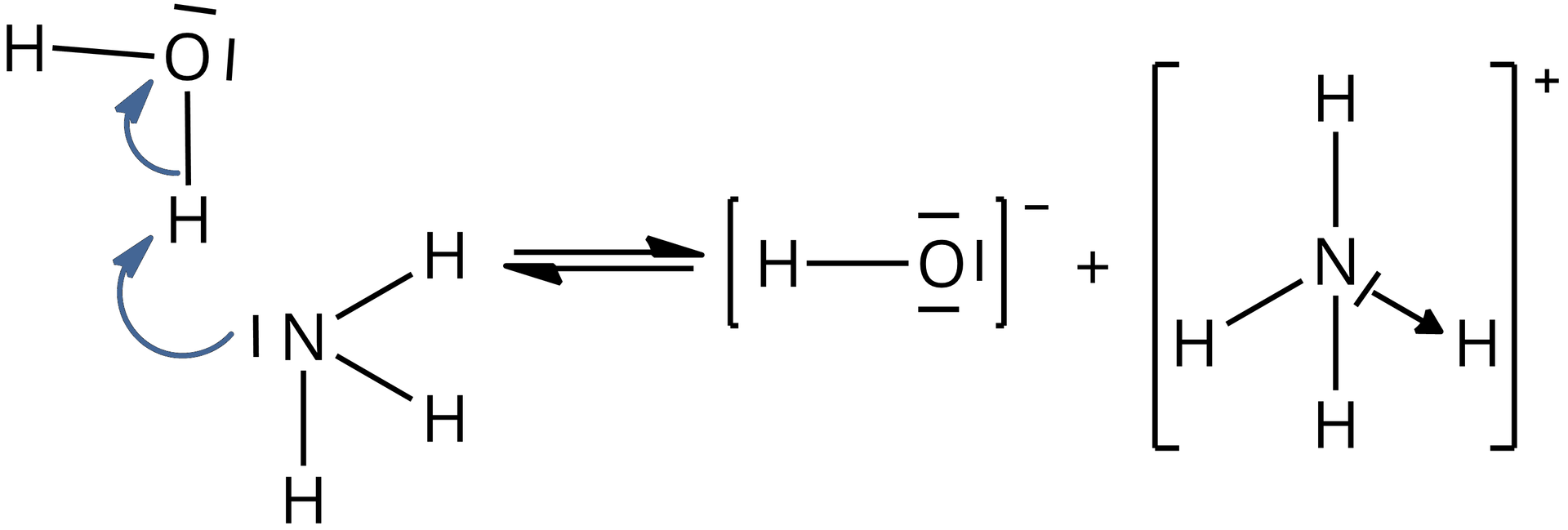
Amoniak w roztworze wodnym ulega zatem reakcji:
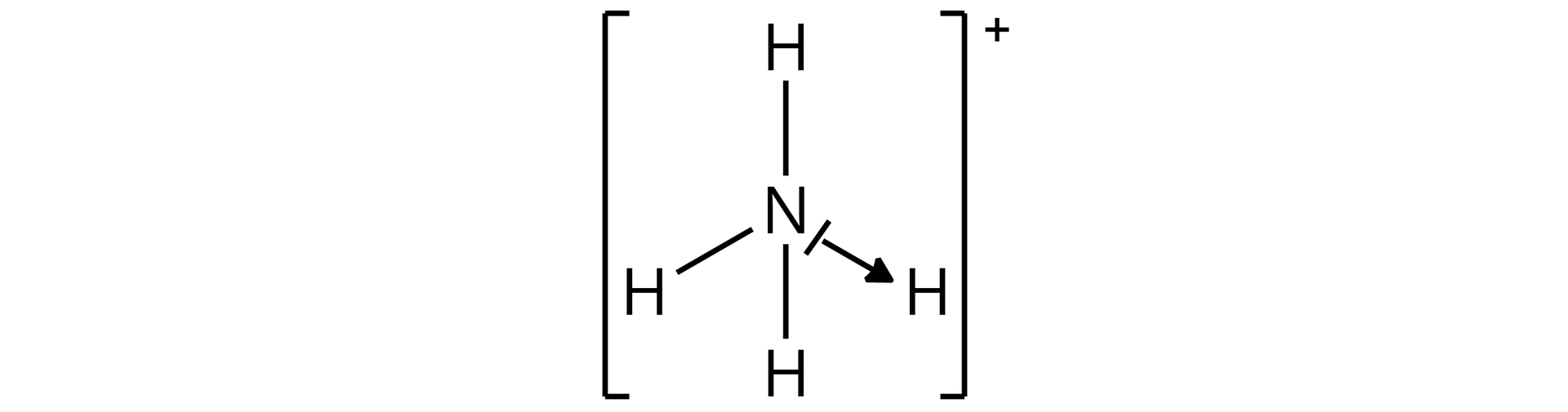
W kationie amonowym obecne jest wiązanie donorowo–akceptorowe (koordynacyjne), które powstało dzięki obecności wolnej pary elektronowej na atomie azotu w cząsteczce amoniaku . Donorem elektronów w kationie amonowym jest zatem atom azotu, natomiast akceptorem – atom wodoru.
Cząsteczka wody składa się z jednego atomu tlenu i dwóch atomów wodoru. Każdy atom wodoru łączy się wiązaniem pojedynczym z atomem tlenu – wiązanie powstaje w wyniku uwspólnienia po jednym elektronie atomu wodoru i jednym elektronie atomu tlenu. Wzór elektronowy (Lewisa) kropkowy cząsteczki wody przedstawiono poniżej:
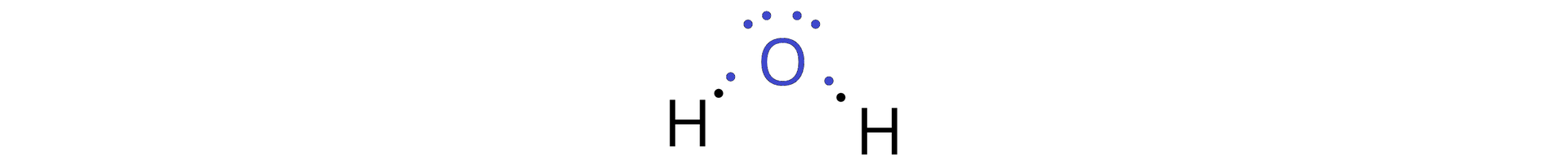
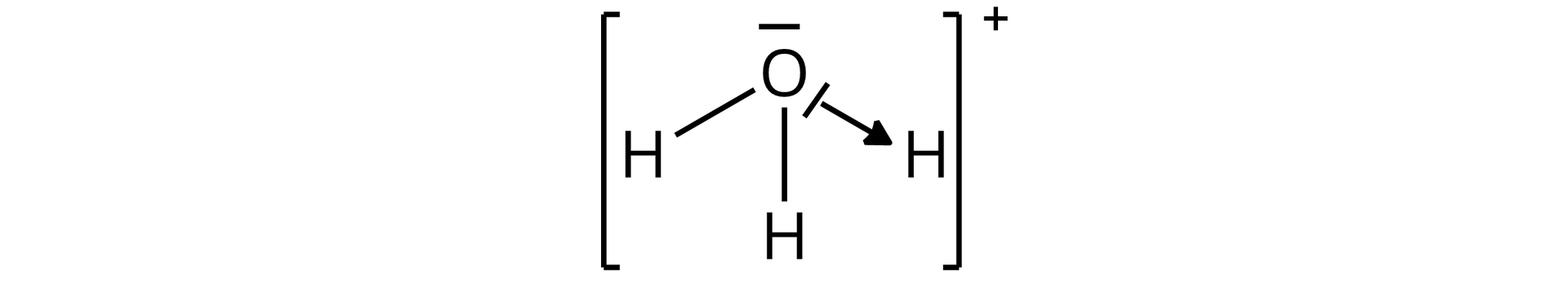
Pomiędzy cząsteczkami wody dochodzi do przemieszczenia się w jednym momencie dwóch elektronów, które tworzą wiązanie na atom tlenu jednej cząsteczki wody. Tym samym powstaje anion wodorotlenkowy oraz dochodzi także do utworzenia nowego wiązania kowalencyjnego , w wyniku czego z drugiej cząsteczki wody powstaje kation oksoniowy (kation hydroniowy, kation hydronowy).
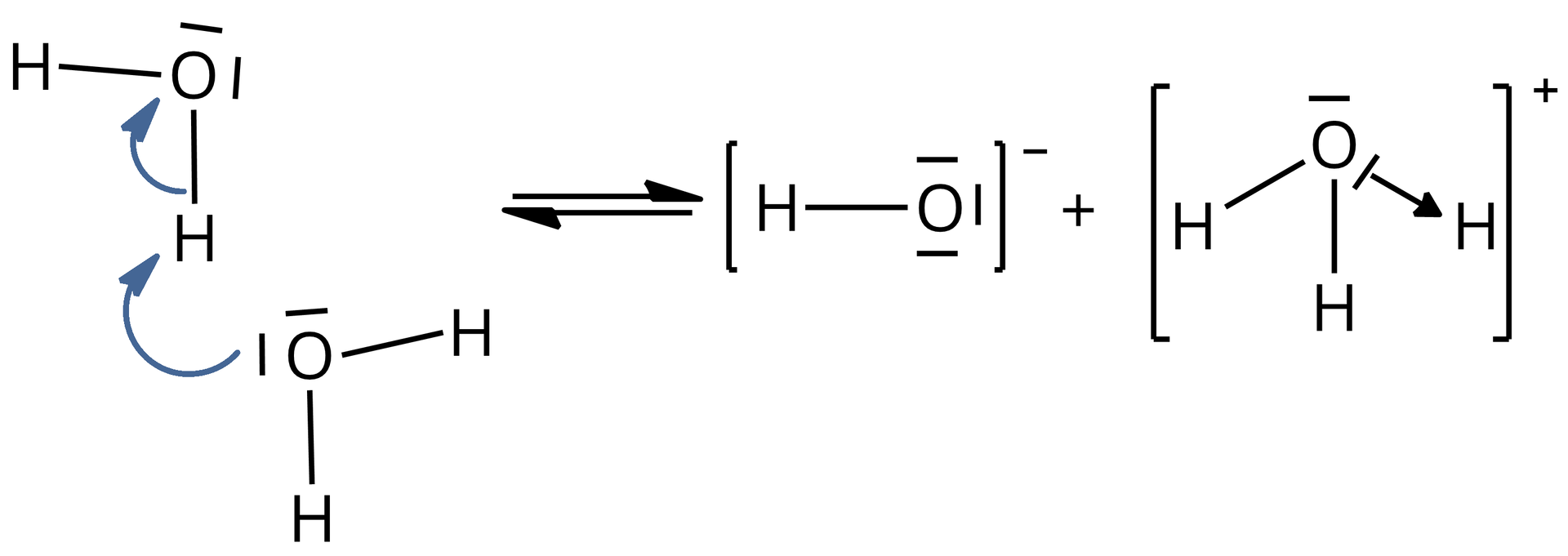
Woda w niewielkim stopniu ulega więc procesowi autodysocjacjiautodysocjacji, której przebieg można zapisać za pomocą równania reakcji:
Nowo utworzone wiązanie kowalencyjne w kationie oksoniowym, czyli , jest wiązaniem donorowo–akceptorowym, ponieważ powstaje z pary elektronowej pochodzącej tylko z jednego tylko atomu, w tym przypadku – z atomu tlenu. Donorem elektronów w kationie oksoniowym jest atom tlenu, natomiast akceptorem atom wodoru.
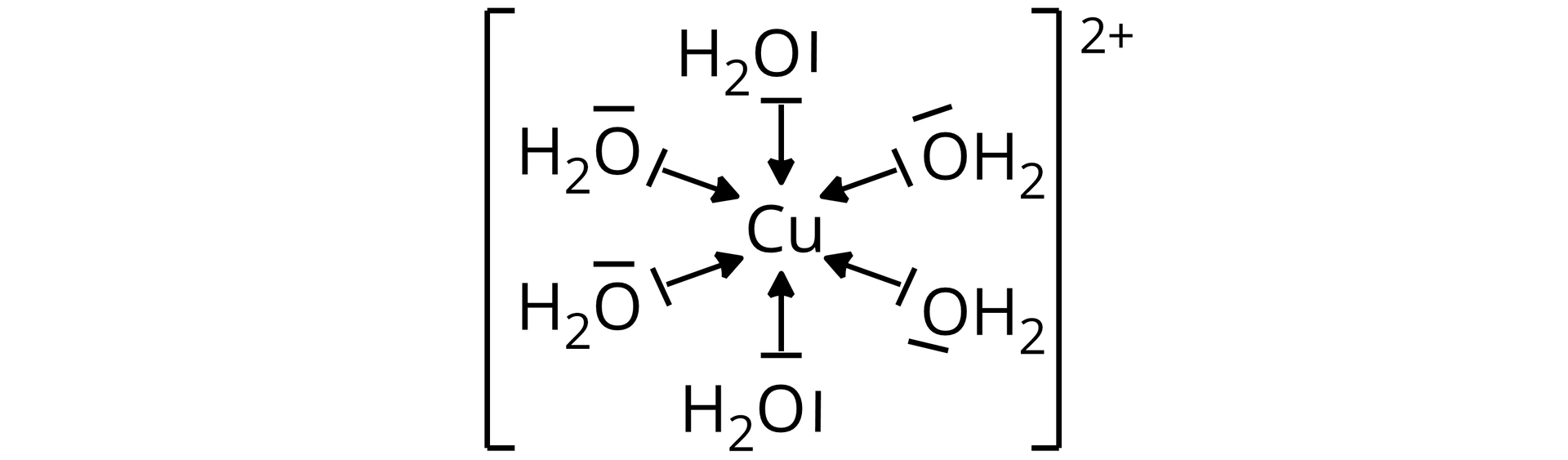
Kationy miedzi() () w roztworach wodnych występują w postaci akwakompleksówakwakompleksów. W cząsteczce wody na atomie tlenu występują dwie wolne pary elektronowe, z czego jedna z nich tworzy wiązanie donorowo–akceptorowe do kationu miedzi(). Każdy kation miedzi() jest otoczony przez sześć cząsteczek wody, tworząc kation heksaakwamiedzi(), .
Słownik
rodzaj wiązania chemicznego, polegającego na uwspólnieniu pary elektronowej, która pochodzi tylko od jednego atomu tworzącego wiązanie; występuje w związkach koordynacyjnych
rodzaj oddziaływania międzycząsteczkowego lub wewnątrzcząsteczkowego, występującego pomiędzy atomem wodoru a elektroujemnym pierwiastkiem, tj. tlenem, fluorem, azotem
dysocjacja elektrolityczna rozpuszczalnika amfiprotycznego zachodząca wskutek wymiany protonów między jego cząsteczkami
związek koordynacyjny, w którym ligandami są cząsteczki wody
jon lub cząsteczka związane koordynacyjnie z atomem centralnym w związkach koordynacyjnych; posiada wolne pary elektronowe, dzięki którym następuje skoordynowanie tej cząsteczki przez atom centralny kompleksu
Bibliografia
Pazdro K., Rola–Noworyta A., Chemia Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2014.
Encyklopedia PWN