Przeczytaj
Czym jest konfiguracja elektronowa?
Konfiguracja elektronowaKonfiguracja elektronowa jest standardowym zapisem, używanym do opisu struktury elektronowej atomu. W przybliżeniu orbitalnym pozwalamy, aby orbital zajmował każdy elektron, co można rozwiązać za pomocą pojedynczej funkcji falowej. W ten sposób otrzymujemy trzy liczby kwantowe, które są takie same, jak te uzyskane z rozwiązania równania Schrödingera dla atomu wodoru Bohra. Stąd wiele zasad, których używamy do opisania położenia elektronu w atomie wodoru, może być również wykorzystane w systemach obejmujących wiele elektronów.
Zapis podpowłokowej konfiguracji elektronowej
Podpowłokowa konfiguracja elektronowa przedstawia sposób zapełniania poszczególnych podpowłok przez elektrony. Aby posłużyć się tą metodą, stosuje się zapis typu , w którym pierwsza liczba oznacza wartość głównej liczby kwantowej (numer powłoki), litera (, , lub ) jest symbolem podpowłoki i umożliwia dokładne określenie pobocznej liczby kwantowej, natomiast liczba w górnym indeksie oznacza liczbę elektronów na danej podpowłoce.
Porównajmy dwa sposoby zapisu konfiguracji elektronowej dla atomu boru w stanie podstawowym.

Konfiguracje elektronowe atomów będą się przedstawiać następująco:
zapis podpowłokowy: : ; zapis powłokowy: ;
zapis podpowłokowy: : ; zapis powłokowy: ;
zapis podpowłokowy: : ; zapis powłokowy: .
Stosuje się również tzw. zapis skrócony konfiguracji podpowłokowej, który wykorzystuje w zapisie symbol gazu szlachetnego poprzedzającego dany pierwiastek w układzie okresowym. Np. dla litu moglibyśmy zapisać:
: .
Podobnie, bazując na konfiguracji elektronowej poprzedzającego gazu szlachetnego (znajdującego się w okresie powyżej), można podać skrócony zapis konfiguracji elektronowej atomu każdego pierwiastka.
Skrócony zapis konfiguracji elektronowej atomu pierwiastka polega na podaniu symbolu poprzedzającego go helowca oraz dopisaniu elektronów, które nie występują w jego atomie.
Klatkowy zapis konfiguracji elektronowej – tzw. zapis graficzny konfiguracji elektronowej
Najbardziej szczegółowy opis przedstawiania konfiguracji elektronowej prezentuje rozmieszczenie elektronów na poziomach orbitalnych. Opis polega na rysowaniu elektronów w kratkach – każda kratka symbolizuje jeden poziom orbitalny. Podpowłoki , , i obejmują odpowiednio , , , poziomów orbitalnych, więc składają się odpowiednio z jednej, trzech, pięciu lub siedmiu połączonych ze sobą kratek, co przedstawiono na poniższym schemacie.

Zwróć uwagę, że każda „kratka” – poziom orbitalny – może pomieścić maks. dwa elektrony. Sposób przypisania wartości magnetycznej liczby kwantowej do poszczególnych kratek, jaki przedstawiono na powyższym schemacie (a więc od najmniejszej wartości dla lewej kratki do największej wartości dla kratki prawej), jest tylko umowny.
Elektrony będą przedstawiane jako pionowe strzałki o zwrocie w górę lub w dół. Odpowiada to zwrotowi wektora spinuspinu, czyli dodatniej lub ujemnej wartości magnetycznej spinowej liczby kwantowej.
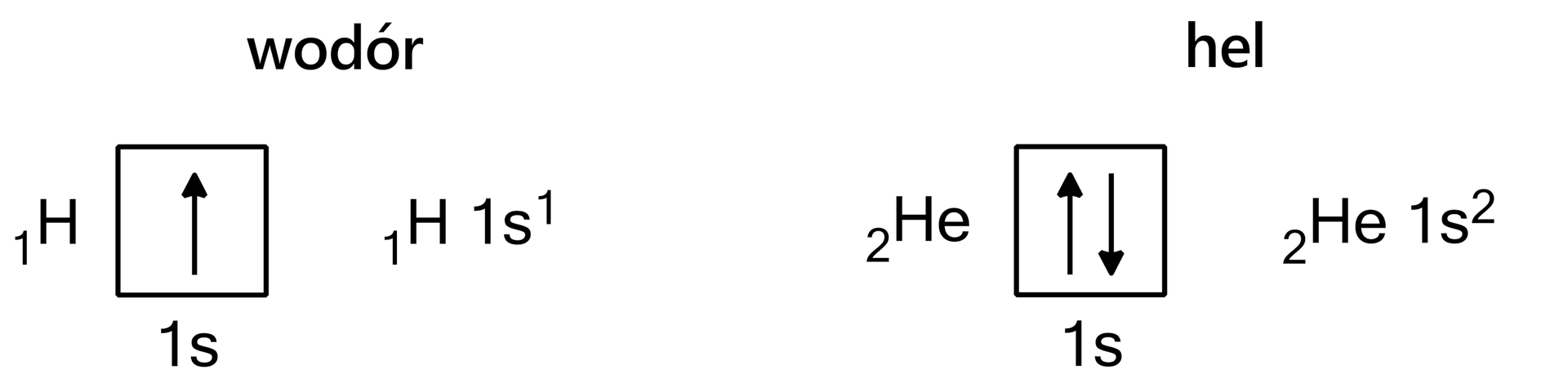
Przypisując elektrony do orbitali, musimy przestrzegać trzech zasad: zasada rozbudowy powłok, zakazu Pauliegozakazu Pauliego i reguły Hundareguły Hunda.
Zakaz Pauliego
Trzy liczby kwantowe (, , ) opisują energię, rozmiar, kształt i orientację przestrzenną orbitalu. Czwarta liczba kwantowa określa dwa stany spinowe. Dowody eksperymentalne sugerują, że elektrony obracają się wokół swoich osi, gdy poruszają się we wnętrzu atomów. Elektron może wirować w jednym z dwóch kierunków, w każdym wytwarzając pole magnetyczne.
Prędkość wirowania elektronów w danym atomie jest taka sama, niezależnie od kierunku, w którym atom obraca się wokół własnej osi. Dlatego właśnie spinowa liczba kwantowa () przyjmuje zawsze wartość . Magnetyczno–spinowa liczba kwantowa () określa kierunek, w którym wiruje elektron. Ma tylko dwie możliwe wartości: lub , bo wirowanie wokół własnej osi może odbywać się tylko w dwóch kierunkach.
W roku szwajcarski fizyk, pochodzenia austriackiego, Wolfgang Pauli zaproponował, że jeden poziom orbitalny mogą zajmować tylko dwa elektrony o przeciwnym kierunku wirowania – a więc o przeciwnej wartości magnetycznej spinowej liczby kwantowej. Ów wniosek stał się znany jako zakaz Pauliegozakaz Pauliego. Polega on na ograniczeniu całkowitej liczby elektronów, które mogą zajmować dowolny orbital. Oznacza to, że orbital może mieć maks. dwa elektrony, a ich spiny muszą być sparowane. A są sparowane, kiedy są ustawione w przeciwnych kierunkach. Orbital może również mieć tylko jeden elektron o dowolnym kierunku wirowania i tak samo może nie mieć żadnych elektronów.
Elektron niesparowany – elektron znajdujący się na poziomie orbitalnym, na którym nie ma innego elektronu.
Elektrony sparowane – dwa elektrony o przeciwnej orientacji spinów, należące do tego samego poziomu orbitalnego.
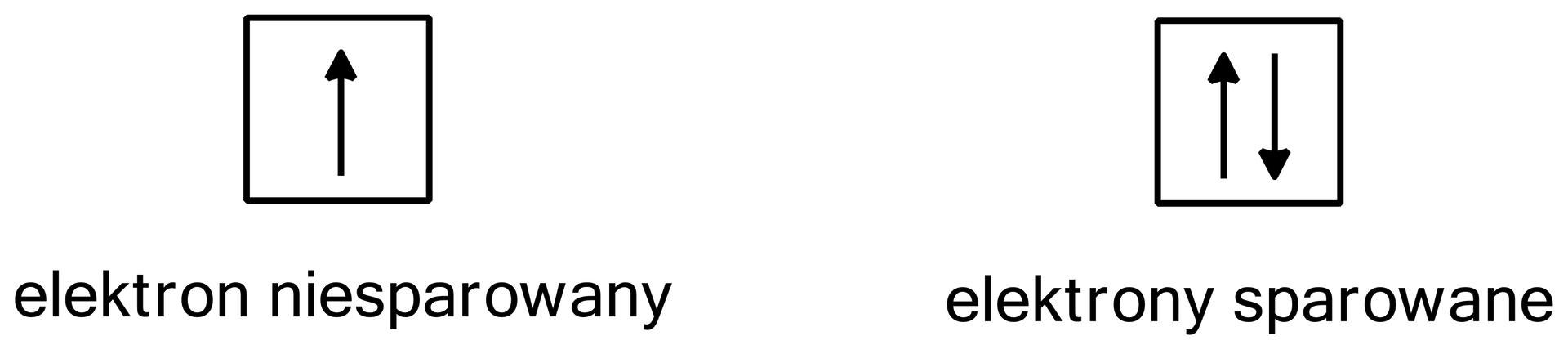
Innym sposobem stwierdzenia zakazu Pauliego jest to, że żadne dwa elektrony w atomie nie mają tych samych wartości wszystkich liczb kwantowych. Ta ważna teza oznacza, że każdy elektron w atomie ma swój unikalny zestaw czterech liczb kwantowych.

Zasada rozbudowy powłok
W ustalaniu kolejności obsadzania powłok, decydującą rolę odgrywa zasada rozbudowy powłok (zasada minimum energii). Elektrony obsadzają powłoki i orbitale, zaczynając od stanu o najniższej energii. Nie pozostawiają żadnych wolnych miejsc. Kolejność jest następująca:

Wyjaśnieniem tego, dość dziwnego na pierwszy rzut oka, sposobu zapełniania podpowłok jest poniższy diagram. Zauważ, że np. energia orbitali jest nieco wyższa niż energia orbitali . Dzięki temu elektrony w pierwszej kolejności obsadzają orbital , a następnie dopiero .

Reguła Hunda
Reguła ta rozwiązuje wiele dylematów podczas rozpisywania konfiguracji elektronowej. Według niej, w danej podpowłoce powinna istnieć możliwie największa liczba niesparowanych elektronów. Te, które obsadzają poziomy orbitalne tej samej podpowłoki, powinny mieć jednakową orientację spinu. Do sparowania elektronów dochodzi dopiero wtedy, gdy elektrony niesparowane zajmą wszystkie poziomy orbitalne danej powłoki.
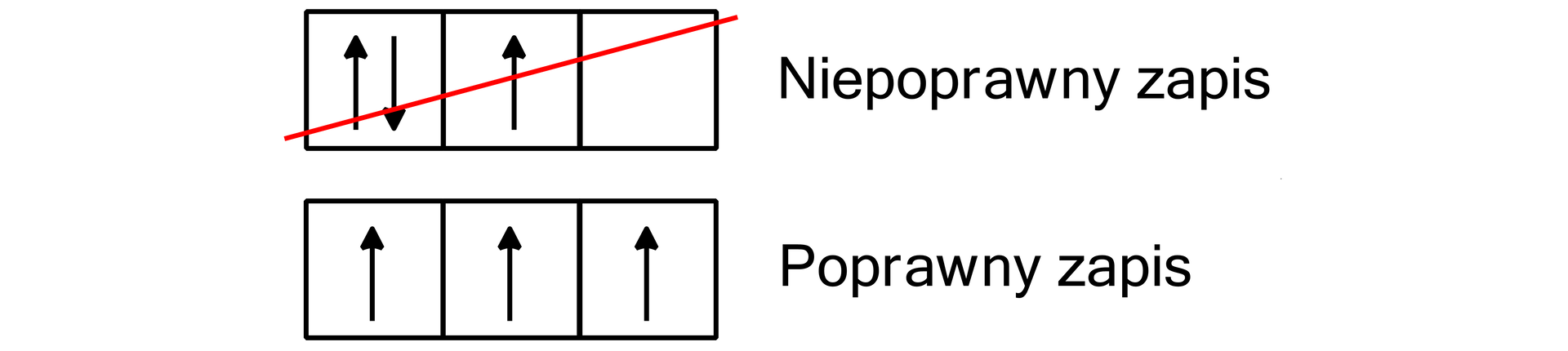
Mając powyższe zasady na uwadze, można przystąpić do rozpisywania konfiguracji elektronowej.
Przedstaw podpowłokową konfigurację elektronową atomu azotu w stanie podstawowym.
Przedstaw pełną podpowłokową konfigurację elektronową oraz skróconą podpowłokową konfigurację elektronową (zawierającą rdzeń gazu szlachetnego) atomu jodu w stanie podstawowym.
Zapisz pełną podpowłokową konfigurację elektronową dla atomu wapnia.
Zjawisko promocji elektronowej
Atom chromu, który posiada elektrony, powinien mieć konfigurację . Okazuje się jednak, że różnica energii między poziomami a jest bardzo niewielka. Dlatego korzystniejszym energetycznie stanem jest umieszczenie pięciu elektronów na podpowłoce . Zysk energetyczny, który wynika z rozdzielenia pary elektronów , wyrównuje z nawiązką nakład energii, potrzebny do przeniesienia elektronu z podpowłoki na .
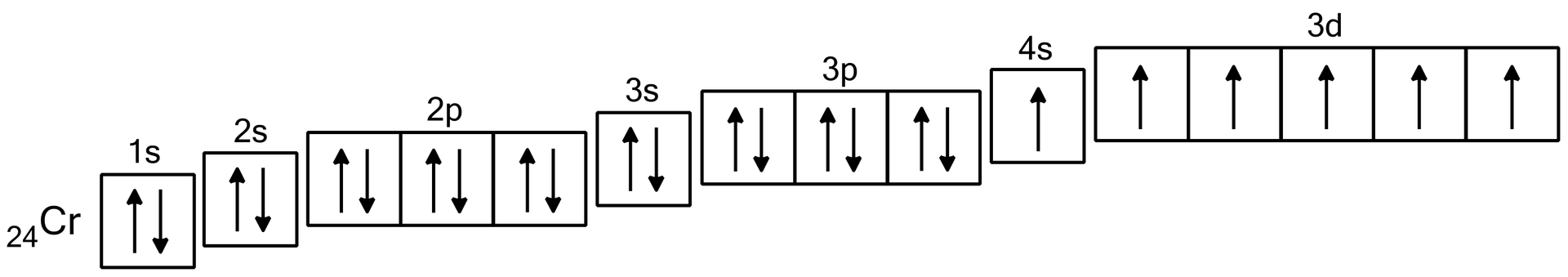
Konfiguracje i należą do szczególnie trwałych, stąd kolejnym wyjątkiem jest miedź. Konfiguracja jej wygląda następująco: .
Opisane zjawisko przeniesienia elektronu z podpowłoki typu na podpowłokę typu , spotykane np. w przypadku chromu i miedzi, nazywamy zjawiskiem promocji elektronowej.
Konfiguracja elektronowa dla kationów
Sposób, w jaki wyznaczamy konfiguracje elektroniczne dla kationów, jest zasadniczo podobny do sposobu przeznaczonego dla atomów w ich stanie podstawowym. Oznacza to, że przestrzegamy trzech ważnych zasad: zasady rozbudowy powłok, zakazu Pauliego i reguły Hunda. W celu tworzenia kationów lub podnoszenia ładunku kationów, należy usuwać elektrony z ostatniej powłoki elektronowej, w kolejności . Tak wiec najpierw należy usunąć wszystkie elektrony podpowłoki ostatniej powłoki, następnie wszystkie elektrony podpowłoki ostatniej powłoki i wtedy dopiero możemy usunąć elektrony z podpowłoki ostatniej powłoki.
Przykładowo – konfiguracja elektronowa atomu wapnia w stanie podstawowym () wynosi .
Jon wapniowy () ma jednak dwa elektrony mniej. Stąd konfiguracja elektronów dla wynosi .
Konfiguracja elektronowa atomu żelaza w stanie podstawowym wynosi:
: .
Atom żelaza może oddać dwa elektrony z orbitalu .
Konfiguracja elektronowa : .
Atom żelaza może także oddać trzy elektrony – dwa pochodzące z oraz jeden pochodzący z podpowłoki .
Konfiguracja elektronowa : .
W pierwszej kolejności należy usunąć elektrony z , a dopiero później z , ponieważ ostatnią powłokę stanowią elektrony czwartej powłoki, a z podpowłoki trzeciej możemy usuwać elektrony dopiero po zupełnym usunięciu ich z powłoki ostatniej, czyli czwartej.
Słownik
zapis przedstawiający poszczególne powłoki, podpowłoki i orbitale atomu wraz z obsadzającymi je elektronami
inaczej zasada Pauliego; podstawowa zasada fizyki kwantowej, wg której w układzie złożonym z identycznych cząstek o spinie połówkowym (fermionów) dwie cząstki nie mogą znajdować się w tym samym stanie kwantowym
reguły empiryczne, opisujące sposób obsadzenia podpowłok i orbitali przez elektrony w atomie, który znajduje się w stanie podstawowym
wewnętrzny moment pędu mikrocząstki (cząstki elementarnej, jądra atomowego) mierzony w jej układzie spoczynkowym
Bibliografia
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Saunders N., Saunders A., AS Chemistry, Oxford 2007.
Encyklopedia PWN