Przeczytaj
Początki elektrochemii

W roku włoski naukowiec Luigi Galvani zaobserwował pewne zjawisko. Po przyłożeniu do żabiego udka dwóch różnych połączonych ze sobą metali zauważył kurczenie się mięśni. Przypuszczał on, że zjawisko to jest spowodowane istnieniem tzw. elektryczności zwierzęcej. Wynikało to z tego, iż w tym czasie znane były już gatunki ryb wytwarzające ładunek elektryczny. Przeszło dekadę później wynikami Galvaniego zainteresował się inny włoski uczony – Alessandro Volta. Słusznie wyjaśnił on zaobserwowane zjawisko. Skurcz mięśni był wynikiem podrażnienia nerwu prądem elektrycznym przepływającym między metalami. Przeprowadził on eksperyment: w wodzie morskiej (będącej niejako roztworem chlorku sodu) zanurzył dwa połączone ze sobą różne kawałki metalu. Zauważył on przepływ prądu. Odkrycia tej dwójki uczonych uznawane są za początki elektrochemii.
Ogniwo galwaniczne
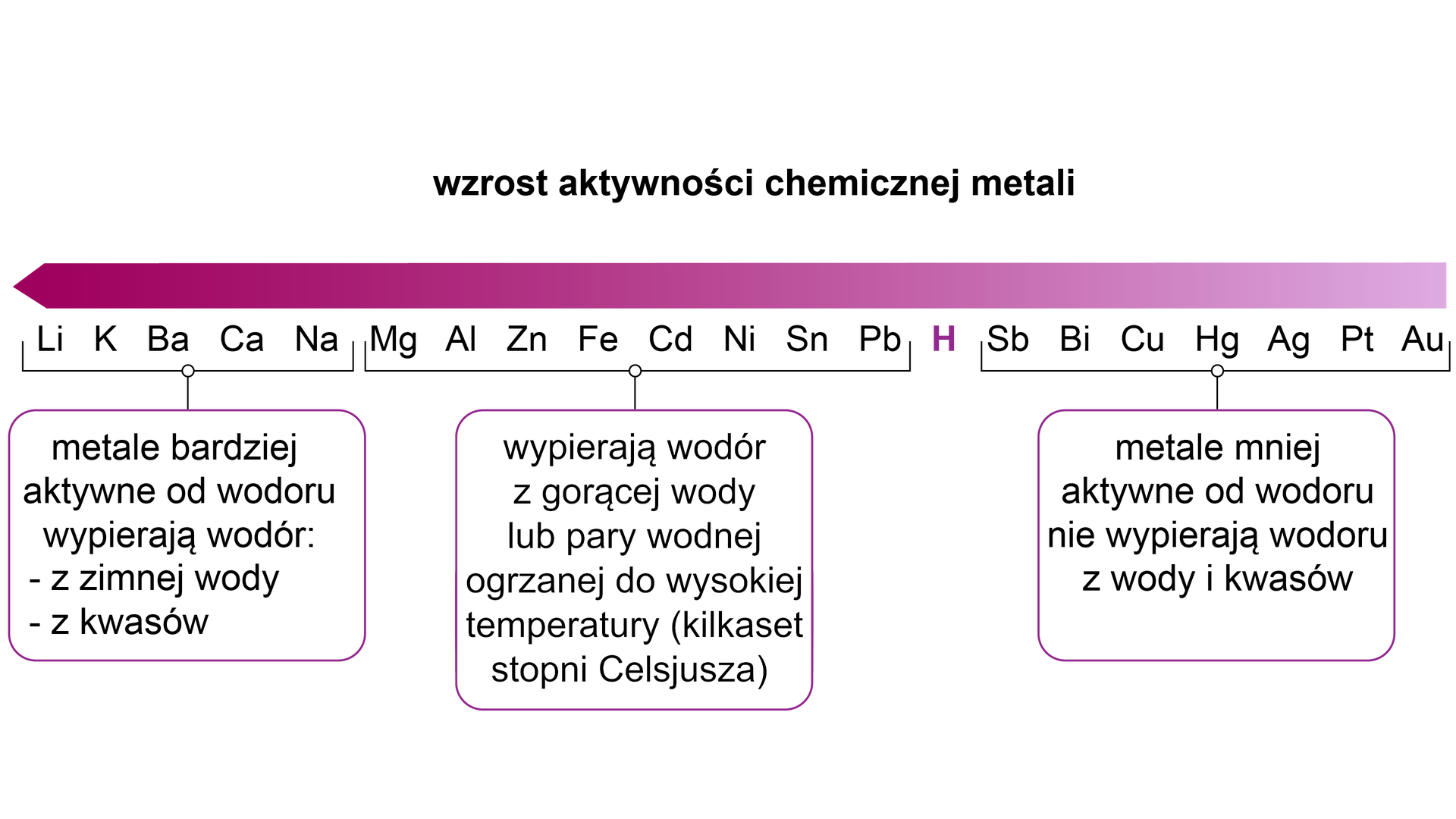
Ogniwo galwaniczne jest to układ wytwarzający energię elektryczną w wyniku przebiegającej w nim reakcji chemicznej. W praktyce jest to układ dwóch połączonych ze sobą półogniwpółogniw – czyli płytek metalu zanurzonych w roztworze. Metal bardziej aktywny (czyli taki, który jest powyżej wodoru w szeregu aktywności metaliszeregu aktywności metali) pełni funkcję anodyanody (roztwarza się w roztworze) oraz ma znak ujemny. Na tej elektrodzie zachodzi proces utleniania. Mniej aktywny metal natomiast pełni funkcję katodykatody (jony tego metalu redukują się na płytce), a elektroda ma znak dodatni. Na katodzie zachodzi proces redukcji.
Omówmy teraz budowę ogniwa na przykładzie ogniwa Daniella.
W ogniwie Daniella płytka cynkowa zanurzona jest w roztworze siarczanu() cynku, a płytka miedziana w roztworze siarczanu() miedzi(). Roztwory te połączone są ze sobą nasyconym roztworem elektrolitu umieszczonym w rurce, pełniącą funkcję klucza elektrolitycznegoklucza elektrolitycznego. Klucz elektrolityczny umożliwia wędrówkę jonów z jednego roztworu do drugiego.

Po połączeniu obu płytek ze sobą, płytka cynkowa zacznie się roztwarzać w roztworze siarczanu() cynku, więc do roztworu zaczną przedostawać się jony zgodnie z równaniem:
Oddawane w ten sposób elektrony przechodzą do elektrody miedzianej. Obecne w roztworze jony będą pobierały elektrony z powierzchni miedzi i zacznie przebiegać reakcja:
Jak łatwo zauważyć na elektrodzie cynkowej zaszła reakcja utleniania, więc elektrodę cynkową nazywać będziemy anodą. Na elektrodzie miedzianej zaszła reakcja redukcji, więc będziemy nazywać ją katodą.
Graficzne przedstawianie ogniw byłoby bardzo uciążliwe. Dlatego też, aby schematycznie zapisać takie ogniwo, stosuje się tzw. konwencję sztokholmskąkonwencję sztokholmską.
W konwencji sztokholmskiej ogniwa zapisuje się w następujący sposób:

Po lewej stronie zapisuje się symbol metalicznej anody. Pionowa kreska oznacza granicę faz pomiędzy metalem a roztworem, dwie pionowe kreski oznaczają klucz elektrolityczny, za nim skład roztworu katodowego, pionowa kreska oddzielająca granicę faz pomiędzy roztworem katodowym a katodą, metaliczna katoda.
Ogniwo Daniella wg. konwencji sztokholmskiej zapiszemy jako:
Konstruowanie ogniw
Przed rozpoczęciem eksperymentu zapoznaj się z kartami charakterystyk używanych w doświadczeniu odczynników. Pamiętaj o zachowaniu ostrożności, zastosowaniu środków ochrony osobistej (rękawiczki, fartuch, okulary ochronne) oraz o zachowaniu zasad bezpieczeństwa.
Eksperyment 1
Na podstawie zgromadzonego sprzętu oraz materiału badawczego wykonaj doświadczenie w laboratorium chemicznym, w którym skonstruujesz ogniwo. Zaproponuj problem/problemy badawcze oraz hipotezę/hipotezy. Następnie rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje wyniki, a następnie sformułuj wnioski.
1. Aby zbudować ogniwo, należy przygotować odpowiednie półogniwa. W celu zbudowania półogniw należy do zlewek wlać roztwory odpowiednich soli. U-rurkę należy wypełnić nasyconym roztworem azotanu(V) potasu i zatkać bibułą. Płytki metalu należy odpowiednio przygotować poprzez dokładne oczyszczenie papierem ściernym, przemycie wodą destylowaną oraz osuszenie. Tak przygotowane elektrody należy wprowadzić do roztworów ich soli.
2. Skonstruuj ogniwo . Połącz odpowiednie półogniwa kluczem elektrolitycznym. Do elektrod przymocuj przewody zaopatrzone w krokodylki połączone z woltomierzem. Elektrody połącz w taki sposób, aby woltomierz wskazywał wartość dodatnią.
3. Skonstruuj ogniwo, w którym jednym z półogniw będzie , a drugim półogniwem jedno z pozostałych półogniw. Dla każdego odczytaj wartość z woltomierza. Jeżeli wartość odczytana na woltomierzu jest dodatnia, oznacza to, że elektrodą dodatnią jest półogniwo , jeżeli woltomierz pokazuje wartość ujemną, oznacza to, ze ogniwo jest elektrodą ujemną. Wyniki eksperymentu zapisz w tabeli.
Eksperyment 2
Na podstawie zgromadzonego sprzętu oraz materiału badawczego wykonaj doświadczenie w laboratorium chemicznym, w którym skonstruujesz ogniwo. Zaproponuj problem/problemy badawcze oraz hipotezę/hipotezy. Następnie rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje wyniki, a następnie sformułuj wnioski.
1. Wbij w owoc lub warzywo płytkę miedzianą oraz cynkową (odległość płytek powinna wynosić około 2 cm).
2. Połącz płytki ze sobą za pomocą woltomierza.
3. Odczytaj wartość wskazywaną przez aparat.
Podsumowanie
Odkrycie ogniw galwanicznym było ogromnym krokiem milowym w rozwoju nauki oraz życia codziennego. Przemiana energii chemicznej w elektryczną towarzyszy nam w życiu codziennym w naszych telefonach komórkowych czy tabletach.
Słownik
najczęściej metal zanurzony w roztworze swojej soli
(z gr. kata – „pod”, „w dół”) elektroda o ładunku dodatnim, na której zachodzi proces redukcji
(gr. ánodos „droga w górę”) w ogniwie galwanicznym jest to elektroda posiadająca ładunek ujemny; zachodzi na niej reakcja utleniania
nasycony roztwór elektrolitu pozwalający na przepływ jonów z jednego półogniwa do drugiego bez mieszania się roztworów
pisanie schematów ogniw w zapisie ogniwa:
przedstawienie zdolności metali do wypierania wodoru z roztworu kwasów lub wody
Bibliografia
Sobczyk L., Kisza A., Chemia fizyczna dla przyrodników, Warszawa .
Hejwowska S., Chemia , Gdynia .