Przeczytaj
Ozon stratosferyczny
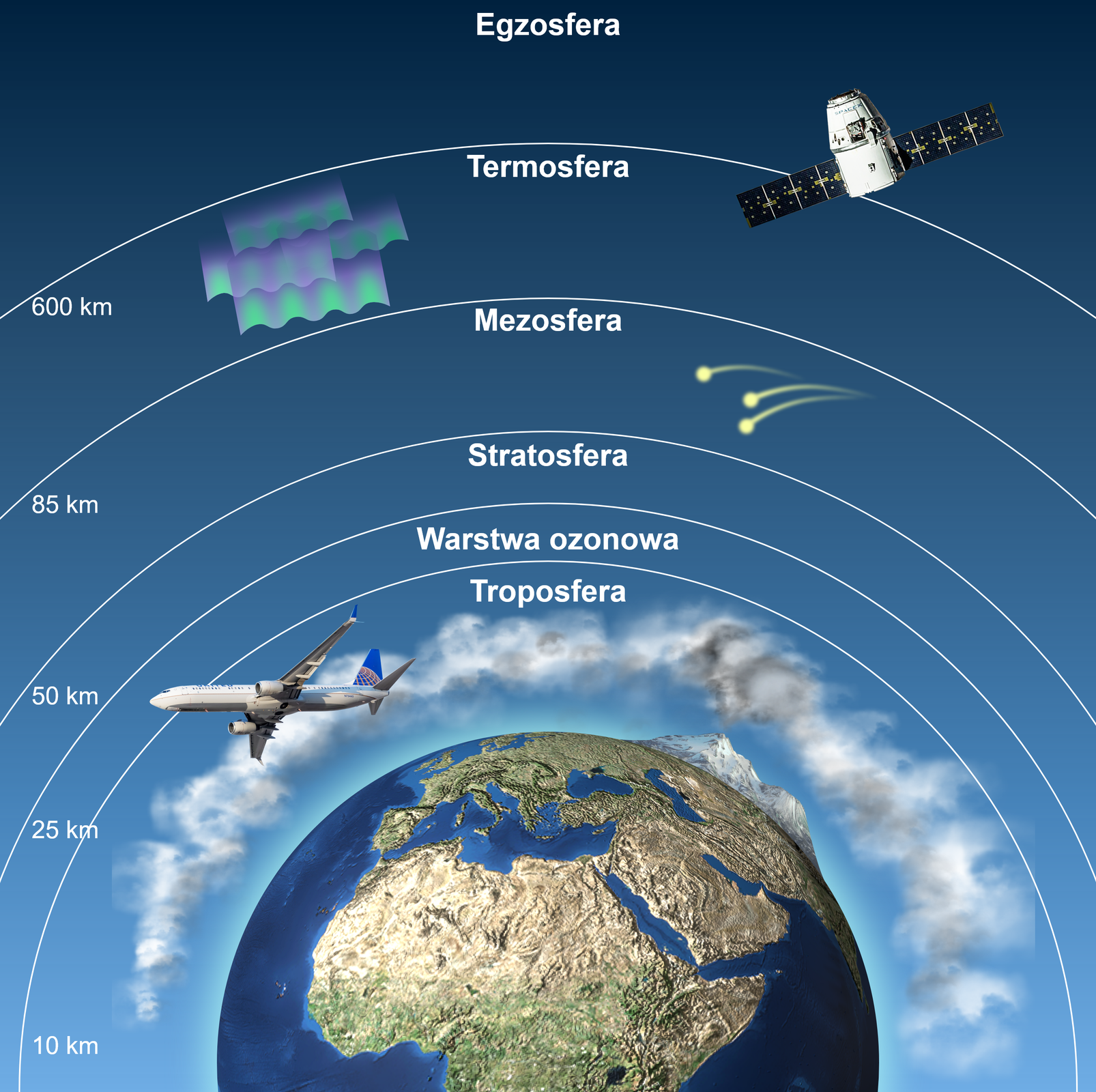
W stratosferze współwystępują dwie formy tlenu: „zwykły”, czyli tlen , składający się z dwóch atomów tlenu, oraz ozon , składający się z trzech atomów tlenu. Przy obecności promieniowania UV jedna z tych form może przekształcić się w drugą.
Wiązanie podwójne w cząsteczce tlenu zostaje rozerwane. Wolny atom tlenu wchodzi w reakcję z inną cząsteczką tlenu, w efekcie powstaje ozon.
Analogicznie, ozon jest niszczony przez fotolizę, jeśli jedno z wiązań połówkowych w cząsteczce ozonu jest rozerwane przez promieniowanie słoneczne. W takim wypadku tworzy się cząsteczka tlenu oraz atom tlenu, który wchodzi w reakcję z inną cząsteczką ozonu, i tworzą się dwie cząsteczki tlenu .

Cykl ozonowy
Ozon powstaje w górnych warstwach atmosfery pod wpływem działania promieniowania UV na cząsteczkę . W wyniku pochłonięcia fotonu światła (o długości fali mniejszej niż 240 nm) wiązanie podwójne cząsteczki tlenu zostaje rozerwane. Utworzony atom tlenu wchodzi w reakcję z cząsteczką tlenu i powstaje ozon .

Promieniowanie ultrafioletowe z zakresu 240–310 nm przyczynia się do fotolizy (procesu niszczenia ozonu):
W wyniku rozpadu ozonu utworzony atom tlenu wchodzi w reakcję z inną cząsteczką ozonu i tworzą się dwie cząsteczki tlenu lub reaguje on z innym atomem tlenu i powstaje cząsteczka tlenu :
Zespół powiązanych reakcji chemicznych, przedstawiających przemiany, którym podlega ozon stratosferyczny (z czym związana jest przemiana promieniowania ultrafioletowego w energię cieplną), to tzw. cykl ozonowo‑tlenowy, nazwany też cyklem Chapmana - na cześć jego odkrywcy - brytyjskiego matematyka i geofizyka Sydneya Chapmana.
Promieniowanie słoneczne jest najsilniejsze w obszarach międzyzwrotnikowych, dlatego też właśnie tam tworzy się najwięcej ozonu. Energia słoneczna powoduje w tym regionie Ziemi, nie tylko tworzenie się znacznych ilości ozonu, ale także wynoszenie powietrza troposferycznego na duże wysokości.
Stężenie ozonu atmosferycznego jest różne w zależności od szerokości geograficznej. Jego ilość wzrasta każdego roku w wyniku działań podjętych wytycznymi Protokołu montrealskiego, zawartego w 1987 r. (Protokół montrealski w sprawie substancji zubożających warstwę ozonową). Protokół zakładał wykluczenie z użycia CFC (chlorofluorowęglowodory, inaczej freony) oraz części halonów (lista substancji wykluczonych z użycia była poszerzana w kolejnych protokołach podpisywanych, m.in. Londynie, Kopenhadze czy Wiedniu). Działania państw, które podpisały i wdrożyły w życie ustalenia w nich zawarte, doprowadziły do znaczącego spadku produkcji substancji zubożających warstwę ozonową, zatrzymania wzrostu zasięgu dziury ozonowej oraz umożliwiły jej regenerację. Szacuje się, że dzięki wprowadzonym działaniom, ok. 2050‑2060 r. problem dziury ozonowej zostanie skutecznie rozwiązany.
Ozon jest przenoszony znad równika ku biegunom, gdzie gromadzi się w chłodnych obszarach okołobiegunowych.
Obszar międzyzwrotnikowy charakteryzuje się występowaniem najsilniejszego promieniowania słonecznego, wpływa to wprost proporcjonalnie na tworzenie w tej strefie największej ilości ozonu. Równocześnie nad równikiem fotochemiczne niszczenie przebiega bardzo intensywnie, w efekcie ozon nie może się tam gromadzić.
Wysokie temperatury strefy międzyzwrotnikowej wpływają na unoszenie się podgrzanego powietrza na duże wysokości. W wyniku naturalnej globalnej cyrkulacji powietrza ozon jest przenoszony znad strefy zwrotnikowej ku biegunom, gdzie masy powietrza ulegają schłodzeniu, a rozpad fotochemiczny zanika – zwłaszcza podczas nocy polarnej. W okresie, kiedy na półkuli północnej rozpoczyna się pora wiosenna, nad Antarktydą zaczyna się noc polarna. Tworzy się wtedy regularny, stabilny, trwający pół roku wir, w którym powietrze krąży wokół bieguna południowego. Masy powietrza antarktycznego są wtedy całkowicie odizolowane od mas powietrza zawierającego ozon, a w wyniku mocno ograniczonej ilości promieniowania UV ograniczone są możliwości zajścia procesów ozonowo‑tlenowych.
Ozon troposferyczny
Ozon troposferyczny jest zanieczyszczeniem wtórnym, co oznacza, że nie jest emitowany do atmosfery, lecz tworzy się w powietrzu w wyniku reakcji tlenków azotu ( i ) i lotnych związków organicznychlotnych związków organicznych (LZO) pod wpływem promieniowania. Związki te nazywamy prekursorami ozonu.
Tlenek azotu(II) i tlenek azotu(IV) są emitowane głównie przez samochody oraz przemysł. Ich emisja prowokuje powstawanie ozonu, w wyniku czego najwyższe stężenia ozonu troposferycznego obserwujemy na obszarach miejskich i podmiejskich. Bogate w powietrze unosi się nad ulicami i autostradami, ulegając utlenieniu do w reakcji z tlenem i/lub ozonem.

Drugim istotnym czynnikiem decydującym o tworzeniu się ozonu są organiczne rodniki nadtlenkowe ( i ). Cząsteczki organiczne () są emitowane naturalnie przez lasy i roślinność niską oraz antropogenicznie (np. stacje paliw). Cząsteczki organiczne pod wpływem światła słonecznego reagują z rodnikami hydroksylowymi , następnie z cząsteczkami tlenu. W efekcie powstaje rodnik nadtlenowy ().
Ze względu na charakter reakcji tworzenia ozonu, wysokie stężenia występują najczęściej w słoneczne i ciepłe dni o słabym wietrze.
Tworzenie ozonu troposferycznego
Cykl tworzenia ozonu troposferycznego:
tlenek azotu(IV) jest rozkładany przez promieniowanie słoneczne i tworzy atomy i tlenek azotu(II) ;
atomy reagują z tlenem cząsteczkowym w powietrzu i tworzą ozon ();
tlenek azotu reaguje z rodnikami nadtlenowymi i znów tworzy
pewna część ozonu przereaguje z w zależności od stężenia rodników nadtlenowych .
Ostatecznie rodniki są zużywane i powstaje ozon, podczas gdy tlenki azotu są zawsze powtórnie przetworzone. Reakcja zajdzie wyłącznie, gdy spełnione zostaną poniższe warunki:
wystarczająca ilość światła słonecznego, aby nastąpiła skuteczna fotolizafotoliza;
wystarczająca ilość rodników nadtlenowych i tlenków azotu w powietrzu, aby wzbudzić tworzenie się ozonu.
Jeśli w powietrzu nie ma tlenków azotu, to cały opisany cykl reakcji nie nastąpi. Jeśli tlenków azotu jest zbyt dużo, nadmiar tlenku azotu reaguje nie tylko z rodnikami nadtlenowymi, ale jeszcze dodatkowo usuwa ozon. Jeśli brak światła słonecznego, to nie może zostać powtórnie użyty i tworzy się za mało rodników nadtlenowych. Zwykle w powietrzu ilość tlenków azotu nie jest wystarczająco duża, aby powstał groźny smog ozonowy.

Ozon jest silnym utleniaczem – wnikając do dróg oddechowych człowieka, powoduje ich podrażnienie i dyskomfort w oddychaniu. Narażenie na ozon jest szczególnie niebezpieczne dla osób cierpiących na schorzenia układu oddechowego oraz osoby o obniżonej odporności organizmu, przede wszystkim osoby starsze i dzieci.
Stężenie powietrza | Skutki oddziaływania ozonu |
|---|---|
40 | wyczuwalny zapach |
100 | ból głowy, podrażnienie oczu |
110 | podrażnienie dróg oddechowych, obniżenie wydolności |
160 | zapalenie dróg oddechowych |
180 | wartość progowa informowania społeczeństwa o ryzyku wystąpienia przekroczeń poziomów dopuszczalnych |
200 | problemy z oddychaniem |
240 | alarmowe poziomy stężeń ozonu |
260 | możliwość wystąpienia ataków astmy |
> 400 | obniżona wydolność, trwałe zniszczenia komórek |
> 1000 | uszkodzenia chromosomów |
Indeks górny Źródło: www.wios.warszawa.pl Indeks górny koniecŹródło: www.wios.warszawa.pl

Słownik
LZO (, ang. volatile organic compounds) – grupa związków organicznych; występują jako uboczne produkty w wielu procesach przemysłowych i stanowią źródło zanieczyszczeń środowiska, także jako indykatory ozonu troposferycznego
dysocjacja fotochemiczna, fotodysocjacja – proces, w którym w wyniku absorpcji kwantu światła następuje zerwanie wiązania w cząsteczce, co często prowadzi do jej rozpadu na prostsze fragmenty; produkty fotolizy inicjują zwykle dalsze reakcje chemiczne, często procesy łańcuchowe; ważnym przykładem fotolizy jest proces zerwania wiązań w cząsteczce wody i powstawanie wodoru i tlenu, który zachodzi w roślinach zielonych (wodór wykorzystywany jest w dalszym etapie fotosyntezy, tlen wydalany zostaje do atmosfery); inny przykład fotodysocjacji stanowi zachodząca w ozonosferze reakcja rozpadu cząsteczek tlenu na reaktywne atomy, które w reakcjach wtórnych z cząsteczkami tlenu tworzą cząsteczki ozonu
Bibliografia
Durecki T., Wpływ warunków meteorologicznych na dobowy i roczny rytm zanieczyszczenia powietrza w Łodzi w latach 2004‑2010, Uniwersytet Łódzki.
Rozporządzenie Ministra Gospodarki z dnia 16 stycznia 2007 r. w sprawie szczegółowych wymagań dotyczących ograniczenia emisji lotnych związków organicznych powstających w wyniku wykorzystywania rozpuszczalników organicznych w niektórych farbach i lakierach oraz w preparatach do odnawiania pojazdów (Dz.U. z 2007 r. nr 11, poz. 72).
Rozbicka K., Michalak M., Charakterystyka stężeń wybranych zanieczyszczeń powietrza na obszarze Warszawy (Poland), „Prz. Nauk. Inż. Kszt. Środ.” 2015, nr 68, s. 193–206. Ozon, online: https://powietrze.uni.wroc.pl/base/t/ozon, dostęp: 05.03.2022.
Oracz K., Rodnik Hydroksylowy –mała cząsteczka o dużym znaczeniu w biologii komórki roślinnej, „Postępy Biologii Komórki” 2015, t. 42, nr 4, s. 707‑726, online: http://agrobiol.sggw.pl/fizjologia/media/Oracz%202015.pdf, dostęp: 05.03.2022.