Przeczytaj
Czynniki wpływające na korozję
Czynnikami powodującymi korozję są procesy chemiczne, elektrochemiczne, biologiczne i mechaniczne.
Korozja chemiczna i elektrochemiczna
Korozja chemiczna zachodzi pod wpływem tlenu z powietrza atmosferycznego, chloru oraz tlenków siarki i azotu (bezwodników kwasów). W przypadku korozji elektrochemicznej powstają ogniwa galwaniczne. W obecności elektrolitu (woda wraz z rozpuszczonymi gazami i solami), powodującego zamknięcie obwodu, zaczynają zachodzić niekorzystne procesy korozyjne. Procesy korozji elektrochemicznej i chemicznej niekiedy przebiegają równocześnie.
Procesy zachodzące na powierzchni korodowanej stali w obecności wody
W przypadku żelazażelaza i jego stopówstopów, na powierzchni, w wyniku korozji, czyli niszczenia, powstaje rdzardza, czyli mieszanina tlenków, wodorotlenków i węglanów żelaza.
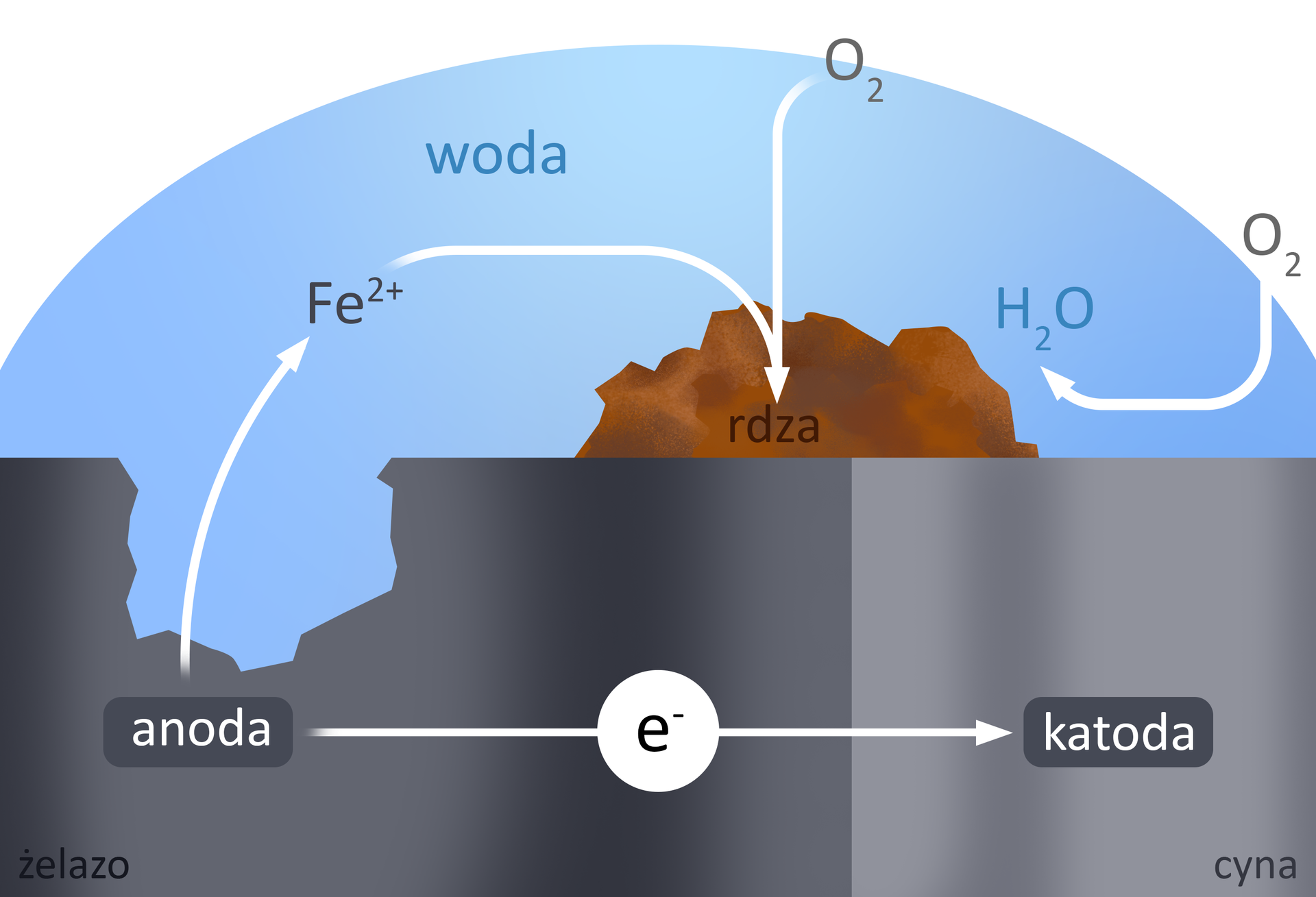
Wodorotlenki żelaza częściowo przechodzą w tlenki żelaza lub węglany żelaza pod wpływem z powietrza.
Procesy zachodzące podczas korozji srebra i miedzi
Innym przykładem korozji może być patynapatyna na miedzi lub czarny osad siarczku srebra na wyrobach ze srebra. Co ciekawe, niektórzy naukowcy nie zaliczają do korozji powstawania patyny na miedzi, czyli tzw. śniedzi. Zdania w tym temacie są podzielone.
Zielonkawa barwa materiałów miedzianych spowodowana jest powstawaniem tzw. śniedzi (patyny) - na miedzi.
Srebro czernieje w wyniku kontaktu ze związkami zawierającymi siarkę. Nasz organizm również wydala je wraz z potem. Skład naszego potu oraz ilość substancji wydzielanych z potem może się zmieniać. Zależne jest to np. od naszej diety oraz zażywania niektórych leków. Może nastąpić wówczas zwiększone wydalanie związków siarki przez nasz organizm i nasza biżuteria może gwałtownie ulec poczernieniu.
Czernienie wyrobów ze srebra spowodowane jest powstawaniem siarczku(II) srebra.
Procesy zachodzące podczas korozji aluminium
Glin pod wpływem tlenu pokrywa się warstewką , która zapobiega procesom utleniania głębszych warstw glinu. Tlenek glinu jest odporny na działanie słabych kwasów i wody:
Matowienie powierzchni glinu (pasywacja) to rodzaj korozji. Glin pod wpływem tlenu pokrywa się warstewką , która zapobiega procesom utleniania głębszych warstw glinu. Tlenek glinu jest odporny na działanie słabych kwasów i wody.
Korozja biologiczna
W przypadku korozji biologicznej, istotną rolę odgrywa działanie organizmów żywych (często bakterii). Zarówno beztlenowce, jak i bakterie używające tlenu, mogą powodować korozję biologiczną. Na przykład bakterie redukują w środowisku beztlenowym siarczany do siarkowodoru i siarczków, co przyczynia się do niebezpiecznej korozji niektórych metali, w tym np. stali nierdzewnej. Beztlenowe bakterie redukujące siarczany inicjują i przyspieszają elektrochemiczną korozję kadłubów statków morskich.
Korozja mechaniczna
Z kolei w przypadku korozji mechanicznej, to na skutek naprężeń mechanicznych, prowadzących do pękania przedmiotów metalowych następuje korozja elektrochemiczna.
Badania korozyjne
Badania korozyjne prowadzone są w celu określenia szybkości korozji metali i stopów metali, właściwości ochronnych powłok, wpływu środowiska na zmiany właściwości mechanicznych materiałów, itp. Bada się oddziaływanie takich czynników jak: temperatura, wilgotność, stężenie składników korozyjnych (np. , , amoniak, kwasy, chlorki).
Często stosuje się takie metody oceny korozji jak:
metoda wizualna oceny zmian wyglądu powierzchni,
metoda wagowa - ocenia się zmiany masy i wymiarów.
Badanie korozji metali
Wykonaj poniższe doświadczenie, uzupełnij brakujące obserwacje i sformułuj wnioski.
Odczynniki:
Wykonanie doświadczenia:
Umieszczony w probówce metal należy do połowy zalać roztworem:
Probówka 1. woda destylowana + gwóźdź.
Probówka 2. roztwór 2% NaCl + gwóźdź.
Probówka 3. roztwór 2% kwasu octowego + gwóźdź.
Probówka 4. roztwór 2% NaCl + gwóźdź owinięty drutem miedzianym.
Schemat doświadczenia:

Po 24 godzinach oddziaływania danego roztworu na wybrany metal:
Probówka 1. Obserwujemy jasnożółte zabarwienie roztworu oraz nieco osadu na dnie probówki.
Probówka 2. Obserwujemy żółtobrunatny roztwór oraz brunatny osad na dnie probówki.
Probówka 1. W wodzie destylowanej jest mało jonów będących nośnikami ładunku i reakcja przebiega powoli.
Probówka 2. Duża ilość jonów powstałych z dysocjacji NaCl powoduje zwiększenie przewodnictwa elektrycznego i przyspieszenie reakcji korozji.
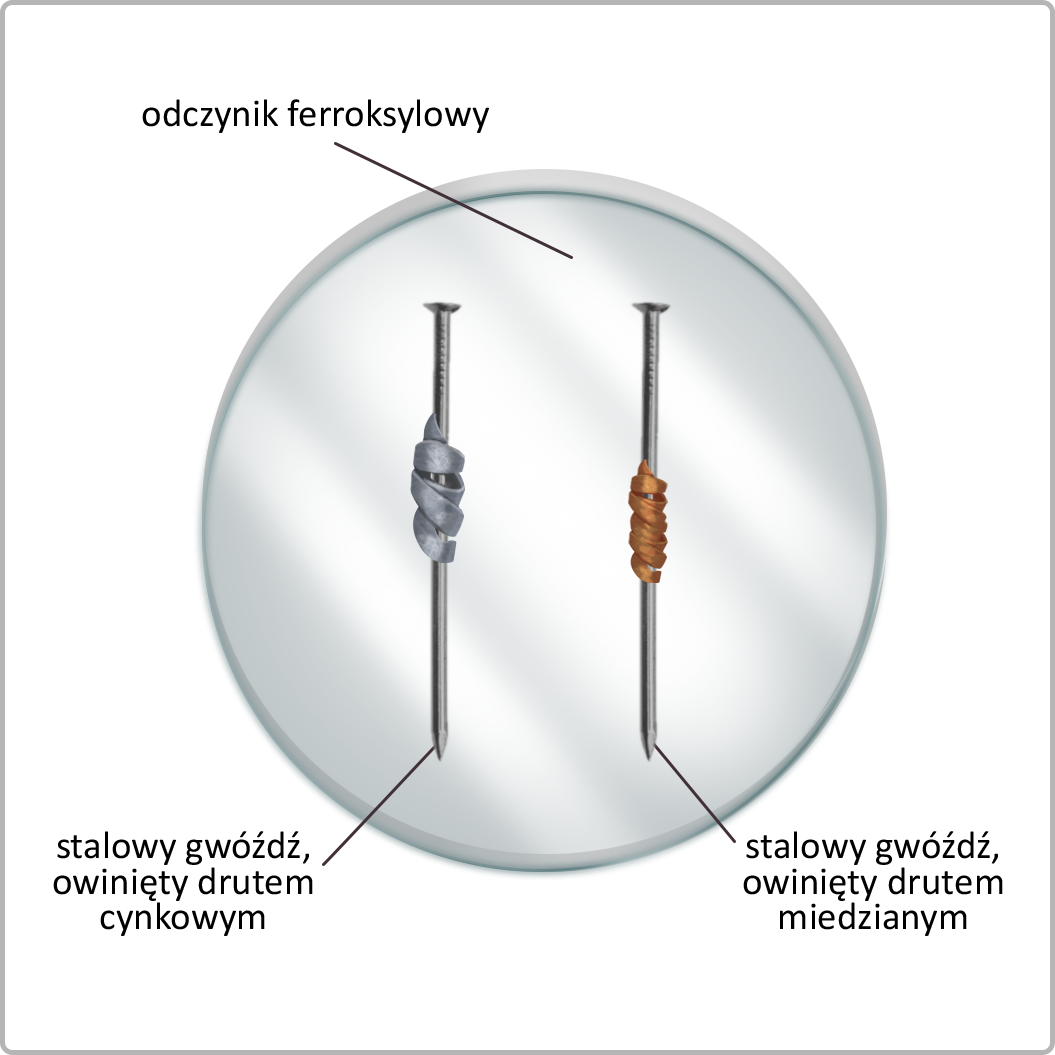
Badanie korozji stali w odczynniku ferroksylowym.
Wykonaj poniższe doświadczenie, zapisz obserwacje i sformułuj wnioski.
1. Przygotuj odczynnik ferroksylowy: do zlewki
Do zlewki z wodnym roztworem chlorku sodu w objętości 200 cm3 dodaj 4 cm3 wodnego roztworu heksacyjanożelazianu(III) potasu i 4 cm3 alkoholowego roztworu fenoloftaleiny. Roztwór ogrzej do temperatury 70°C.
2. Do przygotowanego roztworu dodaj 6 g żelatyny i dokładnie mieszaj przez około 2-3 minuty.
3. Po rozpuszczeniu żelatyny rozlej mieszaninę do dwóch szalek Petriego i umieść w nich uprzednio odtłuszczone i oczyszczone próbki gwoździ.
Szalka nr 1.
Szalka nr 2.
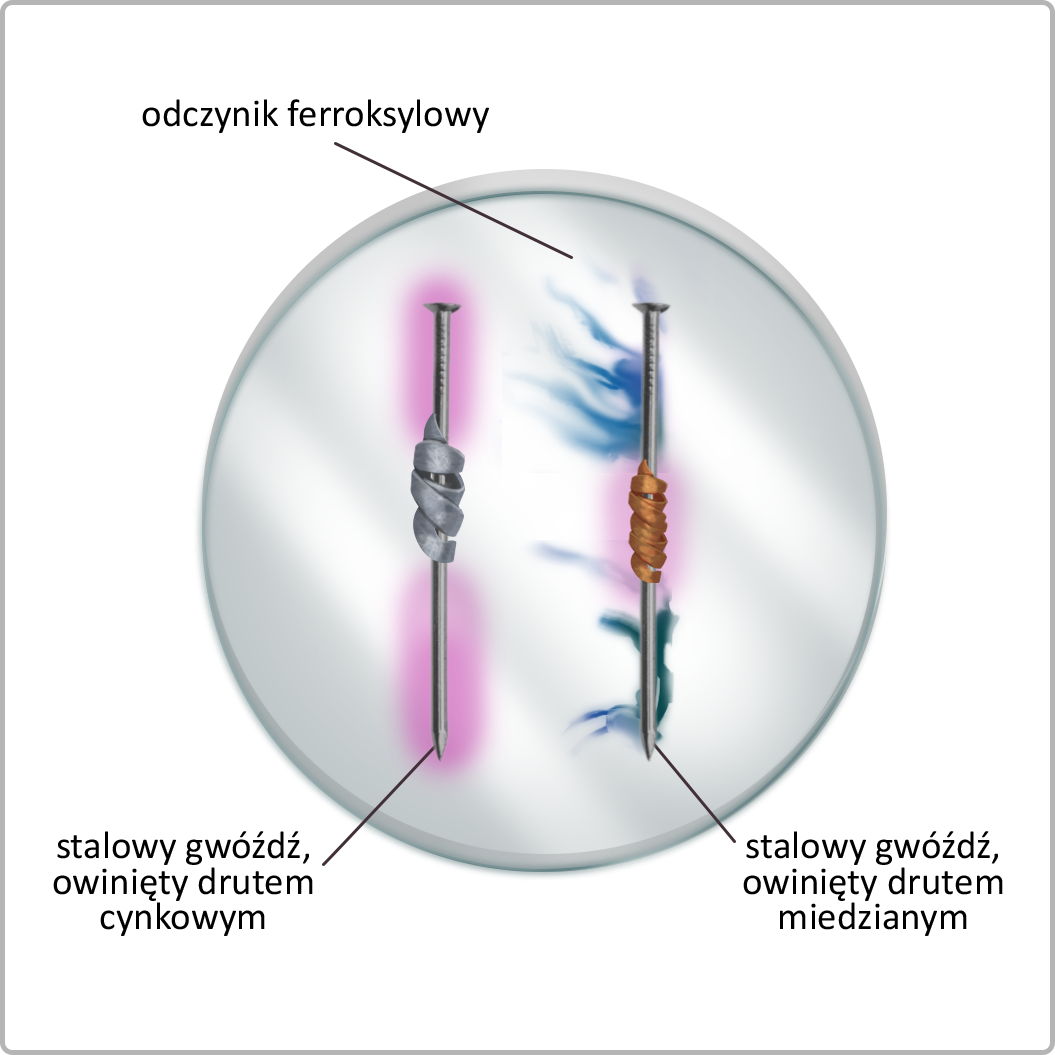
Obserwacje:
Wnioski:
Obserwacje:
Wnioski:
Odczynniki chemiczne: wodny roztwór NaCl o stężeniu 3% (200 centymetrów sześciennych); wodny roztwór heksacyjanożelazianu(III) potasu K3[Fe(CN)6] o stężeniu 1% (5 centymetrów sześciennych); roztwór fenoloftaleiny o stężeniu 1% w etanolu (5 centymetrów sześciennych); żelatyna.
Sprzęt laboratoryjny: zlewka; 2 szalki Petriego; pilnik do stali.
Badane próbki: stalowy gwóźdź owinięty drutem miedzianym; stalowy gwóźdź owinięty drutem cynkowym; stalowy gwóźdź zgięty na pół; prosty stalowy gwóźdź z nadpiłowanym ostrzem.
Wykonanie doświadczenia: 1. Przygotuj odczynnik ferroksylowy: do zlewki Do zlewki z wodnym roztworem chlorku sodu w objętości 200 centymetrów sześciennych dodaj 4 centymetry sześcienne wodnego roztworu heksacyjanożelazianu(III) potasu i 4 centymetry sześcienne alkoholowego roztworu fenoloftaleiny. Roztwór ogrzej do temperatury 70°C. 2. Do przygotowanego roztworu dodaj 6 gramów żelatyny i dokładnie mieszaj przez około 2‑3 minuty. 3. Po rozpuszczeniu żelatyny rozlej mieszaninę do dwóch szalek Petriego i umieść w nich uprzednio odtłuszczone i oczyszczone próbki gwoździ.
W oparciu o informacje zawarte w lekcji, stwórz mapę myśli, w której wskażesz czynniki wpływające na przyśpieszenie procesu korozji.
-
Czynniki wpływające na przyspieszenie procesu korozji
Słownik
substancja składająca się z 2 lub więcej pierwiastków chemicznych, z których co najmniej 1, ale występujący w przeważającej ilości, jest metalem
stopy, których głównym składnikiem jest żelazo, a dodatkami stopowymi są różne pierwiastki metaliczne i niemetaliczne
węglik żelaza ; składnik strukturalny wielu stopów żelaza
mieszanina tlenków, wodorotlenków i węglanów żelaza powstająca na powierzchni stali mającej kontakt z atmosferą - produkt reakcji żelaza z tlenem, wodą i tlenkiem węgla(IV)
zielonkawa warstewka zasadowych węglanów oraz w małym stopniu siarczanów miedzi, która wytwarza się na jej powierzchni (również na stopach miedzi) w wyniku oddziaływania czynników środowiska (, , ); patyna chroni głębsze warstwy przed dalszą korozją
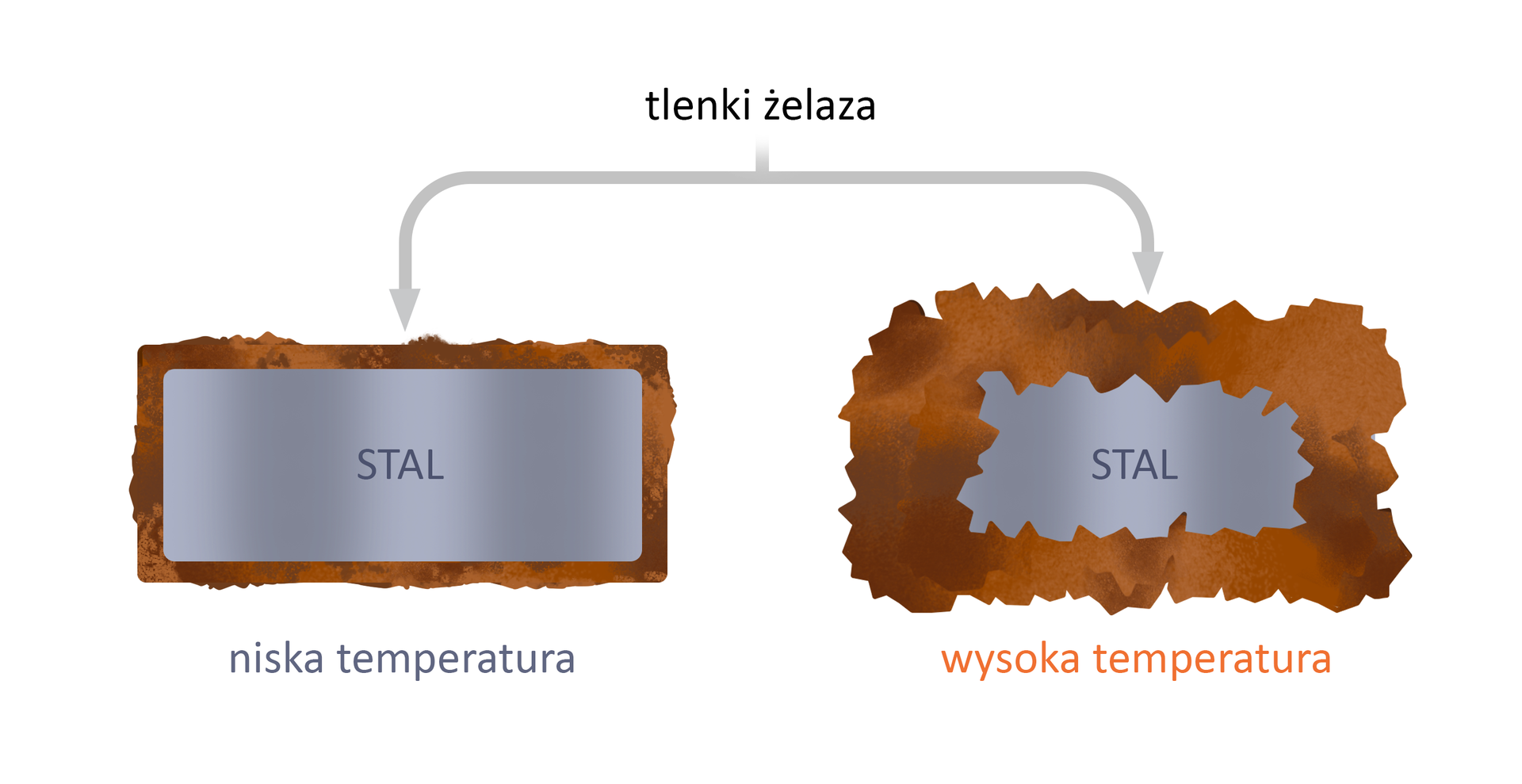
efekt korozji gazowej, warstwa tlenków metali powstająca na powierzchni nagrzanych przedmiotów metalowych w wyniku ich styczności z powietrzem; występuje w postaci powłoki lub łusek; podczas kucia lub walcowania odpada częściowo; pozostałość może być przyczyną powstania wady wyrobu
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.
Bogdańska - Zarembina A., Matusewicz E. I., Matusewicz J., Chemia 1. Dla szkół średnich, Warszawa 1996.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka – Wlazło S., Szymońska J., Chemia ogólna i nieorganiczna, Warszawa 2005.
Pazdro K. M., Chemia. Część 1. Podręcznik do kształcenia rozszerzonego w liceach, Warszawa 2013.