Przeczytaj
Kiedy sól się topi?
Poniższe ilustracje dobrze odzwierciedlają charakterystyczną cechę soli, jaką jest wysoka temperatura topnieniatemperatura topnienia. Gospodynie domowe, aby pozbyć się plam na przypalonym żelazku, używają do tego celu soli kuchennej – chlorku sodu (). W takiej sytuacji na papier lub gazetę rozsypuje się dużą ilość soli, by powstała gruba warstwa. Następnie przy pomocy żelazka rozgrzanego do maksymalnej temperatury (około ) prasuje się papier z solą, aż żelazko będzie czyste. Chlorek sodu oczyszcza płytę żelazka, a na jego powierzchni zbiera się „przypalona” warstwa. Sól kuchenna to również składnik wielu potraw. Posypuje się nią mięso lub ciasto drożdżowe. Podczas pieczenia, sól kuchenna może być wystawiona na działanie wysokiej temperatury piekarnika (). Po wyjęciu potrawy z piekarnika nadal obserwuje się kryształki soli, co oznacza, że dostarczona temperatura nie jest w stanie naruszyć sieci krystalicznej soli kuchennej ().
Dlaczego sól kuchenna nie ulega stopieniu w powyższych przypadkach?
Odpowiedź jest prosta: ponieważ dostarczona temperatura nie jest na tyle duża, by rozerwać strukturę krystaliczną kryształu jonowego chlorku sodu.
Chlorek sodu ():
Chlorek sodu () topi się w temperaturze i wrze w temperaturze . Podczas jego stapiania, jony oddzielane są od siebie, co można zobrazować schematem:
Należy jednak pamiętać, że topnienie to proces fizyczny, dlatego zapisywanie tego procesu w powyższy sposób jest dużym uogólnieniem.
Okazuje się, że niektóre sole – jak chlorek sodu – topią się w temperaturach o wiele wyższych niż temperatura pracy żelazka czy piekarnika. Aby stopić sól o wiązaniach jonowych, należy dostarczyć ogromną ilość energii, która umożliwi oddalenie się od siebie kationów i anionów budujących jej sieć krystaliczną. Gdy rośnie temperatura stałej próbki soli, jony ulegają coraz silniejszym drganiom wokół położenia równowagi, ale dopiero po ogrzaniu do wartości temperatury odpowiadającej temperaturze topnienia, opuszczają one swoje miejsca sieciowe.
Co istotne, na wartość temperatur topnienia ma wpływ wielkość i ładunek zaangażowanych jonów. Wraz ze wzrostem wielkości ładunku siła wiązania rośnie. Wiązanie jonoweWiązanie jonowe w soli jonowej staje się tym silniejsze, im średnica jonu jest mniejsza. Jako miarę trwałości kryształu jonowego przyjęto energię sieci krystalicznej, definiowaną jako energię konieczną do zerwania wiązania jonowego. Poniżej przestawiono wartości energii sieciowej dla kilku soli oraz ich temperatury topnienia.
Jeżeli porównamy teoretyczną wartość energii sieciowej fluorku litu () i chlorku litu (), a także ich temperatury topnienia, to zauważymy, że ma wyższą temperaturę topnienia i wyższą wartość teoretycznej energii sieciowej niż . Wynika to z faktu, że promień jonu fluorkowego jest mniejszy niż promień jonu chlorkowego. Zatem we fluorku litu występuje silniejsze oddziaływanie elektrostatyczne pomiędzy kationem, a anionem.
Sole organiczne a temperatura
A co z solami organicznymi? Czy równie trudno je stopić jak sole nieorganiczne? Jeżeli spojrzymy na wartości temperatur topnienia kilku przykładowych soli organicznych, zauważymy, że ich temperatury topnienia są zwykle znacznie niższe niż soli nieorganicznych. Jednym z powodów jest to, że kationy/aniony organiczne mają znacznie większe promienie niż kationy/aniony nieorganiczne. Stąd oddziaływanie elektrostatyczne pomiędzy jonami jest znacznie słabsze niż w solach nieorganicznych.
Sole kwasów karboksylowych:
Octan amonu (etanian amonu) – sól kwasu octowego (etanowego) i amoniaku
W wyniku ogrzewania octanu amonu, sól ta ulega stopieniu w temperaturze . Procesowi temu towarzyszy reakcja chemiczna dehydratacji, w wyniku której powstaje nowy związek chemiczny – acetamid (amid kwasu octowego (etanowego)).
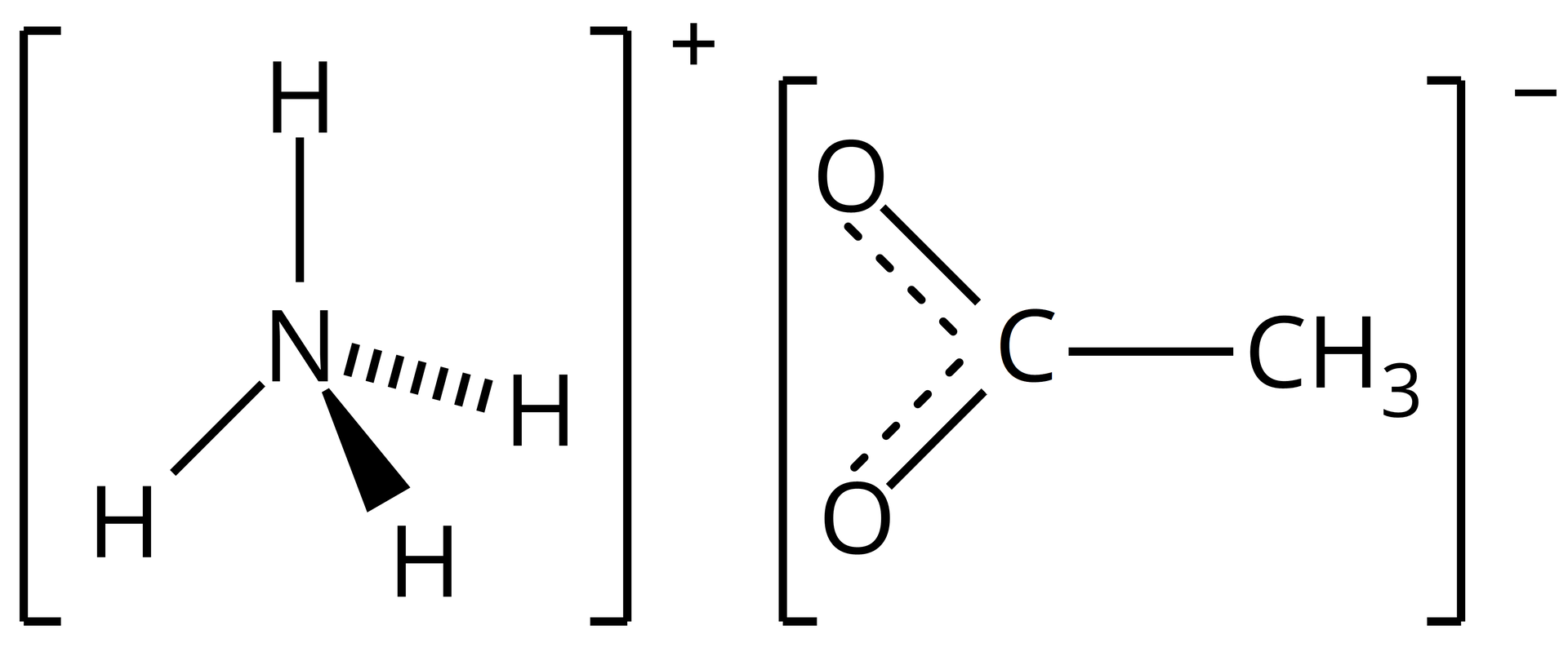
Czwartorzędowe sole amoniowe:
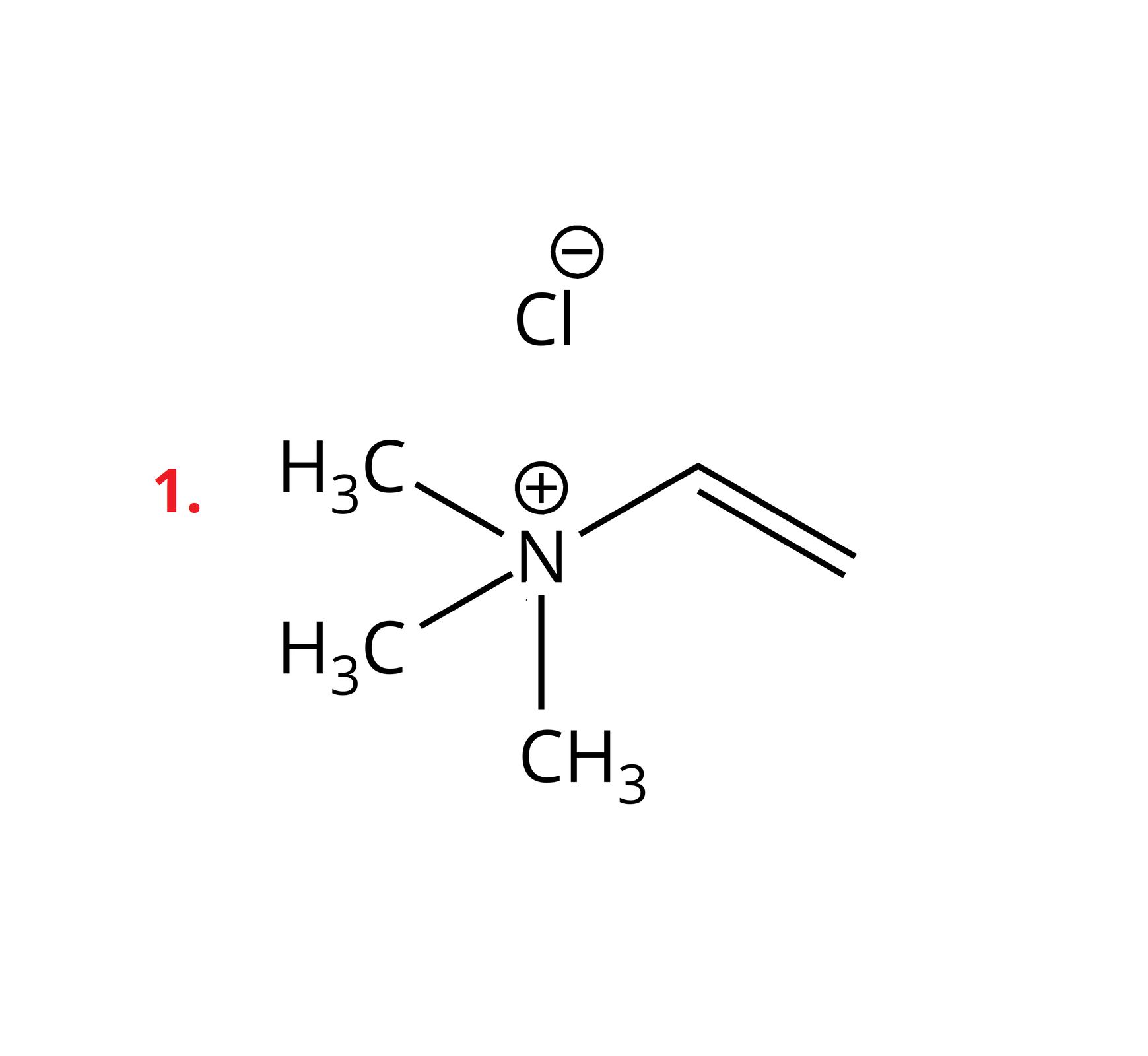
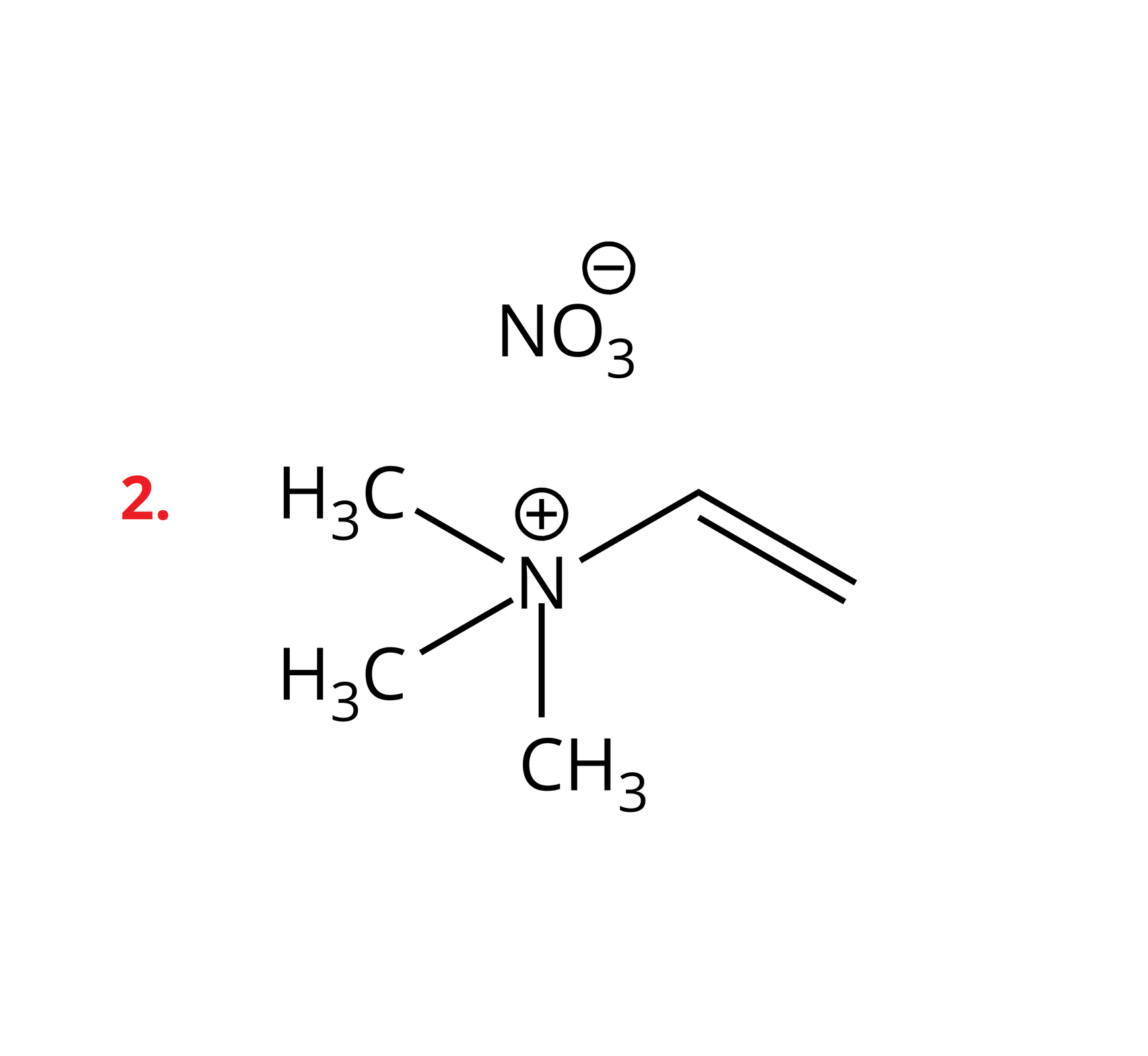
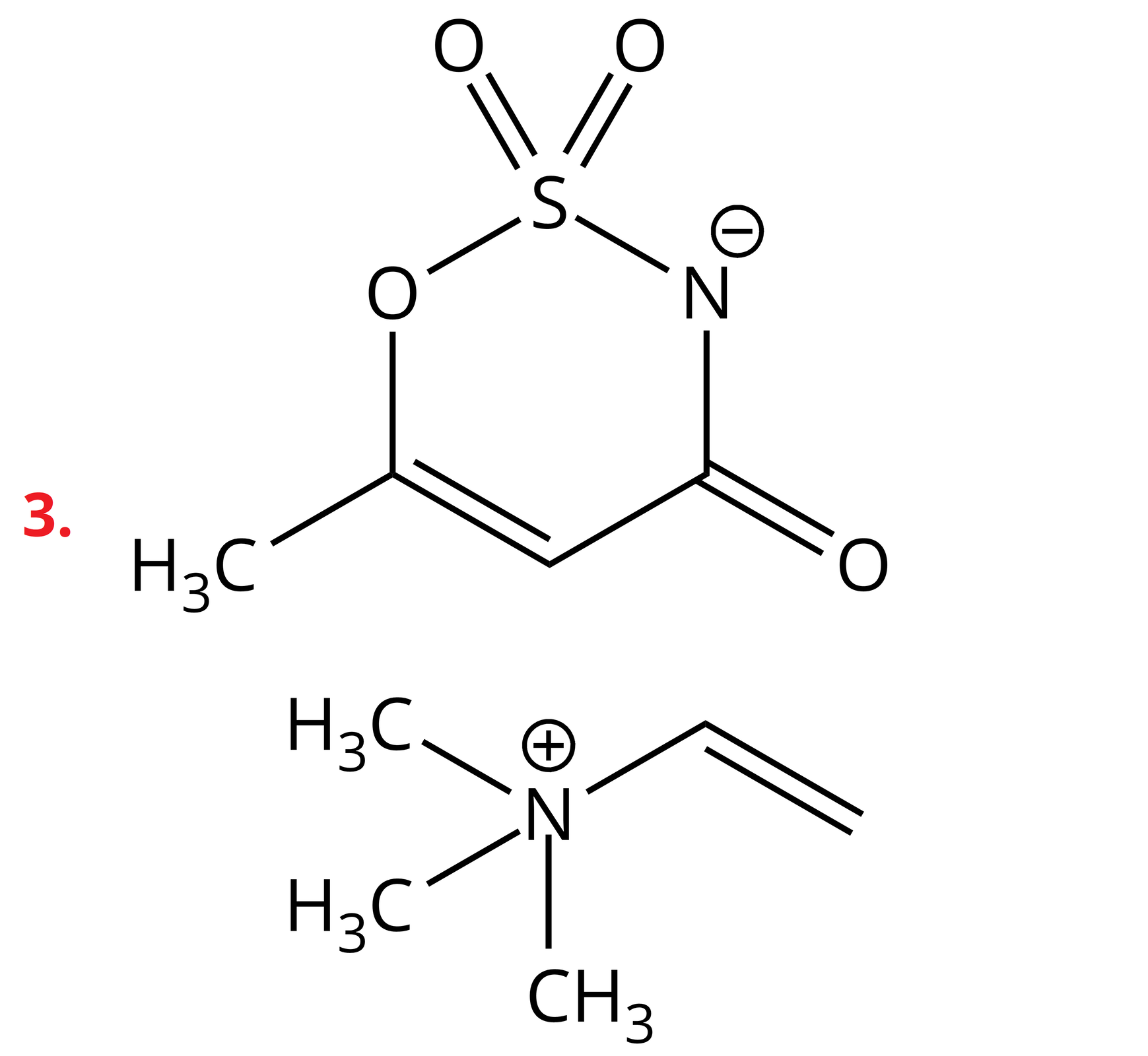
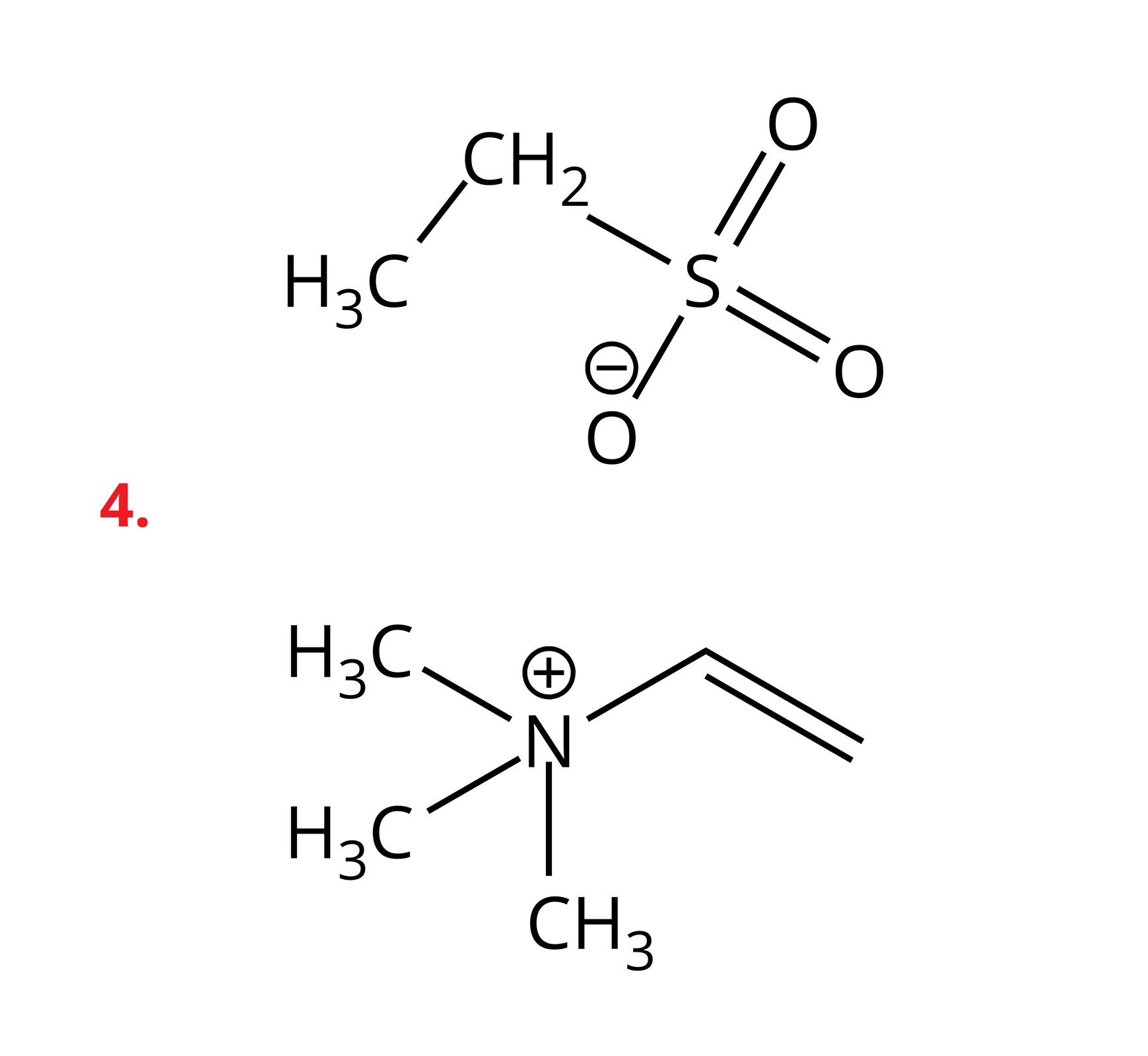
Sole te należą do związków organicznych. W swojej budowie posiadają dodatnio naładowane kationy, w których atom azotu tworzy cztery wiązania kowalencyjne z atomami wodoru lub podstawnikami węglowodorowymi. W przypadku, gdy w kationie występują same atomy wodoru, mamy do czynienia po prostu z kationem amonu. Jeśli choć jeden z atomów wodoru jest zastąpiony alifatycznym lub aromatycznym podstawnikiem, wówczas są to kationy amoniowe. Dodatni ładunek kationu jest stabilizowany przez ładunek anionu, o charakterze organicznym lub nieorganicznym.
Poniżej przedstawiono przykłady soli z kationem amoniowym, w którym atom azotu łączy się z trzema grupami metylowymi oraz jedną grupą winylową. Ponadto podano wartości temperatur topnienia tych soli.
Sól jako magazyn energii
Stopione sole nieorganiczne są wykorzystywane w procesie elektrolizy do otrzymywania metali. Na przykład w wyniku elektrolizy stopionego chlorku strontu można otrzymać metaliczny stront.
Czy znasz inne zastosowania soli?
Starożytni Chińczycy, jak i Grecy używali luster do koncentracji energii słonecznej, aby rozniecić ogień. Co łączy lustro z solą we współczesnym świecie?
W technologię polegającą na magazynowaniu energii w postaci roztopionych soli wykorzystuje się w wielkich siłowniach słonecznych (rysunek poniżej). Na wysokiej wieży umieszczone jest zwierciadło skupiające wiązkę promieni słonecznych. W pewnej odległości od wieży umieszczane są w tubach stopione sole. Wiązka promieni słonecznych z wieży odbija się od zwierciadła i trafia na tubę, dzięki czemu stopiona sól absorbuje energię słoneczną. Sól podgrzewa się nawet do blisko 400°C, po czym ciepło z soli podgrzewa wodę w wymiennikach ciepła, ta zamienia się w parę, która z kolei wprawia w ruch turbinę, wytwarzając tym samym prąd. Zaletą tego typu elektrowni jest brak emisji gazów cieplarnianych i zanieczyszczeń powietrza. Niestety, z uwagi na ogromne ilości energii pochodzącej ze Słońca, obecnie nie ma możliwości wykorzystania stopionej soli w instalacjach przydomowych.

Słownik
temperatura, w której (w warunkach normalnych) zachodzi przemiana fazowa stałej substancji krystalicznej w ciecz
elektrostatyczne oddziaływanie między przeciwnie naładowanymi jonami, powstającymi wskutek przeniesienia elektronu (elektronów) z atomu pierwiastka mniej elektroujemnego do atomu pierwiastka bardziej elektroujemnego
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Bieniek G., Chemia. Doświadczenia chemiczne w zadaniach. Trening przed maturą, Kraków 2007.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002.
Encyklopedia PWN
Jagodziński P., Wolski R., Aspekty Metodyczne eksperymentów chemicznych, cz. 2, Warszawa 2013.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Vogel A. I., Preparatyka Organiczna, Warszawa 2018.
Czy stopione sole zdobędą energetykę?, „Młody Technik”, online: https://mlodytechnik.pl/news/19681-czy-stopione-sole-zdobeda-energetyke (dostęp: 29.07.2020).
How to Use Solar Energy at night, „Scientific American”, online: https://www.scientificamerican.com/article/how-to-use-solar-energy-at-night/ (dostęp: 29.07.2020).
Molten Salt Reactors, online: https://www.world-nuclear.org/information-library/current-and-future-generation/molten-salt-reactors.aspx (dostęp: 29.07.2020).
World's First Utility -Scale Molten Salt Fresnel CSP Plant Connects to China's Grid, online: https://www.solarpaces.org/worlds-first-utility-scale-molten-salt-fresnel-csp-plant-connects-to-chinas-grid/ (dostęp: 29.07.2020).