Przeczytaj
Liczba przestrzenna a kształt cząsteczki
Liczbą przestrzenną () nazywamy sumę wolnych par elektronowych atomu centralnego oraz par elektronowych sigma (). Wyznaczając tę liczbę można określić typ hybrydyzacji i na tej podstawie ustalić rozmieszczenie atomów w cząsteczce. Jest to niezbędne do prawidłowego skonstruowania modelu przestrzennego.
Wzór strukturalny tlenku węgla() jako przykład związku mającego hybrydyzację . Atom centralny połączony jest z sąsiednimi atomami w sposób liniowy.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Na drugiej grafice przedstawiono ten sam związek w postaci kulkowej. W linii znajdują się trzy kule. Centralnie położona ma kolor różowy, dwa znajdujące się po bokach mają kolor biały.Model kulkowy tlenku węgla(). Szara kulka w centrum to atom węgla, czerwone kulki to atomy tlenu.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
, Liczba przestrzenna Podobnie jak w przypadku hybrydyzacji , tutaj również obecne są punktowe ładunki ujemne, które układają się jak najdalej od siebie na skutek działania sił odpychania elektrostatycznego. Jedyną różnicą jest liczba punktowych ładunków ujemnych. W tym przypadku są ich trzy. Z tego powodu, kąt pomiędzy odcinkami łączącymi ładunki ze środkiem (atom centralny) również jest inny. Jego wartość wynosi . Rozmieszczenie przestrzenne atomów nosi nazwę orientacji trygonalnej, określanej jako hybrydyzacja . W tym przypadku atomy tworzą płaski trójkąt równoboczny, gdzie w centrum znajduje się atom centralny. Cząsteczkami o budowie tetraedralnej są między innymi: , , . Na ilustracji przedstawiono wzór cząsteczki trifluorku boru. Atom boru znajduje się w centralnej części. Od niego dochodzą wiązania do trzech atomów fluoru, tworzących tetraedr. Wiązania mają postać: jednolitej, pojedynczej kreski, jednolitej kreski w kształcie stożka, kreski w kształcie stożka, składającej się z kilku poziomych kresek.Przykład cząsteczki trifluorku boru (), mającej hybrydyzację .
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
, Liczba przestrzenna W tym przypadku w modelu znajdują się cztery punktowe ładunki ujemne, które układają się w jak największej odległości od siebie na skutek siły odpychania elektrostatycznego. W tej sytuacji atomy tworzą orientację tetraedryczną, inaczej zwaną tetragonalną, która odpowiada hybrydyzacji . Kąt utworzony pomiędzy odcinkami łączącymi środek z ładunkami wynosi . Przykładami takich cząsteczek są np.: , . Na ilustracji przedstawiono przestrzenne ułożenie atomów w cząsteczce metanu. W centralnej części znajduje się atom węgla, do którego przyłączone są atomy wodoru. Tworzą one tetraedryczną cząsteczkę. Nad atomem węgla znajduje się atom wodoru. Długość odległości między atomem węgla a wodoru wynosi pikometrów. Natomiast kąt tworzony przez dwa atomy wodoru wynosi stopni.Przestrzenne ułożenie atomów w cząsteczce metanu () jako przykład orientacji tetraedrycznej. Zaznaczony został kąt tworzony przez odcinki łączące środek kuli z ładunkami.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Na ilustracji przedstawiono model kulkowy cząsteczki metanu. W centralnej części znajduje się kula oznaczona ciemnym kolorem. Do niej przyłączone zostały pozostałe kule, oznaczone jasnym kolorem. Kule tworzą strukturę tetragonalną.Model kulkowy cząsteczki metanu jako przykład struktury tetragonalnej. Czarna kulka w centrum jest atomem węgla, natomiast sąsiednie białe są atomami wodoru.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
, Liczba przestrzenna W modelu mamy obecnych pięć punktowych ładunków ujemnych, które, tak jak w poprzednich przypadkach, ustawiają się jak najdalej od siebie na skutek odpychania elektrostatycznego. Ładunki tworzą bipiramidę trygonalną, a kąt pomiędzy odcinkami łączącymi ładunki ze środkiem ma w płaszczyźnie podstawy struktury oraz w płaszczyźnie prostopadłej do płaszczyzny. Takie ułożenie przestrzenne jest przykładem orientacji pentagonalnej i odpowiada hybrydyzacji . Przykładem cząsteczki o takiej właśnie orientacji jest pentachlorek fosforu (). Na ilustracji przedstawiono przestrzenne ułożenie atomów w cząsteczce pentachlorek fosforu. W centralnej części znajduje się atom fosforu, do którego przyłączonych jest pięć atomów chloru. Tworzą one orientację pentagonalną. Długość odległości między atomem fosforu a atomem chloru znajdującym się po prawej stronie, lekko z ukosa wynosi pikometry. Poniżej znajduje się kolejny atom chloru. Kąt między nimi wynosi stopni. Kolejny atom chloru znajduje się w linii prostej pod atomem fosforu. Odległość między atomem fosforu a chloru wynosi pikometrów. Po lewej stronie atomu fosforu, w linii prostej znajduje się kolejny atom chloru. Również tuż nad atomem fosforu, znajduje się atom chloru. Kąt między atomem chloru a fosforu wynosi stopni.Wzór strukturalny pentachlorku fosforu () jako przykład cząsteczki o orientacji pentagonalnej.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Na ilustracji przedstawiono model kulkowy cząsteczki pentachlorku fosforu. W centralnej części znajduje się kula oznaczona pomarańczowym kolorem. Do niej przyłączone zostało pozostałych kul, oznaczonych zielonym kolorem. Kule tworzą strukturę pentagonalną.Model kulkowy pentachlorku fosforu (). Ciemnoróżowa kulka w cetrum to atom fosforu, zielone kulki to atomy chloru.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
, Liczba przestrzenna Strukturę przestrzenną tworzy ładunków punktowych, które, tak jak poprzednio, oddalone są od siebie na skutek odpychania elektrostatycznego. Geometria cząsteczki przyjmuje kształt oktaedru, czyli bipiramidy tetragonalnej. Kąty w takiej strukturze osiągają między wiązaniami. Takie ułożenie jest przykładem orientacji heksagonalnej, odpowiadającej hybrydyzacji . Cząsteczką charakteryzującą się taką budową przestrzenną jest np. heksafluorek siarki (). Na ilustracji przedstawiono przestrzenne ułożenie atomów w cząsteczce heksafluorku siarki. W centralnej części znajduje się atom siarki, do którego przyłączonych jest atomów fluoru. Dwa atomy po lewej stronie, jeden nad atomem siarki, dwa po prawej stronie i jeden pod atomem siarki. Tworzą one orientację heksagonalną. Odległość między atomami fluoru przyłączonymi po lewej stronie atomu siarki wynosi pikometry, Kąt między atomem fluoru znajdującym się w linii prostej nad atomem siarki a atomem fluoru znajdującym się po prawej stronie atomu siarki, wynosi stopni.Wzór strukturalny heksafluorku siarki jako przykład cząsteczki o hybrydyzacji .
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
, Liczba przestrzenna Strukturę przestrzenną tworzą atom centralny oraz siedem punktowych ładunków oddalonych od siebie z powodu odpychania elektrostatycznego. Całość tworzy strukturę bipiramidy pentagonalnej, a kąty pomiędzy odcinkami łączącymi ładunki ze środkiem wynoszą oraz w płaszczyźnie prostopadłej do podstawy. Taką strukturę określamy jako orientację heptagonalną i hybrydyzację . Przykładem związku o takiej strukturze przestrzennej jest heptafluorek jodu (). Na ilustracji przedstawiono przestrzenne ułożenie atomów w cząsteczce heptafluorku jodu. W centralnej części znajduje się atom jodu, do którego przyłączonych jest atomów fluoru. Dwa atomy po lewej stronie, dwa nad atomem jodu, dwa po prawej stronie i jeden pod atomem jodu. Tworzą one orientację heptagonalną. Odległość między atomami fluoru przyłączonymi po lewej stronie atomu jodu wynosi pikometrów. Kąt między atomami fluoru znajdującym się po prawej stronie atomu jodu wynosi stopnie. Odległość między atomem jodu i atomem fluoru znajdującym się w linii prostej nad atomem jodu, wynosi pikometrów. Kąt między tym atomem fluoru a atomem fluoru znajdującym się po prawej stronie aromu jodu wynosi stopni.Wzór strukturalny heptafluorku jodu jako przykład cząsteczki o hybrydyzacji .
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Na ilustracji przedstawiono model kulkowy cząsteczki heptafluorku jodu. W centralnej części znajduje się kula oznaczona fioletowym kolorem. Do niej przyłączonych zostało pozostałych kul, oznaczonych zielonym kolorem. Kule tworzą strukturę heptagonalną.Model kulkowy cząsteczki heptafluorku jodu. Ciemnoróżowa kulka w cetrum to atom jodu, zielone kulki to atomy fluoru.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Woda i amoniak
Istnieje możliwość, że atom centralny będzie posiadał wolne pary elektronowe. Prowadzi to do zaburzenia geometrii cząsteczki, ponieważ siła odpychania wolnych par elektronowych i wiązań sigma nie jest taka sama. Przykładami takich cząsteczek są woda () i amoniak ().
Budowanie modeli w oparciu o metodę VSEPR
Dane jest równanie reakcji:
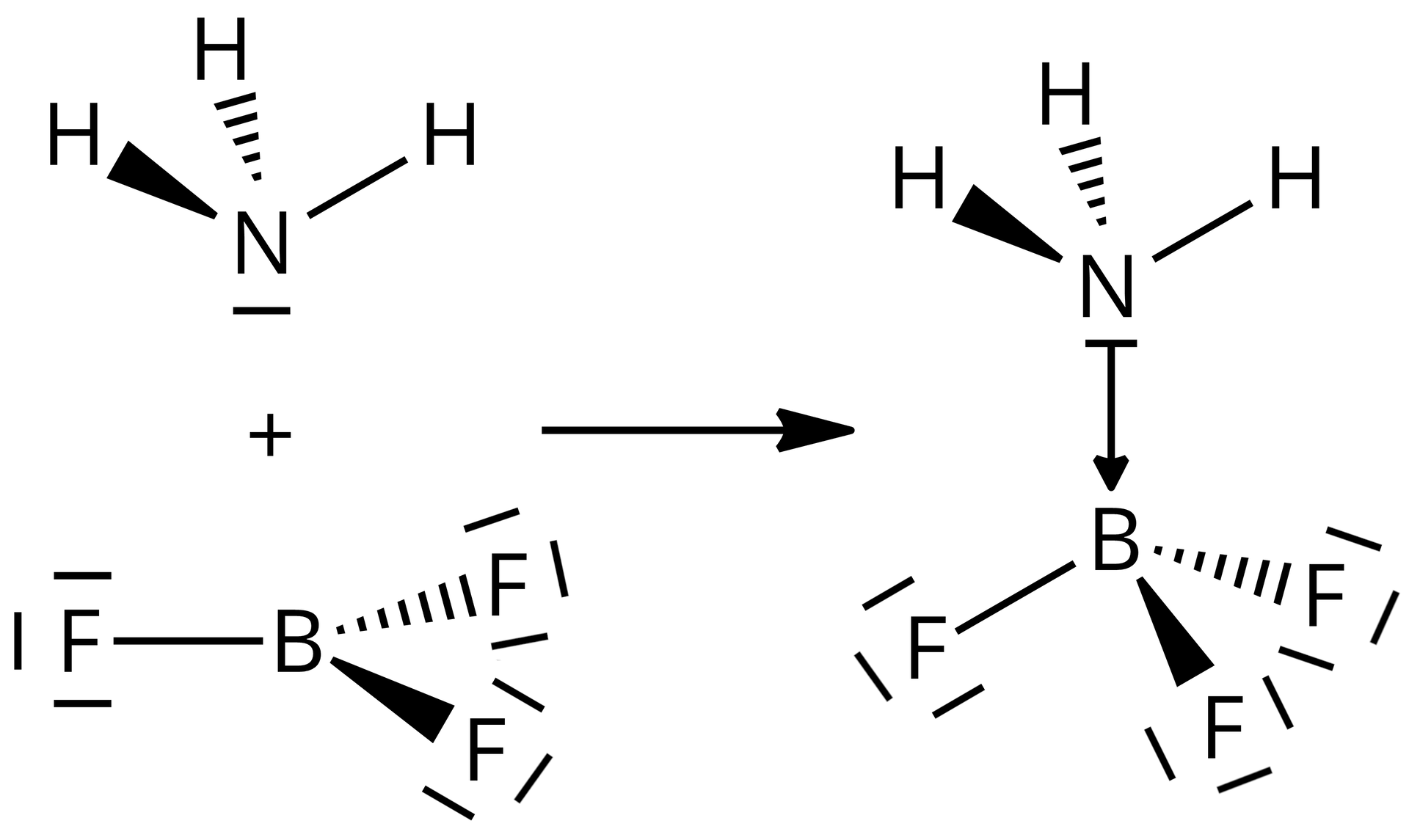
Uczniowie mieli za zadanie określić, która cząsteczka jest kwasem LewisaLewisa, a która zasadą Lewisa. Jeden z uczniów postawił tezę: kwasem Lewisa jest ta cząsteczka, która nie posiada wolnych par elektronowych.
Korzystając z metody VSEPR (Valence Shell Electron Pair Repulsion – teoria odpychania par elektronów walencyjnych) zbuduj modele cząsteczek, a następnie zweryfikuj przedstawioną hipotezę badawczą. Zapisz w formularzu niezbędne obliczenia oraz wnioski.
Materiały pomocnicze:
zestaw do budowania modeli cząsteczek (alternatywnie: plastelina różnokolorowa, druciki);
kartki;
kolorowe pisaki.
Odpowiedź zapisz w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Słownik
kwasami są jony lub cząsteczki, które mają niedobór elektronów oraz mogą reagować z jonami lub cząsteczkami zawierającymi wolne pary elektronowe
(franc. doublet „drugi”, „podwójny”) dwa elektrony, które zajmują ten sam orbital atomowy lub molekularny, lecz mają przeciwne spiny
zespół ośmiu elektronów, będących powłoką elektronową atomów gazów szlachetnych
atom bądź jon, stanowiący rdzeń kompleksu (koordynacyjne związki) i przyłączający (koordynujący) pewną liczbę jonów lub atomów, zwanymi jonami lub atomami otaczającymi
Bibliografia
Cox P. A., Chemia nieorganiczna. Krótkie wykłady, Warszawa 2012.
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum - poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.
Lee J. D., Zwięzła Chemia nieorganiczna, tłum. Jerzy Kuryłowicz, Warszawa 1997, wyd. 5.