Przeczytaj
Reakcje metali wobec tlenu
Metale reagują z tlenem, tworząc tlenki metali, ale czasem również nadtlenki lub ponadtlenki metali. Jednym ze sposobów ich otrzymywania jest reakcja bezpośredniej syntezy.
Poniżej przedstawione zostały przykładowe reakcje metali z tlenem.
Reakcję magnezu z tlenem przeprowadza się w podwyższonej temperaturze (reakcja spalania). W efekcie otrzymywany jest tlenek magnezu.
Reakcja sodu z tlenem jest najczęściej stosowaną metodą otrzymywania nadtlenku sodu.
Ciekawym przykładem jest reakcja żelaza z tlenem. Żelazo w postaci płytki utleniautlenia się bardzo powoli, natomiast jeśli jest w postaci żelaza koloidalnego, to w zetknięciu z tlenem zachodzi gwałtowne utlenienie, któremu towarzyszą pojawiające się iskry.
Analogiczne równania reakcji można zapisać również dla wapnia, glinu, cynku czy miedzi.
Zapisz równanie reakcji glinu z tlenem. Pamiętaj o właściwym dobraniu współczynników stechiometrycznych.
Czy metale reagują z wodą?
Reakcje metali z wodą prowadzą do powstawania wodorotlenków – związków o wzorze ogólnym , gdzie to liczba grup wodorotlenowych równa stopniowi utlenienia.
Poniżej przedstawione zostały przykładowe równania reakcji, które zachodzą pomiędzy metalami a wodą.
Ze względu na wysoką aktywność potasu, podczas reakcji z wodą wypierany jest z niej gazowy wodór. W efekcie tej przemiany powstaje wodorotlenek potasu.
W reakcji wapnia z wodą powstaje wodorotlenek wapnia i gazowy wodór.
Analogicznie reakcje te można zapisać m.in. dla magnezu i sodu. Należy jednak pamiętać o prawidłowym dobraniu współczynników stechiometrycznych.
Metale a kwasy o słabych właściwościach utleniających
Kwasy o słabych właściwościach utleniających powodują utlenienie metalu (zwiększenie jego stopnia utlenienia), dzięki redukcji wodoru zawartego w kwasie. Kwasy o silnych właściwościach utleniających powodują zwiększenie stopnia utlenienia metalu nie tylko dzięki redukcji jonu wodoru, ale również dzięki redukcji atomu centralnego reszty kwasowej.
Kwasami nieutleniającymi są m.in. kwas chlorowodorowy, kwas bromowodorowy, kwas fosforowy(), rozcieńczony kwas siarkowy(). Reagują one wyłącznie z metalami o ujemnym potencjale standardowym z wydzieleniem wodoru.
Należy pamiętać, że im bardziej ujemny potencjał standardowy metalu, tym jest on mocniejszym reduktorem.

Przykład reakcji metali wobec kwasów o słabych właściwościach utleniających przedstawiono poniżej na podstawie żelaza.
W analogiczny sposób można zapisać równania reakcji m.in. dla sodu, potasu, wapnia, magnezu, glinu, cynku, manganu i chromu. Przykładem metalu, który nie reaguje z kwasem chlorowodorowym, jest miedź.
Przykłady reakcji metali wobec kwasów o słabych właściwościach utleniających przedstawiono poniżej na przykładzie glinu, który jest dobrym reduktoremreduktorem ze względu na swój niski potencjał standardowy.
Zapisz równania reakcji chemicznych, które zachodzą pomiędzy cynkiem oraz manganem a kwasem bromowodorowym.
Kwas azotowy() i siarkowy()
Rozcieńczony i stężony kwas azotowy() oraz stężony kwas siarkowy() należą do kwasów o silnych właściwościach utleniających. Reagują one z metalami aktywniejszymi od wodoru, jak i z metalami szlachetnymi (mniej aktywnymi od wodoru). Głównym produktem reakcji chemicznej pomiędzy metalem a kwasem o silnych właściwościach utleniających jest sól. Oprócz soli otrzymuje się mieszaninę produktów, której skład jest zależny od stężenia kwasu. Są to m.in, tlenki na niższych stopniach utlenienia.
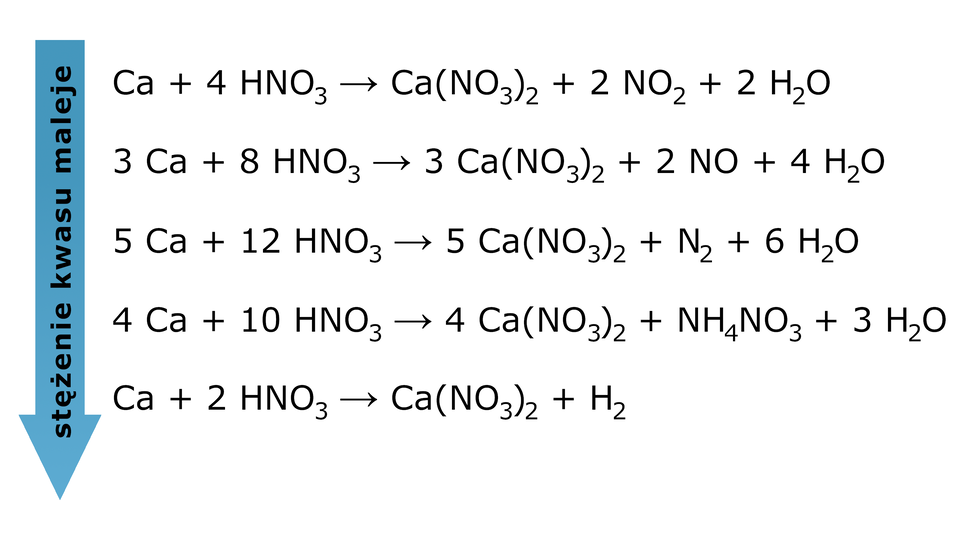
Poniżej przedstawione zostały przykłady równań reakcji tych kwasów z wybranymi metalami.
Żelazo
Reakcja żelaza ze stężonym kwasem siarkowym() zachodzi dopiero w podwyższonej temperaturze, ponieważ w temperaturze pokojowej żelazo pasywuje i nie ulega reakcji z kwasem siarkowym() stężonym.
Reakcja żelaza z rozcieńczonym kwasem siarkowym() w temperaturze pokojowej zachodzi z wydzieleniem wodoru:
Reakcja żelaza ze stężonym lub rozcieńczonym kwasem azotowym() prowadzona w podwyższonej temperaturze:
Reakcja żelaza ze stężonym lub rozcieńczonym kwasem azotowym() w temperaturze pokojowej praktycznie nie zachodzi. Żelazo zwykle pokryte jest warstwą tlenku, czyli jest spasywowane, co uniemożliwia zajście reakcji.
Jak wspominano, podczas tego typu reakcji dochodzi do powstawania tlenków na niższym stopniu utlenienia – siarka zmienia swój stopień utlenienia z na , natomiast azot z na .
Glin
Podobnie jak w przypadku żelaza, reakcja glinu ze stężonym kwasem siarkowym() zachodzi dopiero w podwyższonej temperaturze:
W temperaturze pokojowej glin pokrywa się tlenkiem glinu(), czyli pasywuje, i praktycznie nie ulega reakcji z kwasem siarkowym() stężonym.
Reakcje glinu z kwasem azotowym() przebiegają analogicznie do reakcji tego kwasu z żelazem.
Miedź
Kolejnym przykładem jest reakcja miedzi ze stężonym kwasem azotowym() w temperaturze pokojowej. Przebiega zgodnie z poniższym równaniem.
Podczas reakcji miedzi i stężonego kwasu siarkowego() powstaje tlenek siarki na stopniu utlenienia. Na podstawie powyższych przykładów, spróbuj zapisać równanie reakcji.
Srebro
Srebro reaguje również ze stężonym kwasem siarkowym(). W wyniku tej reakcji powstaje m.in. siarczan() srebra i jeden z tlenków siarki. Zapisz równanie dla opisanej reakcji.
Ze stężonym kwasem azotowym() reaguje również srebro, w efekcie tworzy się m.in. sól i tlenek azotu na stopniu utlenienia. Na podstawie tych informacji zapisz równanie reakcji.
Słownik
substancja oddająca elektrony substancji redukowanej, sama ulegająca utlenieniu; silnymi reduktorami są m.in. sód, magnez oraz wodór
pojęcie umowne określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chem. wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
proces polegający na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka oddającego elektrony
wodny roztwór nanożelaza
Bibliografia
Atkins P., Jones L., Podstawy chemii fizycznej, Warszawa 2009.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
Pajdowski L., Chemia ogólna, Warszawa 2002.