Przeczytaj
Przypomnienie wiadomości o węglowodorach
Aby dobrze zrozumieć tematy dotyczące węglowodorów, należy znać podstawowy zestaw ogólnych informacji na ich temat.
Jeżeli nie jesteś pewny/pewna swojej wiedzy – kliknij w poniższą listę i zapoznaj się z jej treścią. Po przypomnieniu sobie potrzebnych informacji, przejdź do pracy z materiałem.
- Topologia łańcucha
- Atomy węgla w węglowodorach mogą łączyć się bezpośrednio ze sobą, tworząc łańcuchy. Dzielą się na proste (bez rozgałęzień), rozgałęzione lub zamknięte w pierścienie. Dlatego też istnieje wiele różnych grup (rodzin) węglowodorów. Węglowodory łańcuchowe nazywamy alifatycznymi, a węglowodory pierścieniowe – cyklicznymi.
- Węglowodory alifatyczne (węglowodory łańcuchowe), węglowodory o atomach węgla połączonych w otwarte łańcuchy (proste lub rozgałęzione).
- Węglowodory cykliczne (węglowodory pierścieniowe), węglowodory o atomach węgla połączonych w pierścienie (jeden lub więcej).
- Typ i liczba wiązań między atomami węgla – krotność wiązań.
- Wśród węglowodorów łańcuchowych wyróżniamy węglowodory nasycone (alkany) i nienasycone (alkeny, alkiny).
- Wśród węglowodorów pierścieniowych możemy wyróżnić węglowodory cykloalifatyczne (cykloalkany, cykloalkeny) oraz aromatyczne (pierścieniowe z układem aromatycznym).
- Węglowodory nasycone to takie, które posiadają w swoich cząsteczkach jedynie wiązania pojedyncze.
- Węglowodory nienasycone to takie, które posiadają w swoich cząsteczkach wiązania wielokrotne. Może być ono jedno lub kilka.
- Węglowodory cykloalifatyczne to węglowodory pierścieniowe, nasycone lub nienasycone (cykloalkany, cykloalkeny).
- Węglowodory aromatyczne (areny), węglowodory pierścieniowe – jedno lub wielopierścieniowe – z układem aromatycznym. W tych węglowodorach obecne są sprzężone wiązania wielokrotne (naprzemiennie pojedyncze i podwójne), np. benzen, homologi benzenu.
- Krotność wiązań: pojedyncze, podwójne, potrójne i wielokrotność wiązań. W węglowodorach mogą występować wiązania pojedyncze (alkany), wiązania podwójne (alkeny) oraz wiązania potrójne (alkiny). Wiązania wielokrotne bywają w liczbie większej niż jedno pomiędzy atomami węgla, np. dwa wiązania podwójne w dienach.
- Typ wiązań sigma () i pi () to wiązania występujące w węglowodorach. Wiązanie pojedyncze jest wiązaniem typu sigma, natomiast wiązanie podwójne i potrójne są wiązaniami typu sigma i pi (jedno sigma jedno pi (podwójne) oraz jedno sigma dwa pi (potrójne)).
- – atom węgla tworzy z atomami sąsiednimi dwa wiązania sigma i dwa wiązania pi (z jednym lub dwoma sąsiadami), np. etyn; Schemat hybrydyzacji typu s p. Po lewej stronie ilustracji znajdują się dwa trójwymiarowe układy współrzędnych. Zaznaczono osie: x, y, z. Oś zet jest pionowa i skierowana do góry, dwie pozostałe znajdują się w poziomie, przy czym oś iks skierowana jest po skosie w prawo za płaszczyznę monitora, a oś igrek po skosie w prawo przed płaszczyznę monitora. Pomiędzy osiami iks igrek występuje kąt prosty, podobnie pomiędzy osiami iks zet oraz igrek zet. W środku pierwszego układu znajduje się niebieska kula, do której nie należy punkt zero zero zero, stanowi ona orbital typu s . W drugim układzie wzdłuż osi x zlokalizowany jest orbital typu p przypominający kształtem strukturę wyznaczoną przez trójwymiarową obracającą się wzdłuż własnej osi ósemkę (dla typowego zapisu cyfry osiem oś ta skierowana jest pionowo i dzieli na dwie równe części strukturę). Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią igrek i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części pierwsza znajduje się nad osią igrek a druga pod i nazywa się je lobami. Po prawej stronie ilustracji za strzałką z napisem hybrydyzacja przedstawiono orbitale o hybrydyzacji typu s p powstałe na skutek wymieszania się orbitali typu s i p . Powstała hybryda składa się z dwóch orbitali. Każdy z nich stanowi jeden duży i jeden mały lob. W przypadku pierwszego orbitalu duży lob odchodzi nad oś igrek, a mały pod, a w przypadku drugiego jest odwrotnie. Pomiędzy dużymi lobami, jak i pomiędzy małymi, z uwagi na fakt, iż zlokalizowane są one wzdłuż osi iks znajduje się kąt sto osiemdziesiąt stopni.
- – atom węgla tworzy z atomami sąsiednimi trzy wiązania sigma i jedno wiązanie pi, np. eten, benzen; #Schemat hybrydyzacji typu . Po lewej stronie ilustracji znajdują się trzy trójwymiarowe układy współrzędnych. Zaznaczono osie: x, y, z. Oś zet jest pionowa i skierowana do góry, dwie pozostałe znajdują się w poziomie, przy czym oś iks skierowana jest po skosie w prawo za płaszczyznę monitora, a oś igrek po skosie w prawo przed płaszczyznę monitora. Pomiędzy osiami iks igrek występuje kąt prosty, podobnie pomiędzy osiami iks zet oraz igrek zet. W środku pierwszego układu znajduje się niebieska kula, do której nie należy punkt zero zero zero, stanowi ona orbital typu s . W drugim układzie wzdłuż osi x zlokalizowany jest orbital p indeks dolny iks koniec indeksu przypominający kształtem strukturę wyznaczoną przez trójwymiarową obracającą się wzdłuż własnej osi ósemkę (dla typowego zapisu cyfry osiem oś ta skierowana jest pionowo i dzieli na dwie równe części strukturę). Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią igrek i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części, pierwsza znajduje się nad osią igrek a druga pod i nazywa się je lobami. W trzecim układzie wzdłuż osi igrek zlokalizowany jest orbital p indeks dolny igrek koniec indeksu również przypominający kształtem trójwymiarową obracającą się wzdłuż osi igrek ósemkę. Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią iks i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części, pierwsza znajduje się nad osią iks a druga pod i nazywa się je lobami. Po prawej stronie ilustracji za strzałką z napisem hybrydyzacja przedstawiono orbitale o hybrydyzacji typu powstałe na skutek wymieszania się orbitali: jednego typu s i dwóch typu p. Powstałe orbitale stanowią każdy jeden duży i jeden mały lob odchodzące od początku układu współrzędnych. Loby te zorientowane są w płaszczyźnie iks igrek. Pierwszy duży lob znajduje się nad osią igrek wzdłuż osi iks, z kolei mały lob tworzący razem z nim orbital znajduje się po przeciwnej stronie osi igrek również wzdłuż osi iks. Pozostałe dwa duże loby zlokalizowane są odpowiednio w trzeciej i czwartej ćwiartce płaszczyzny wyznaczonej przez osie, z kolei małe loby w pierwszej i w drugiej. Pomiędzy orbitalami występują kąty wynoszące sto dwadzieścia stopni.
- – atom węgla tworzy z atomami sąsiednimi cztery wiązania sigma, np. metan, etan. Schemat hybrydyzacji typu . Po lewej stronie ilustracji znajdują się cztery trójwymiarowe układy współrzędnych. Zaznaczono osie: x, y, z. Oś zet jest pionowa i skierowana do góry, dwie pozostałe znajdują się w poziomie, przy czym oś iks skierowana jest po skosie w prawo za płaszczyznę monitora, a oś igrek po skosie w prawo przed płaszczyznę monitora. Pomiędzy osiami iks igrek występuje kąt prosty, podobnie pomiędzy osiami iks zet oraz igrek zet. W środku pierwszego układu znajduje się niebieska kula, do której nie należy punkt zero zero zero, stanowi ona orbital typu s . W drugim układzie wzdłuż osi x zlokalizowany jest orbital p indeks dolny iks koniec indeksu przypominający kształtem strukturę wyznaczoną przez trójwymiarową obracającą się wzdłuż własnej osi ósemkę (dla typowego zapisu cyfry osiem oś ta skierowana jest pionowo i dzieli na dwie równe części strukturę). Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią igrek i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części, pierwsza znajduje się nad osią igrek a druga pod i nazywa się je lobami. W trzecim układzie wzdłuż osi igrek zlokalizowany jest orbital p indeks dolny igrek koniec indeksu również przypominający kształtem obracającą się wzdłuż osi trójwymiarową ósemkę. Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią iks i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części, pierwsza znajduje się nad osią iks a druga pod i nazywa się je lobami. W czwartym układzie wzdłuż osi zet zlokalizowany jest orbital p indeks dolny zet koniec indeksu również przypominający kształtem strukturę wyznaczoną przez trójwymiarową obracającą się wzdłuż własnej osi ósemkę (dla typowego zapisu cyfry osiem oś ta skierowana jest pionowo i dzieli na dwie równe części strukturę). Jest on dwukolorowy: czerwono-niebieski (niebieski nad osią iks i czerwony pod). Zwężenie ósemki znajduje się w samym środku układu, czyli w punkcie przecięcia osi i nie należy do orbitalu. Zatem orbital ten składa się z dwóch części, pierwsza znajduje się nad osią iks a druga pod i nazywa się je lobami. Po prawej stronie ilustracji za strzałką z napisem hybrydyzacja przedstawiono orbitale o hybrydyzacji typu powstałe na skutek wymieszania się orbitali: jednego typu s i trzech typu p. Powstałe orbitale stanowią, każdy jeden duży i jeden mały lob odchodzące od początku układu współrzędnych. Loby te zorientowane są w przestrzeni trójwymiarowej iks igrek zet. Pierwszy duży lob znajduje się nad osią iks wzdłuż osi zet, z kolei mały lob tworzący razem z nim orbital znajduje się po przeciwnej stronie osi iks również wzdłuż osi zet. Pozostałe trzy duże loby zlokalizowane są poniżej płaszczyzny wyznaczonej przez osie iks i igrek, w taki sposób, że pomiędzy wszystkimi lobami występują kąty równe sto dziewięć stopni i dwadzieścia osiem minut. Małe loby są przeciwlegle zlokalizowane względem dużych. Pomiędzy orbitalami występują kąty wynoszące sto dziewięć stopni i dwadzieścia osiem minut.
- Nazwa kategorii: Węglowodory
- Nazwa kategorii: Łańcuchowe (alifatyczne)
- Nazwa kategorii: Nasycone
- Nazwa kategorii: Alkany Koniec elementów należących do kategorii Nasycone
- Nazwa kategorii: Nienasycone
- Nazwa kategorii: Alkeny
- Nazwa kategorii: Alkadieny
- Nazwa kategorii: Alkiny Koniec elementów należących do kategorii Nienasycone
- Nazwa kategorii: Cykliczne (związki karbocykliczne)
- Nazwa kategorii: Jednopierścieniowe
- Nazwa kategorii: Nasycone
- Nazwa kategorii: Cykloalkany Koniec elementów należących do kategorii Nasycone
- Nazwa kategorii: Nienasycone
- Nazwa kategorii: Cykloalkeny
- Nazwa kategorii: Cykloalkadieny Koniec elementów należących do kategorii Cykloalkeny
- Nazwa kategorii: Cykloalkiny Koniec elementów należących do kategorii Nienasycone
- Nazwa kategorii: Aromatyczne Koniec elementów należących do kategorii Jednopierścieniowe
- Nazwa kategorii: Wielopierścieniowe
- Nazwa kategorii: Skondensowane
- Nazwa kategorii: Cykloalkany
- Nazwa kategorii: Cykloalkeny
- Nazwa kategorii: Areny Koniec elementów należących do kategorii Skondensowane
- Elementy należące do kategorii Węglowodory
- Elementy należące do kategorii Łańcuchowe (alifatyczne)
- Elementy należące do kategorii Nasycone
- Elementy należące do kategorii Nienasycone
- Elementy należące do kategorii Cykliczne (związki karbocykliczne)
- Elementy należące do kategorii Jednopierścieniowe
- Elementy należące do kategorii Nasycone
- Elementy należące do kategorii Nienasycone
- Elementy należące do kategorii Cykloalkeny
- Elementy należące do kategorii Wielopierścieniowe
- Elementy należące do kategorii Skondensowane
-
Węglowodory
-
Łańcuchowe (alifatyczne)
-
Nasycone
-
Alkany
-
-
Nienasycone
-
Alkeny
-
Alkadieny
-
Alkiny
-
-
-
Cykliczne (związki karbocykliczne)
-
Jednopierścieniowe
-
Nasycone
-
Cykloalkany
-
-
Nienasycone
-
Cykloalkeny
-
Cykloalkadieny
-
-
Cykloalkiny
-
-
Aromatyczne
-
-
Wielopierścieniowe
-
Skondensowane
-
Cykloalkany
-
Cykloalkeny
-
Areny
-
-
-
-
Ogólny podział węglowodorów. Węglowodory dzielą się na łańcuchowe (alifatyczne) i cykliczne (związki karbocykliczne). 1. Węglowodory łańcuchowe (alifatyczne) dzielą się na nasycone i nienasycone. 1.1. Nasycone. Wyróżnia się w nich alkany; 1.2. Nienasycone, wyróżnia się w nich: alkeny, alkadieny oraz alkiny. 2. Węglowodory cykliczne (związki karbocykliczne). Tu wyróżniamy jednopierścieniowe i wielopierścieniowe. 2.1. Węglowodory jednopierścieniowe. Należą do nich nasycone cykloalkany.; 2.2. Węglowodory jednopierścieniowe nienasycone. Należą do nich cykloalkeny. Tu wyróżnia się cykloalkadieny oraz cykloalkiny.; 2.3. Węglowodory jednopierścieniowe aromatyczne.; 2.4. Węglowodory cykliczne wielopierścieniowe. Wyróżnia się wśród nich skondensowane, które dzielą się na: cykloalkany, cykloalkeny, areny.
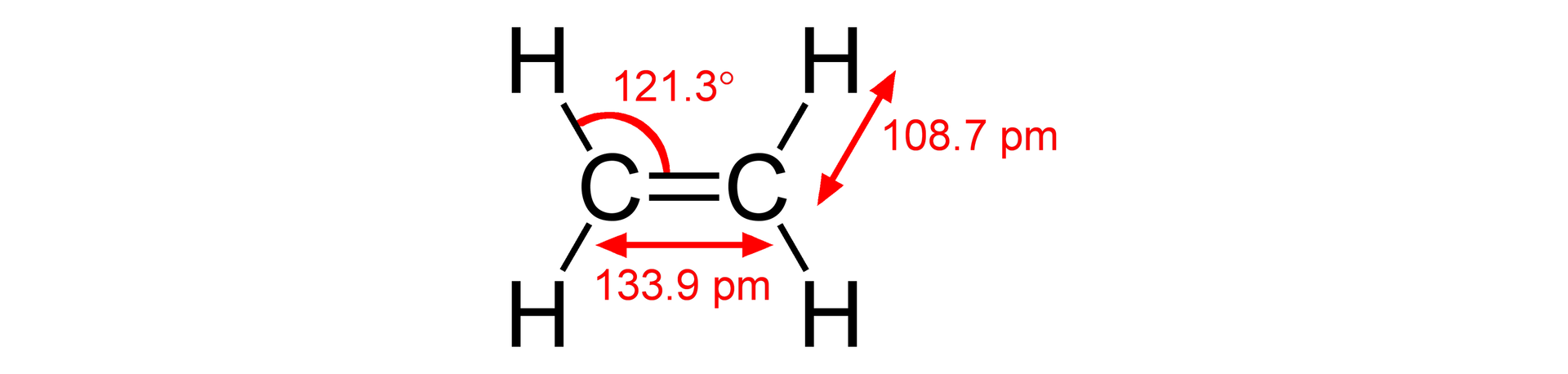
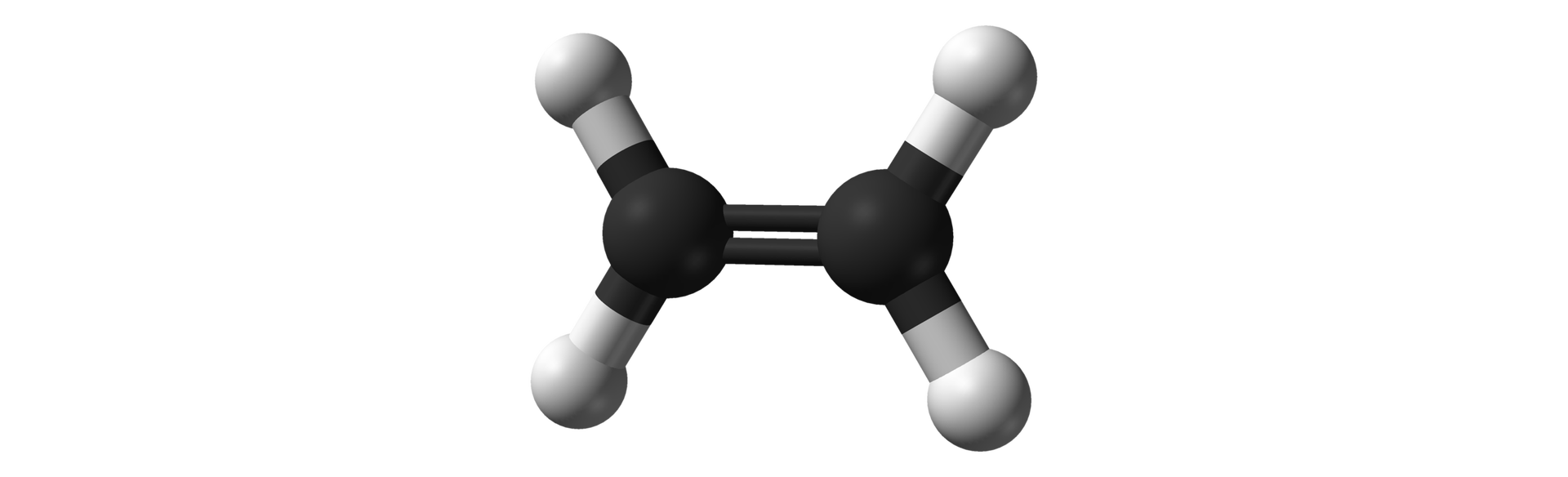
Jak zbudowane są cząsteczki alkenów?
Posiadasz już ogólne informacje na temat węglowodorów. Na ich podstawie zdobądź wiedzę szczegółową na temat jednej z rodzin węglowodorów, jaką są alkenyalkeny.
Na podstawie poniższej informacji o alkanachalkanach i parafinach oraz swoich dotychczasowych wiadomości o alkenach zastanów się, jak będą zbudowane poszczególne elementy szeregu homologicznegoszeregu homologicznego tych węglowodorów. Uzupełnij tabelę.
Informacja o alkanach:
Alkany zawierają w swojej budowie podstawowy szkielet węglowy i przyłączone do niego atomy wodoru. Atomy węgla scalone są ze sobą wyłącznie wiązaniami pojedynczymi (typu sigma). Alkany to związki chemiczne, które tworzą szereg homologiczny. Każdy kolejny węglowodór różni się od poprzedniego o jeden atom węgla oraz dwa atomy wodoru.
1, 2, 3, 4, 5, 6, 7, 8, 9, 10
| Liczba atomów węgla | Nazwa węglowodoru | Wzór strukturalny (uproszczony) | Wzór sumaryczny |
|---|---|---|---|
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 | |||
| 8 | |||
| 9 | |||
| 10 |
Dlaczego alkeny nie posiadają swojego odpowiednika metanu (alkan)?
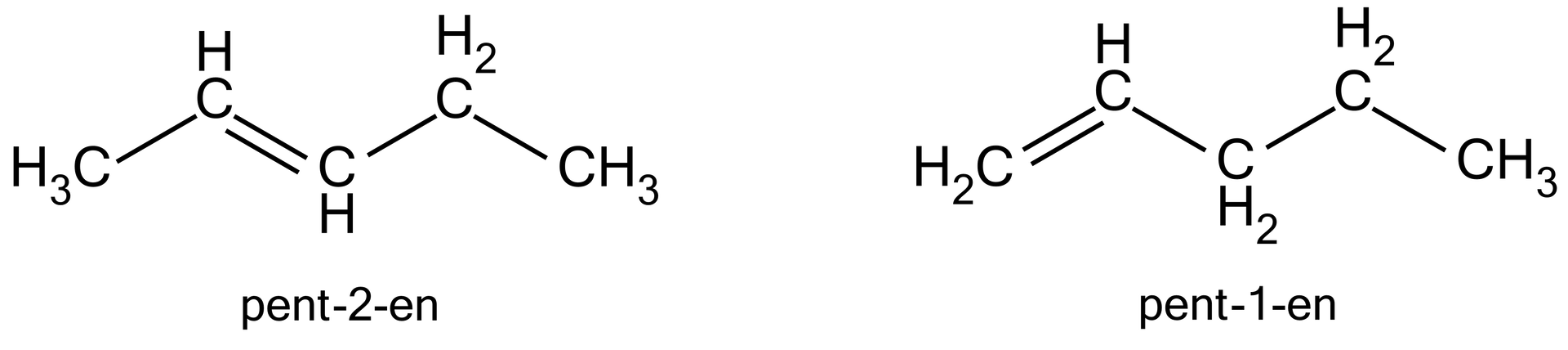
Wiązanie podwójne w alkenach może mieć różne położenie. O położeniu wiązania wielokrotnego informuje nas odpowiedni liczebnik w nazwie alkenu. W powyższym przypadku wiązanie podwójne występuje pomiędzy drugim a trzecim atomem węgla oraz pierwszym a drugim atomem węgla.

W alkenach może być również różna liczba wiązań podwójnych, np. dwa lub więcej. W takim przypadku mówimy o dienach, trienach itd.
Masz uzupełniony już wcześniej schemat, który przedstawia szereg homologiczny pierwszych 10 alkenów. Zastanów się i narysuj, jaki wzór strukturalny będzie miał kolejny węglowodór z szeregu homologicznego?
Masz uzupełniony już wcześniej schemat, który przedstawia szereg homologiczny pierwszych 10 alkenów. Zastanów się i narysuj w zeszycie, jaki wzór strukturalny będzie miał kolejny węglowodór z szeregu homologicznego?
Słownik
nienasycone związki organiczne zbudowane z węgla i wodoru o wzorze ogólnym posiadają w swojej strukturze wiązanie podwójne
(łac. parum affinis „mało powinowaty”) nasycone związki organiczne zbudowane z węgla i wodoru o wzorze ogólnym (n – liczba atomów węgla w cząsteczce węglowodoru), posiadają w swojej strukturze wiązania pojedyncze
atom lub grupa atomów, która powoduje pojawienie się charakterystycznych cech w danym związku chemicznym, np. aminowa
(łac. hibrida ,,mieszaniec”) tworzenie bardziej korzystnych energetycznie orbitali poprzez wymieszanie się orbitali atomowych, na skutek oddziaływania innych atomów podczas tworzenia cząsteczki (tylko w niektórych cząsteczkach)
hybrydyzacja, której kształt jest wynikiem nałożenia się orbitalu s oraz dwóch orbitali p
ciąg kolejnych związków chemicznych, których struktura zmienia się w stosunku do poprzedniego o pojedynczy identyczny fragment - grupę
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Mastalerz P., Podręcznik chemii organicznej, Wrocław 1998.
McMurry J., Chemia organiczna. T. 1‑2, Warszawa 2000.
Morrison R.T., Boyd R.N., Chemia organiczna. T. 1‑2, Warszawa 1997.