Przeczytaj
Brom
![Ilustracja przedstawia klatkę z charakterystyką bromu. Opisano co następuje: symbol Br, liczba atomowa 35, średnia liczba masowa 79,904 temperatura topnienia 265,9 stopnia Kelwina, temperatura wrzenia 331,95 stopnia Kelwina, gęstość 3,13 gramów na centymetr sześcienny w temperaturze 25 stopni Celsjusza czyli 298,15 stopni kelwina, najczęściej spotykane stopnie utlenienia: -1, 1, 3, 5, 7. Stan skupienia w warunkach normalnych – ciecz, konfiguracja elektronowa podpowłokowa skrócona (zawierająca rdzeń gazu szlachetnego) w stanie podstawowym [Ar]3d104s24p5.](https://static.zpe.gov.pl/portal/f/res-minimized/Ris2vEtbc5IwV/1689250263/58tK8A80q3T1PaHIKsic35yxPElcFTtA.png)
Brom jest trzecim przedstawicielem 17. grupy układu okresowego – fluorowców. Odkryty został niezależnie przez dwóch naukowców – niemieckiego chemika Carla Jacoba Löwiga w 1825 r., oraz francuskiego farmaceutę i chemika Antoine Balarda w 1826 r. Początkowo pierwiastek ten został nazwany przez Balarda muria, co z łaciny oznacza solankę. W późniejszym czasie zmieniono jego nazwę na Brôme (z jęz. greckiego betarhoomegamuomicronς), co oznaczało smród. Nazwa ta wywodziła się z charakterystycznego zapachu, jakie mają opary bromu.
Będąc w 17. grupie, brom należy do niemetali. Jego właściwości są zbliżone do właściwości pozostałych pierwiastków należących do tej grupy: fluoru, chloru oraz jodu. Podpowłokowa konfiguracja elektronowa w formie skróconej przyjmuje dla atomu bromu w stanie podstawowym następującą postać:
Siedem elektronów, znajdujących się na powłokach 4s i 4p, pełni funkcję elektronów walencyjnychelektronów walencyjnych. Do całkowitego wypełnienia podpowłoki 4p i osiągnięcia korzystnej energetycznie konfiguracji elektronowej brakuje jednego elektronu. Następstwem tego jest silne powinowactwo elektronowepowinowactwo elektronowe bromu, przez co jest on silnym utleniaczem. Reaguje z większością metali, tworząc odpowiednie sole – bromki. Elektroujemność bromu 2,9 (wg skali Paulinga) jest wartością pomiędzy wartościami sąsiadujących pierwiastków – chloru (3,1) i jodu (2,6).
Obecność niesparowanego elektronu sprawia, że w stanie wolnym brom występuje jako cząsteczka dwuatomowa . Dwa atomy bromu dzielą jedną wspólną parę elektronową, tworząc pojedyncze wiązanie.
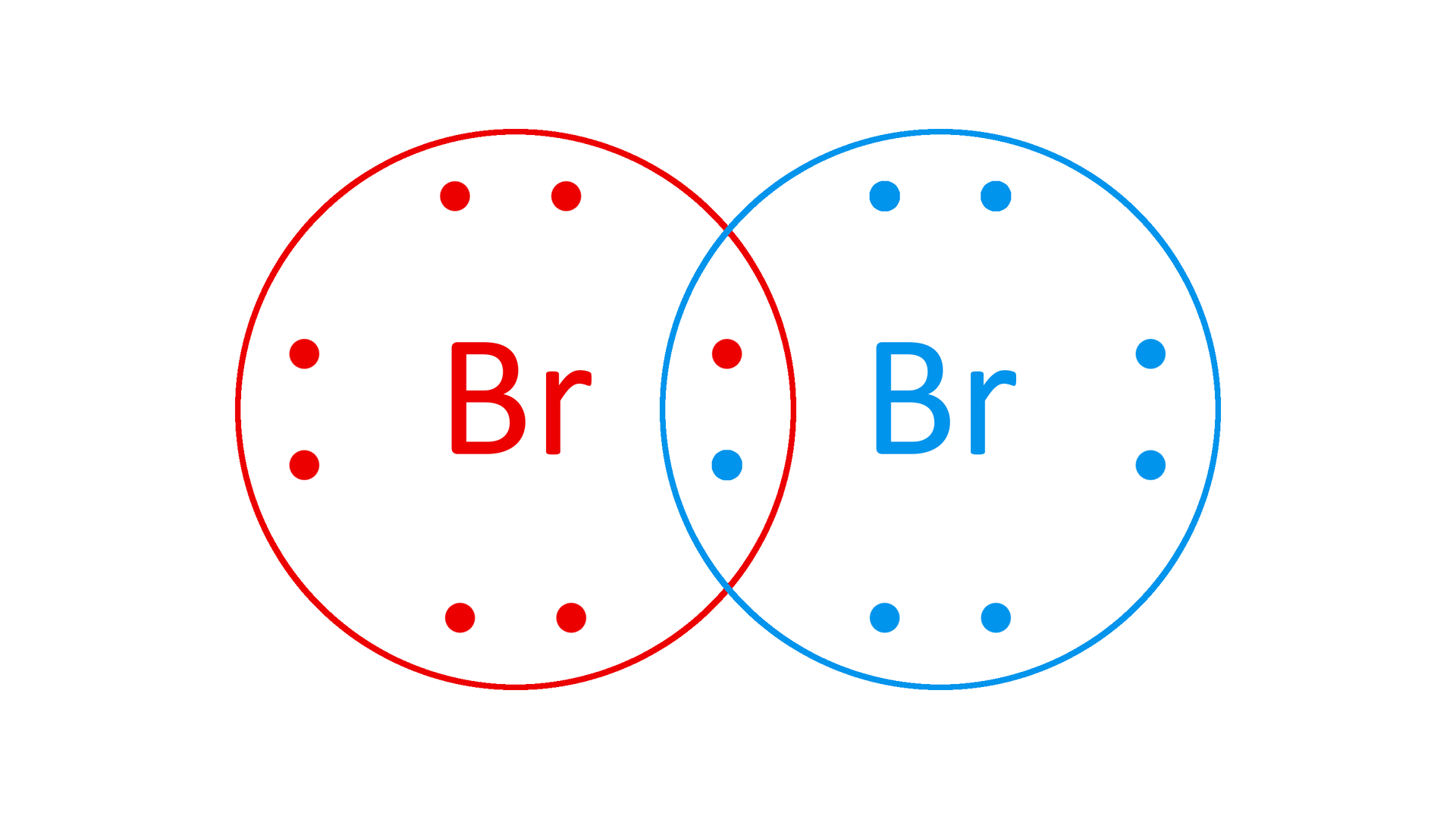
Idąc w dół grupy, zwiększają się masy molowe pierwiastków, co wpływa na stan skupienia, w jakim występują te pierwiastki w warunkach normalnych. Fluor i chlor leżą powyżej bromu, czyli mają mniejszą masę molową - są gazami, a jod, leżący niżej, jest ciałem stałym o charakterystycznej, fioletowej barwie. Brom natomiast jest cieczą o brunatnym zabarwieniu. Jego temperatury topnienia i wrzenia wynoszą odpowiednio 265,9 K i 331,95 K.

Brom reaguje z metalami, tworząc sole kwasu bromowodorowego – bromki. W wyniku reakcji bromu z metalami o zmiennych stopniach utlenienia, zwykle otrzymuje się sole pierwiastków na wyższych stopniach utlenienia, np. żelazo (tworzące związki na +II i +III stopniu utlenienia):
Bromki są pochodnymi bromowodoru o wzorze . Bromowodór rozpuszczony w wodzie dysocjuje praktycznie całkowicie na jony i , tworząc kwas bromowodorowy. Brom występuje w nim na stopniu utlenienia.
kwas bromowy ;
kwas bromowy ;
kwas bromowy ;
kwas bromowy .
Kwasy te są jednak generalnie niestabilne i łatwo ulegają rozkładowi do bromu oraz wody.
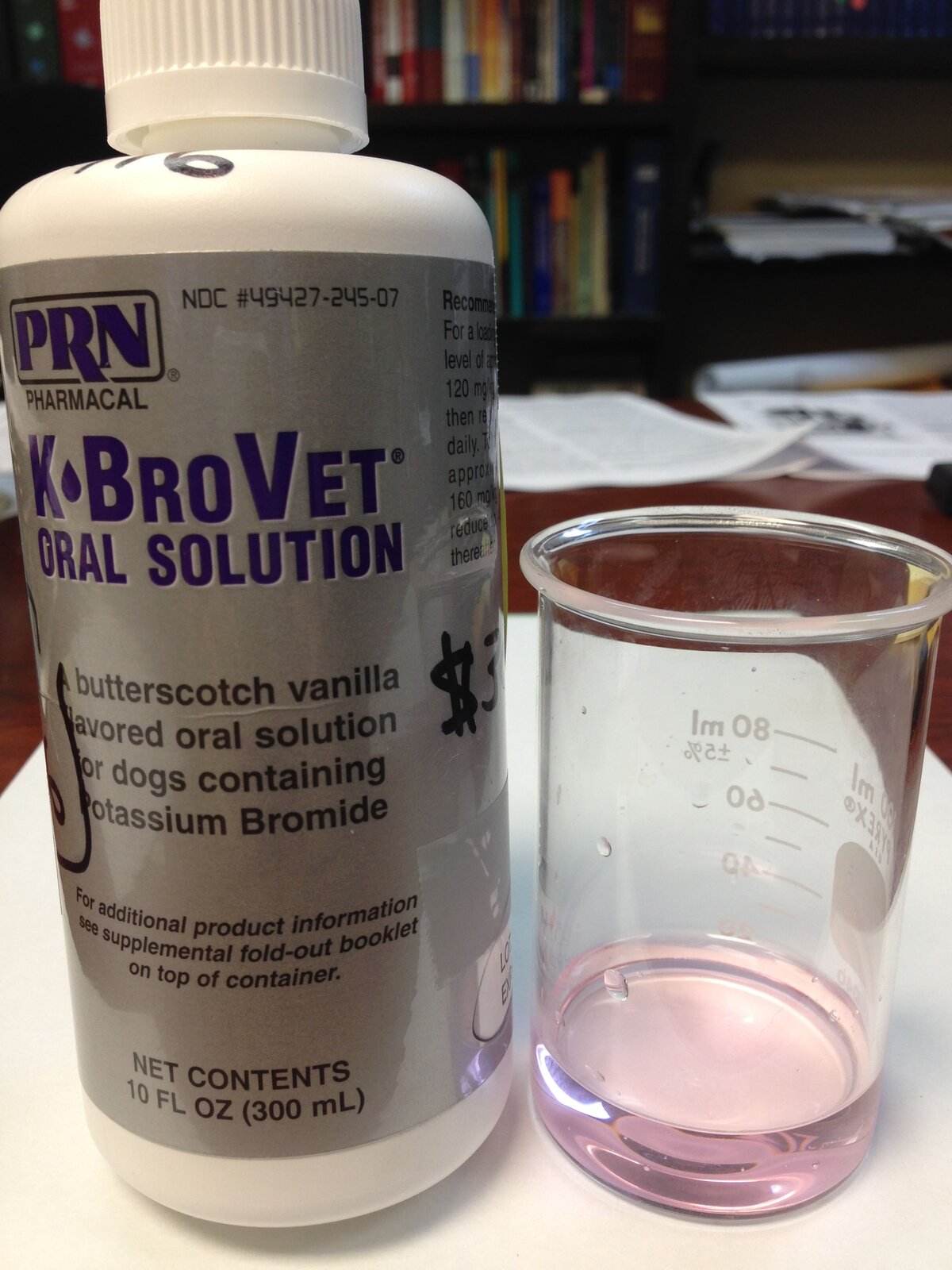
Bromek potasu () był pierwszym znanym i powszechnie stosowanym lekiem na epilepsję. Miał on właściwości uspokajające oraz łagodzące drgawki. Ze względu na swoją toksyczność preparat ten został wycofany. Obecnie bromek potasu wykorzystuje się w weterynarii (głównie w leczeniu napadów padaczkowych u psów).
Brom rozpuszcza się w wodzie (3,6 g na 1 dmIndeks górny 33 wody), tworząc wodę bromową o charakterystycznym, pomarańczowym zabarwieniu. Odczynnik ten jest wykorzystywany w chemii organicznej do wykrywania wiązań wielokrotnych w węglowodorach dzięki swoim utleniającym właściwościom. W wyniku reakcji węglowodorów nienasyconych z bromem, zawartym w wodzie bromowej, można zauważyć jej odbarwienie.

W wodzie bromowej występuje równowaga pomiędzy bromem a kwasem bromowym i kwasem bromowodorowym:
W przypadku zakwaszenia roztworu, równowaga przesuwa się w stronę produktów.
Wodny roztwór bromu jest nietrwały i z czasem rozkłada się z wydzieleniem bromowodoru oraz tlenu:
Reakcja ta zachodzi pod wpływem światła, dlatego też wodę bromową należy przechowywać w ciemnych naczyniach.
Sole bromu hamują wytwarzanie testosteronu, co wpływa na popęd płciowy u mężczyzn. Dawniej preparaty zawierające brom stosowano w wojsku, aby wyciszyć popęd płciowy.
Słownik
zdolność atomu do przyciągania elektronów
powłoka najdalej wysunięta od jądra atomowego; znajdują się na niej elektrony walencyjne
wielkość określająca zdolność atomu do przyłączania elektronu z utworzeniem jonu ujemnego
inaczej opóźniacz palenia, inhibitor palenia, substancja chemiczna dodawana do tworzyw sztucznych, ale także produktów pochodzenia naturalnego (np. bawełny i celulozy) w celu ograniczenia ich palności lub zmniejszenia szybkości ich spalania
Bibliografia
Atkins P., Jones L., Laverman L., Chemical Principles, 7th Edition, New York 2016.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012.
Encyklopedia PWN
Greenwood N. N., Earnshaw A., Chemistry of the Elements, Second Edition, Oksford 1997.