Przeczytaj
Etyn (acetylen)Etyn (acetylen) należy do szeregu homologicznegoszeregu homologicznego alkinów, czyli alifatycznych węglowodorów nienasyconych o wzorze ogólnym , które posiadają w swojej budowie jedno wiązanie potrójne.

W cząsteczce etynu każdy z atomów węgla ulega hybrydyzacjihybrydyzacji , w związku z czym cała cząsteczka jest płaska i wszystkie atomy leżą w jednej linii. Kąt pomiędzy wiązaniami to . Wiązanie potrójne składa się z jednego silnego wiązania typu oraz dwóch słabych (łatwo ulegających rozerwaniu) wiązań typu , które w znaczący sposób wpływają na reaktywność etynu oraz wszystkich pozostałych alkinów.
Jak myślisz, jakie właściwości fizyczne i chemiczne etynu mogą wynikać z jego budowy?
Właściwości fizyczne etynu
bezbarwny gaz;
lżejszy od powietrza (nieznacznie);
dobrze rozpuszczalny w rozpuszczalnikach organicznych (np. w acetonie/ toluenie);
nierozpuszczalny w wodzie;
słaby, eteryczny zapach.
Właściwości chemiczne etynu
Jego główną właściwością jest to, że jest palny.
Reakcje spalania
Etyn, w związku z powyższą cechą, tworzy z powietrzem mieszaninę wybuchową i spala się silnie kopcącym, żółtym płomieniem. Powyżej ciśnienia rozkłada się do węgla i wodoru. Następnie wodór tworzy z tlenem mieszaninę wybuchową i powstaje woda. Reakcja spalania, w której powstaje węgiel (w postaci sadzy), zachodzi na powietrzu i nazywa się spalaniem niecałkowitym. Równanie reakcji zapisuje się w następujący sposób:
Ten proces w kontekście transportu etynu jest problematyczny, dlatego przewozi się go w formie rozpuszczonej w acetonie (rozpuszczalniku organicznym).
Jeżeli w reakcji spalania bierze udział czysty tlen lub jest dostęp do nadmiaru powietrza, to produktem reakcji jest tlenek węgla() oraz woda, a reakcja nosi nazwę spalania całkowitego. Równanie reakcji zapisuje się w następujący sposób:
Reakcje addycji
Etyn oraz wszystkie pozostałe alkiny ulegają reakcjom addycji – przyłączania – na dwa omówione poniżej sposoby.
Addycja elektrofilowaAddycja elektrofilowa, czyli łączenie substratów, w której ważną rolę odgrywa elektrofilelektrofil.
Addycja na katalizatorzeAddycja na katalizatorze (, lub ).
Addycja cząsteczek , gdzie to lub
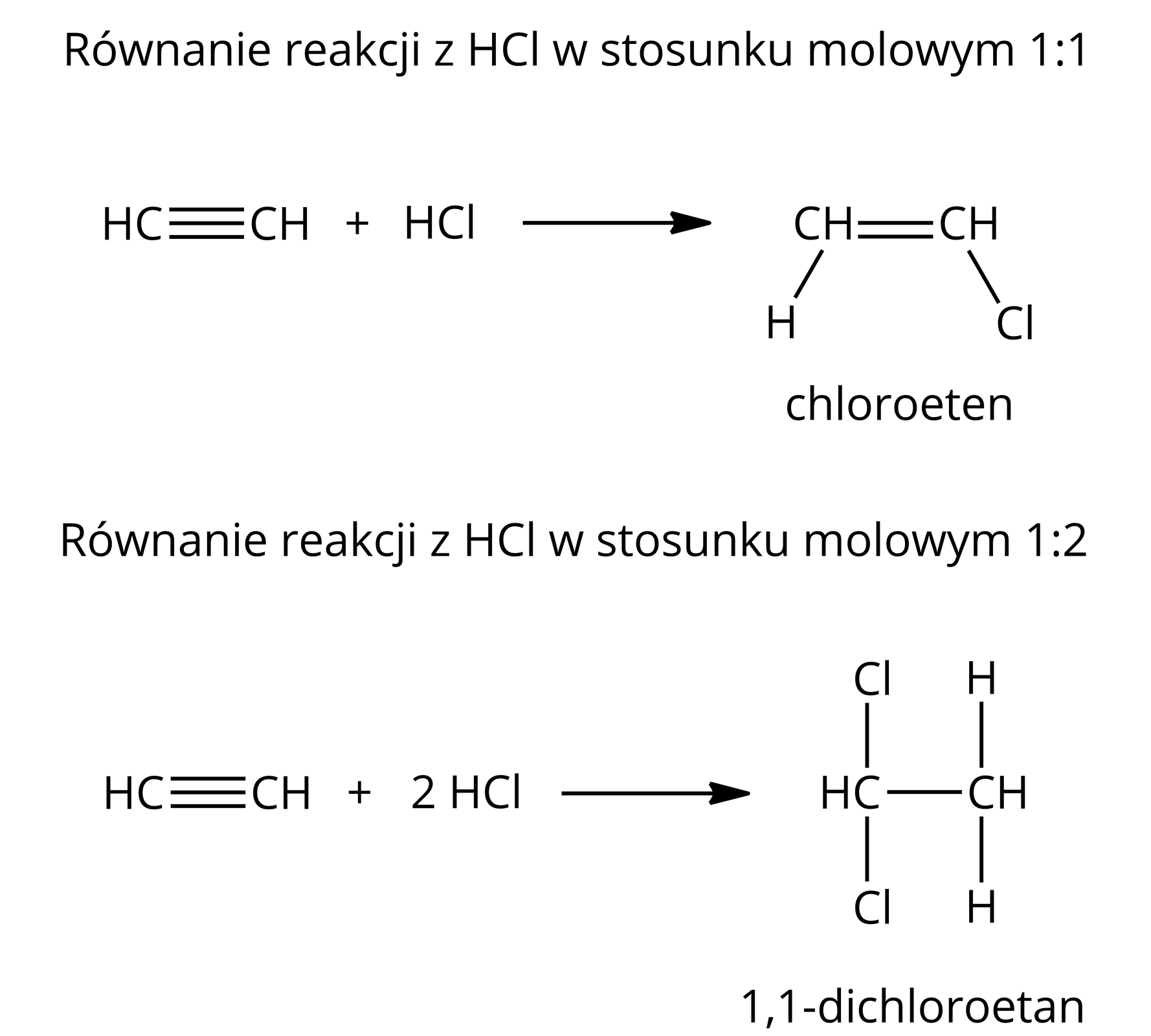
Addycja cząsteczki chlorowca może prowadzić do różnych produktów, w zależności od ilości użytego w reakcji reagenta w stosunku do alkinu. Przy reakcji zachodzącej w stosunku molowym powstaje dichlorowcopochodna alkenu, a przy stosunku tetrachlorowcopochodna alkanu, tak jak pokazano na poniższych przykładach.
Addycja cząsteczek , gdzie to lub
Addycja lub również prowadzi do różnych produktów, w zależności od ilości użytego w reakcji chlorowcowodoru. Przy reakcji zachodzącej w stosunku molowym powstaje chlorowcopochodna alkenu, a przy stosunku – dichlorowcopochodna alkanu.
Należy tutaj zwrócić uwagę na regułę Markownikowa, odnoszącą się do niesymetrycznych wiązań wielokrotnych, która mówi o tym, że atom wodoru, pochodzący z cząsteczki, która się przyłącza, zawsze atakuje atom węgla przy wiązaniu wielokrotnym, który jest bardziej uwodorniony (posiada więcej atomów wodoru).

Addycja wody
Reakcja addycji cząsteczki wody do etynu (bądź innego alkinu) to tzw. reakcja Kuczerowa. Zachodzi w specyficznych warunkach, a powstający produkt pośredni jest zgodny z regułą Markownikowa. Reguła ta odnosi się do reakcji addycji wody oraz chlorowcowodorów do wiązania wielokrotnego węglowodorów nienasyconych. W wyniku addycji atom wodoru przyłącza się do tego atomu węgla związanego wiązaniem wielokrotnym, przy którym znajduje się więcej atomów wodoru. Z kolei grupa (lub atom chlorowca) do tego atomu węgla, połączonego wiązaniem wielokrotnym, przy którym znajduje się mniej atomów wodoru. Powstające związki pośrednie to tzw. enole, które charakteryzują się dużą nietrwałością, dlatego bardzo szybko ulegają przegrupowaniu do aldehydu (w przypadku etynu) lub ketonów (w przypadku pozostałych alkinów). Takie przegrupowanie nazywamy tautomerią.

Addycja wodoru
Przebieg addycji wodoru do nienasyconych węglowodorów (w tym etynu) różni się od typowej addycji elektrofilowej halogenów, halogenowodorów czy wody. Reakcja uwodornienia zachodzi na katalizatorze, najczęściej rozdrobnionym niklu, palladzie lub platynie. W przypadku uwodornienia etynu, przy reakcji z wodorem w stosunku molowym , powstaje eten, natomiast przy stosunku – etan.
Równanie reakcji z wodorem w stosunku molowym – eten (etylen)
Równanie reakcji z wodorem w stosunku molowym – etan
Reakcje polimeryzacji
W odpowiednich warunkach zachodzi również polimeryzacjapolimeryzacja acetylenu, w wyniku której powstaje polietyn, tzw. poliacetylen (skróty: PA lub PAC), charakteryzujący się dużym przewodnictwem prądu elektrycznego. Stosowany jest m.in. do wyrobu nici chirurgicznych.

Reakcje trimeryzacji
Etyn, w odpowiednich warunkach (), ulega trimeryzacji do benzenu, a równanie tej reakcji zapisuje się w następujący sposób:

Jest to szczególny rodzaj polimeryzacji, w której zamiast cząsteczek monomerów, tylko trzy z nich biorą udział w reakcji.
Zachowanie etynu wobec wodnego roztworu
Rozcieńczony roztwór manganianu() potasu powoduje utlenienie etynu do kwasu szczawiowego, występującego w mieszaninie reakcyjnej w postaci soli – szczawianu potasu – ze względu na zasadowy odczyn środowiska po reakcji.

Z kolei w środowisku kwasowym ma miejsce rozerwanie łańcucha węglowodorowego i utworzenie tlenku węgla() jako produktu utlenienia etynu. Produktami są również sole, m.in. sól manganu na stopniu utlenienia (bezbarwny/ bladoróżowy roztwór), charakterystyczna dla reakcji redukcji manganianu() potasu w środowisku kwasowym.
Słownik
najprostszy alkin; gaz palny, stosowany m.in. do spawania i cięcia metali
szereg związków organicznych należących do jednej grupy (np. alkany, alkohole), których cząsteczki różnią się między sobą liczbą grup metylenowych
zabieg matematyczny z udziałem walencyjnych orbitali atomowych atomu centralnego w cząsteczce, prowadzący do powstawania odpowiedniej liczby orbitali atomowych (hybryd), będących w różnych stanach energetycznych
reakcja addycji, w której elektrofil (indywiduum z niedomiarem elektronów) przyłącza się do nukleofila (indywiduum z nadmiarem elektronów), bez powstawania produktów ubocznych
indywiduum chemiczne obdarzone ładunkiem dodatnim (w reakcji bromowania jest to , w reakcji nitrowania , w reakcji chlorowania , w reakcji metylowania itd.)
reakcja łączenia substratów, zachodząca na katalizatorze, zazwyczaj rozdrobnionym niklu, palladzie lub platynie
reakcja łączenia się wielu cząsteczek monomerów w jedną dużą cząsteczkę polimeru, bez powstawania produktów ubocznych, kosztem rozrywania wiązań wielokrotnych
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.