Przeczytaj
Fluorowcowodory (halogenowodory)
Wodorki stanowią jedną z najbardziej zróżnicowanych grup związków chemicznych, wykazując silną zmienność właściwości fizycznych i chemicznych, w zależności od położenia w układzie okresowym pierwiastka związanego z atomem wodoru. Jedną z najbardziej interesujących grup wodorków są wodorki pierwiastków grupy układu okresowego, czyli fluorowców.
Wodorki grupy to związki zbudowane z atomu wodoru i atomu fluorowca. W tych związkach wodór występuje na stopniu utlenienia, natomiast atom fluorowca na stopniu utlenienia .
Pod względem właściwości fizycznych i chemicznych, stanowią one jedną z najbardziej jednorodnych grup związków pierwiastków z wodorem. Wszystkie halogenowodoryhalogenowodory w warunkach normalnych są gazami dobrze rozpuszczalnymi w wodzie. Ich wodne roztwory są kwasami, przy czym moc kwasów rośnie w kierunku . Wzrost mocy kwasów beztlenowych jest zgodny ze spadkiem wartości elektroujemności fluorowca. Głównym jednak czynnikiem odpowiedzialnym za moc kwasów beztlenowych, a więc tendencję do zachodzenia procesu dysocjacji elektrolitycznej, jest promień atomowy – wraz ze wzrostem promienia atomowego fluorowca moc kwasu rośnie. W praktyce wodne roztwory , oraz są bardzo mocnymi kwasami, natomiast jest kwasem słabym.
Ze względu na bardzo wysoką elektroujemność fluoru – najwyższą spośród wszystkich pierwiastków – oraz jego niewielki promień atomowy, wiązania wodorowe, występujące pomiędzy cząsteczkami , należą do wyjątkowo silnych. Znajduje to potwierdzenie w bardzo wysokiej, w porównaniu do innych halogenowodorów, temperaturze wrzenia, wynoszącej .
Stwierdzono obecność asocjatówasocjatów , gdzie . Ponadto w roztworze występują jony , powstałe wskutek dysocjacji , wg równania:
Wiązania wodorowe
Cząsteczki wodorków grupy są polarne. W warunkach standardowych wszystkie są gazami. Wartości temperatur wrzenia rosną w szeregu od wartości do . Pomiędzy cząsteczkami tych wodorków występują oddziaływania dipol–dipol, co powoduje systematyczny wzrost temperatur wrzenia wraz ze wzrostem masy cząsteczkowej wodorku.
W przypadku fluorowodoru, posiadającego najmniejszą masę cząsteczkową spośród wszystkich wodorków grupy , wartość temperatury wrzenia osiąga rekordowo . Tak wysoka temperatura wrzenia jest konsekwencją występowania wiązań wodorowych pomiędzy cząsteczkami . Ze względu na bardzo wysoką elektroujemność oraz mały promień atomowy fluoru, wiązania wodorowe pomiędzy cząsteczkami należą do najsilniejszych wiązań wodorowych. Wysoka temperatura wrzenia wynika z obecności asocjatów zbudowanych z kilku – od dwóch do sześciu – cząsteczek . Wodny roztwór fluorowodoru jest słabym kwasem. Ze względu na występowanie wiązań wodorowych pomiędzy cząsteczkami , w roztworze kwasu fluorowodorowego, oprócz jonów fluorkowych, które powstają w procesie dysocjacji:
zachodzi także proces:
Jony mają kształt liniowy.
Wodorki definiuje się jako związki wodoru z innymi pierwiastkami. Chociaż nazwa „wodorek” w swoim dosłownym znaczeniu określa jon , to przyjęto określać wszystkie dwupierwiastkowe związki wodoru z innymi pierwiastkami jako „wodorki”, niezależnie od tego, czy wodór występuje w nich na czy stopniu utlenienia. W przypadku wodorków grupy , wiązanie można scharakteryzować jako kowalencyjne spolaryzowane, przy czym polarny charakter wiązania maleje w kierunku od do .
Jak zbudowane są cząsteczki wodorków grupy układu okresowego
Cząsteczki dwuatomowe wodorków fluorowców
Wszystkie fluorowce tworzą wodorki o wzorze .
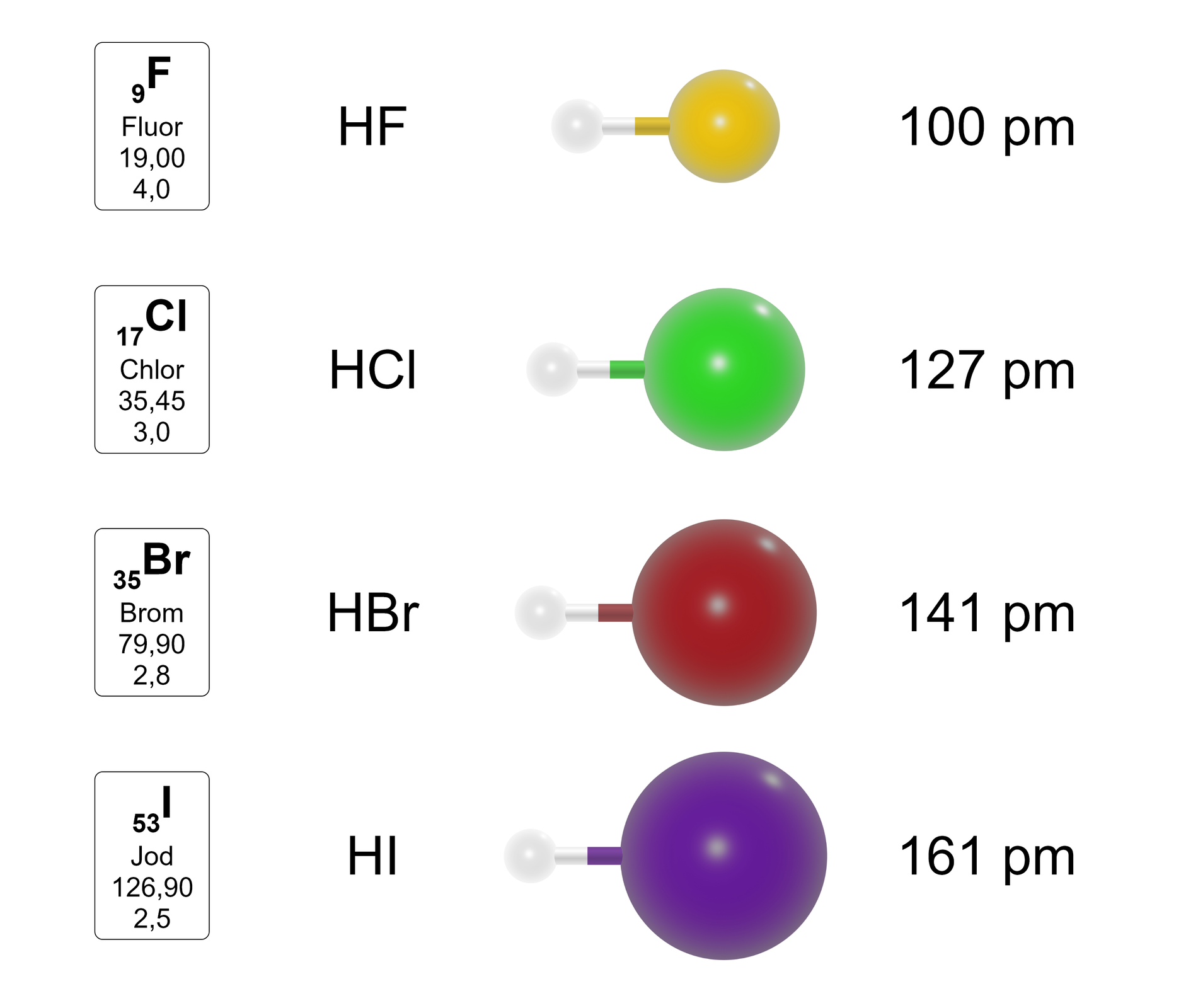
Budowa cząsteczek halogenowodorów:
Pierwiastek | Udział charakteru jonowego w wiązaniu | Energia wiązania |
|---|---|---|
Fluor | ||
Chlor | ||
Brom | ||
Jod |
Wodne roztwory halogenowodorów
Wodne roztwory halogenowodorów wykazują właściwości kwasowe.
Słaby kwas
Pierwiastek | Stężenie procentowe nasyconego roztworu wodnego |
|---|---|
Fluor |
rozpuszcza się w każdej ilości w wodzie, lecz tylko niewielka część cząsteczek dysocjuje:
Wskazuje na to niska wartość stałej dysocjacji kwasu () dla tego związku.
Mocne kwasy
Pierwiastek | Stężenie procentowe nasyconego roztworu wodnego |
|---|---|
Chlor | |
Brom | |
Jod |
Wodne roztwory , i są mocnymi kwasami. Dysocjacja tych halogenowodorów jest całkowita:
Moc kwasów beztlenowych, utworzonych przez wodorki grupy , rośnie w dół grupy, czyli przeciwnie do różnicy elektroujemności.
Pierwiastek | Różnica elektroujemności | Energia wiązania | Stała dysocjacji kwasowej | Moc kwasu |
|---|---|---|---|---|
Fluor |
| Słaby kwas | ||
Chlor |
| Bardzo mocne kwasy | ||
Brom |
| |||
Jod |
|
Wiązania wodorowe występujące we fluorowodorze
Ze względu na dużą różnicę elektroujemności między wodorem a fluorem, pomiędzy cząsteczkami występują wiązania wodorowe.
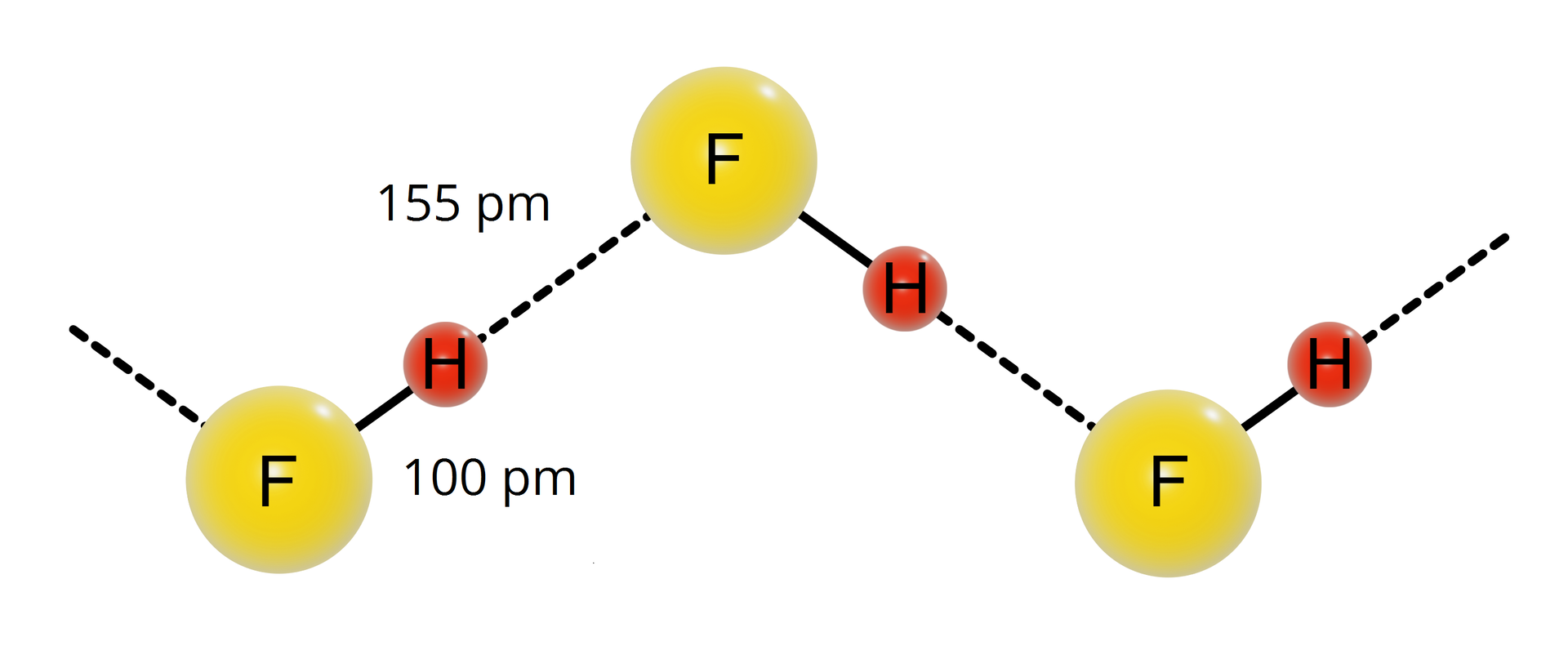
Wiązanie wodorowe pomiędzy cząsteczkami to najsilniejsze wiązanie wodorowe
(). Konsekwencjami tego są:
nieograniczona rozpuszczalność w wodzie;
obecność jonów w wodnym roztworze ; dysocjuje na i ;
wysoka – w porównaniu do innych fluorowodorów – temperatura wrzenia i topnienia ;
w przypadku ciała stałego występują zygzakowate łańcuchy ;
w przypadku cieczy są mniejsze jednostki: od do .
- 1. zestaw danych:
- Związek: HF
- Temperatura wrzenia: 20; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- Temperatura topnienia: -83; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- 2. zestaw danych:
- Związek: HCl
- Temperatura wrzenia: -85; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- Temperatura topnienia: -174; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- 3. zestaw danych:
- Związek: HBr
- Temperatura wrzenia: -67; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- Temperatura topnienia: -88; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- 4. zestaw danych:
- Związek: HI
- Temperatura wrzenia: -35; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
- Temperatura topnienia: -51; Podpis osi wartości: [font-style: italic;]T[/] [[°C]]
Słownik
pierwiastek grupy ; inaczej fluorowiec, zazwyczaj atom fluorowca oznacza się symbolem
związek fluorowca z wodorem o wzorze
łączenie się cząsteczek danego związku w większe ugrupowania (asocjaty) dzięki oddziaływaniom międzycząsteczkowym, w tym wodorowym
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa i wyd. następne.