Przeczytaj
Dział chemii, który zajmuje się badaniem efektu energetycznego reakcji chemicznych, to termochemia. Opisuje zmiany energii, które zachodzą podczas różnych procesów chemicznych. Można zauważyć, że niektóre z reakcji wydzielają dużą ilość energii (np. reakcja cynku z kwasem solnym), inne zaś nie zajdą bez dostarczenia im określonej ilości energii (np. proces fotosyntezy). Jest ona wymieniana między układem, w którym zachodzi analizowany proces, a otoczeniem.
Entalpia
W życiu codziennym oraz w laboratorium najczęściej reakcje chemiczne zachodzą w warunkach izobarycznych (czyli pod stałym ciśnieniem atmosferycznym). Dla takich układów wprowadzono nową funkcję termodynamiczną – entalpię. Jest ona definiowana jako suma energii wewnętrznej układu i iloczynu jego ciśnienia i objętości:
gdzie:
– entalpia;
– energia wewnętrzna;
– ciśnienie;
– objętość.
W procesach chemicznych, przebiegających pod stałym ciśnieniem, wymianę energii na sposób ciepła, między układem a otoczeniem, określa się jako zmianę entalpii układu, która w przybliżeniu jest równa efektowi cieplnemu reakcji.
gdzie:
– zmiana entalpii układu;
– entalpia produktów (stan po reakcji chemicznej);
– entalpia substratów (stan przed reakcją chemiczną).
Entalpia układu jest funkcją stanufunkcją stanu. Oznacza to, że jej wartość nie zależy od drogi, po której układ doszedł do danego stanu. Na tej podstawie można stwierdzić, że efekt cieplny reakcji, przebiegającej w danym kierunku, jest równy efektowi cieplnemu reakcji odwrotnej z przeciwnym znakiem (prawo Lavoisiera i Laplace’a).
Ciepło wydzielone w czasie tworzenia jednego mola tlenku wapnia z jednego mola wapnia oraz połowy mola cząsteczek tlenu wynosi . Można to zobrazować równaniem:
Ciepło potrzebne do rozkładu mola na pierwiastki jest równe co do wartości ciepłu tworzenia tego tlenku, ale przeciwne co do znaku.
Inny przykład reakcji:
równanie reakcji tworzenia węglanu litu:
równanie reakcji rozkładu węglanu litu:
Zmiana entalpii układu w reakcjach chemicznych wynosi:
dla reakcji endotermicznychreakcji endotermicznych (). W reakcji chemicznej tego typu energia jest pobierana.

dla reakcji egzotermicznychreakcji egzotermicznych (). W reakcji chemicznej tego typu jest wydzielana energia.

Równania termochemiczne
Reakcję chemiczną w termochemii definiuje się jako przemianę, w której substraty stanowią początkowy stan układu, a produkty stan końcowy. Efekt energetyczny zapisuje się obok równania stechiometrycznego, zawierającego indeksy stanów skupienia.
lub
Powyższy zapis to przykład równania termochemicznego. Symbol to standardowa entalpia reakcji. Określa ona efekt cieplny reakcji przeprowadzonej w warunkach standardowych, gdzie temperatura wynosi , a ciśnienie , oraz przy założeniu, że reakcja przebiega z udziałem liczb moli reagentów równych ich współczynnikom stechiometrycznym, a wydajność reakcji jest równa .
Obok równania termochemicznego można również zapisać wartość tzw. standardowej entalpii molowej, która jest wyrażana w . Określa ona efekt cieplny reakcji odniesiony do mola wybranego reagenta.
Biorąc za przykład poniższe równanie reakcji:
Jak poprawnie odczytać zapis równania termochemicznego?
Efekt energetyczny jest to inaczej zmiana entalpii w warunkach standardowych reakcji mola benzenu w stanie ciekłym z molami wodoru w stanie gazowym, dzięki czemu powstaje mol cykloheksanu w stanie ciekłym. Zmiana entalpii wynosi .
Badanie efektu energetycznego reakcji z . Obliczanie entalpii reakcji.
Odczynniki:
;
(proszek).
Sprzęt:
termometr,
waga;
styropianowe kubki;
mieszadło magnetyczne (opcjonalnie).
Wykonanie:
W doświadczeniu badany jest efekt energetyczny, który towarzyszy reakcji wypierania miedzi z roztworu przez bardziej aktywny metal.
Doświadczenie wykonywane jest w prostym kalorymetrze, który można wykonać z dwóch kubków styropianowych. Jeden z nich będzie naczyniem reakcyjnym, drugi będzie służył jako przykrywka (w nim należy wykonać mały otwór, aby możliwe było włożenie termometru). W naczyniu należy umieścić roztworu soli miedzi() o stężeniu i dokonać pomiaru temperatury. Następnie należy dodać pyłu cynkowego, zamknąć kalorymetr oraz dokonywać pomiaru temperatury w pewnych odstępach czasu. Roztwór należy mieszać.

Za pomocą wyznaczenia różnicy pomiędzy temperaturą początkową a maksymalną, można określić przyrost temperatury. Należy utworzyć w tym celu wykres zmiany temperatury w czasie.
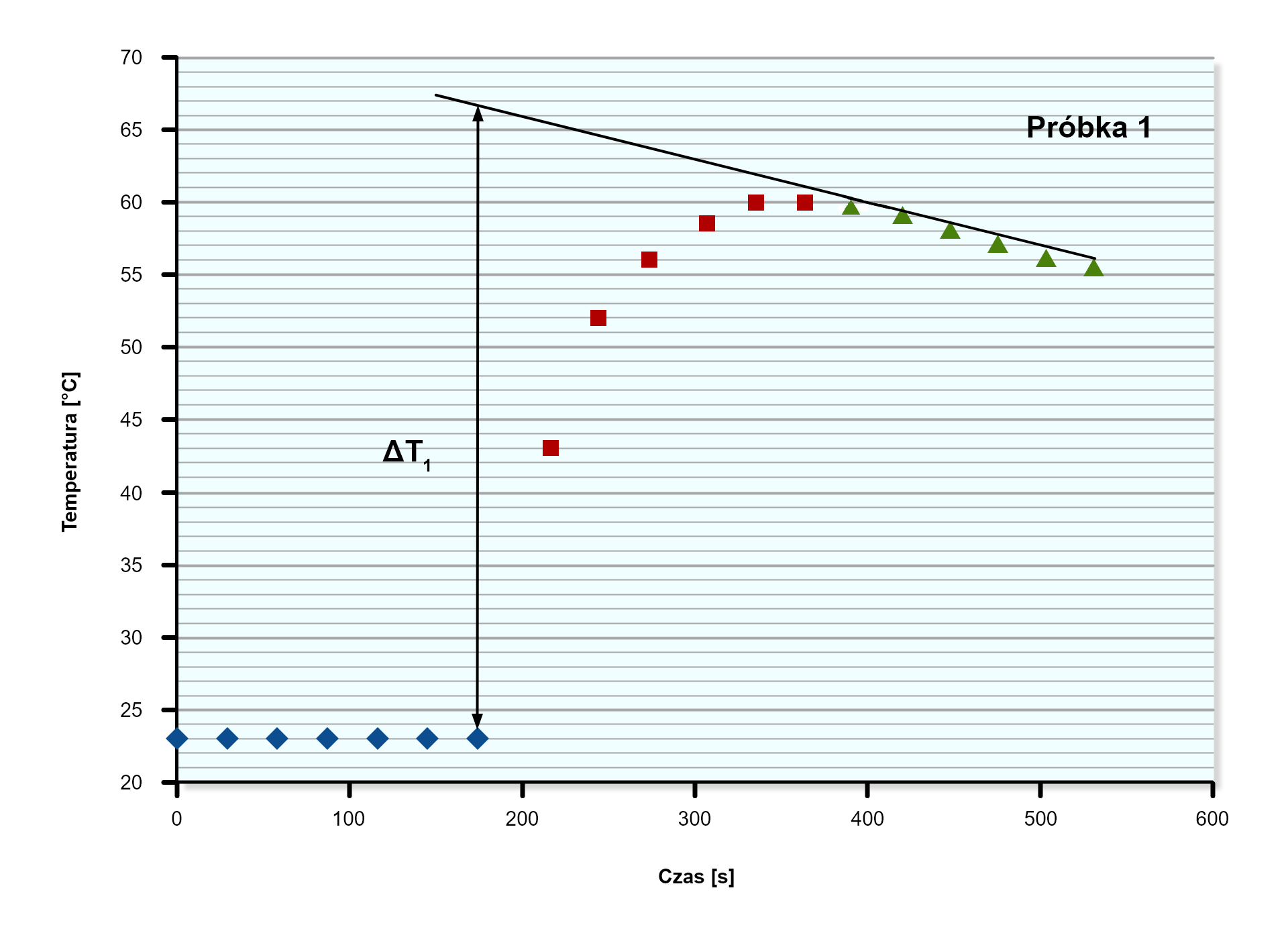
Do wyznaczonej serii danych dopasowano prostą, która została ekstrapolowana do czasu pierwszego przyrostu temperatury. Różnica temperatur została wyznaczona poprzez określenie różnicy pomiędzy temperaturą początkową a temperaturą wyznaczoną przez prostą.
Na podstawie danych obliczamy entalpię reakcji.
Entalpię reakcji obliczamy na podstawie równania:
gdzie:
– masa wody (roztworu);
– pojemność cieplna wody ();
– wyznaczona zmiana temperatury.
Gęstość wody wynosi .
Obliczanie ilości pobranego ciepła:
W czasie reakcji ciepło zostaje wydzielone, stąd zmiana entalpi reakcji wynosi:
W doświadczeniu użyto w nadmiarze cynku, więc efekt energetyczny można odnieść do ilości moli jonów miedzi w roztworze. Do reakcji użyto roztworu o stężeniu . Zatem liczba moli w roztworze wynosiła mola. Po przeliczeniu na 1 mol:
Słownik
funkcja zależna od aktualnych parametrów układu (masy, temperatury, ciśnienie)
dział chemii fizycznej oraz termodynamiki chemicznej; zajmuje się metodami pomiaru ciepła powstającego w wyniku reakcji chemicznych i rozmaitych procesów fizycznych
przemiana chemiczna, podczas której następuje wydzielenie energii z układu do otoczenia
przemiana chemiczna, podczas której następuje pochłanianie energii z otoczenia do układu
dział chemii, który zajmuje się efektami energetycznymi reakcji chemicznych
Bibliografia
Atkins P., Podstawy chemii fizycznej, Warszawa 1999.
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Atkins P., Julio P., Chemia fizyczna, Warszawa 2015.