Przeczytaj
Benzyna z tlenku węgla() i wodoru? Ale czad!
Synteza Fischera-Tropscha (w skrócie reakcja F‑T) jest reakcją tworzenia węglowodorów z mieszaniny tlenku węgla() i wodoru, czyli tzw. gazu syntezowanego, w celu produkcji płynnego paliwa, pozbawionego siarki i azotu.
Gaz syntezowany otrzymuje się z węgla, gazu ziemnego (w procesie reformingu parowego) lub biomasy. To pierwszy, a zarazem najdroższy etap syntezy Fischera-Tropscha.

Jean‑Baptiste Senderens i Paul Sabatier w roku przeprowadzili syntezę metanu z mieszaniny wodoru i tlenku węgla() oraz wodoru i tlenku węgla() w obecności zredukowanego niklu w temperaturze -. Tę samą syntezę wykonali również w obecności zredukowanego kobaltu w temperaturze -. Jedenaście lat później, badacze z BASF opublikowali wyniki dotyczące reakcji konwersji gazu syntezowego do ciekłych związków tlenowych, zawierających również małe ilości węglowodorów.
Benzyna syntetyczna – historia
W czasie wojny światowej, w Policach działała jedna z największych niemieckich fabryk benzyny syntetycznejbenzyny syntetycznej, należąca do IG Farben Industrie. Popadła jednak w ruinę zaraz po zakończeniu wojny. Benzynę syntetyczną produkowano także w Blachowni Śląskiej do roku.

Benzyna syntetyczna – metody syntezy
Środki przeciwstukowe (antydetonatory)
Paliwo zawiera w swoim składzie węglowodory o długości od do atomów węgla. Parametrem, który określa odporność benzyny na spalanie stukowespalanie stukowe, jest liczba oktanowa (LO).
gdzie:
– liczba oktanowa poszczególnych składników mieszanki paliwowej;
– procent objętościowy poszczególnych składników mieszanki paliwowej.
Ustalono, że wzorcem „najlepszego” paliwa będzie ,,-trimetylopentan, zwany izooktanem, któremu przypisuje się , a „najgorszego” heptan, któremu z kolei przypisuje się . Wiele związków może jednak znacznie wykraczać poza tę umowną skalę, tzn. cechować się ujemną wartością LO lub znacznie przekraczać . Jeśli benzyna, którą możemy kupić na stacji, ma , to oznacza, że spala się jak mieszanina zawierająca objętościowych izooktanu i objętościowych heptanu. Ze względu na to, że we frakcji benzynowej, otrzymywanej z destylacji ropy naftowej, znajdują się liczne alkany o prostych łańcuchach, taka benzyna ma niską liczbę oktanową. Celem podwyższenia LO stosuje się substancje o właściwościach przeciwstukowych (np. etanol, toluen, kumen i inne).
Wiele związków chemicznych, z powodu swojej skomplikowanej lub długiej nazwy systematycznej, zapisuje się za pomocą skrótów. Poniżej znajdziesz ich wyjaśnienie dla trzech wybranych związków, które znajdują zastosowanie jako środki przeciwstukowe.
Skrót | Nazwa związku | Wzór chemiczny |
|---|---|---|
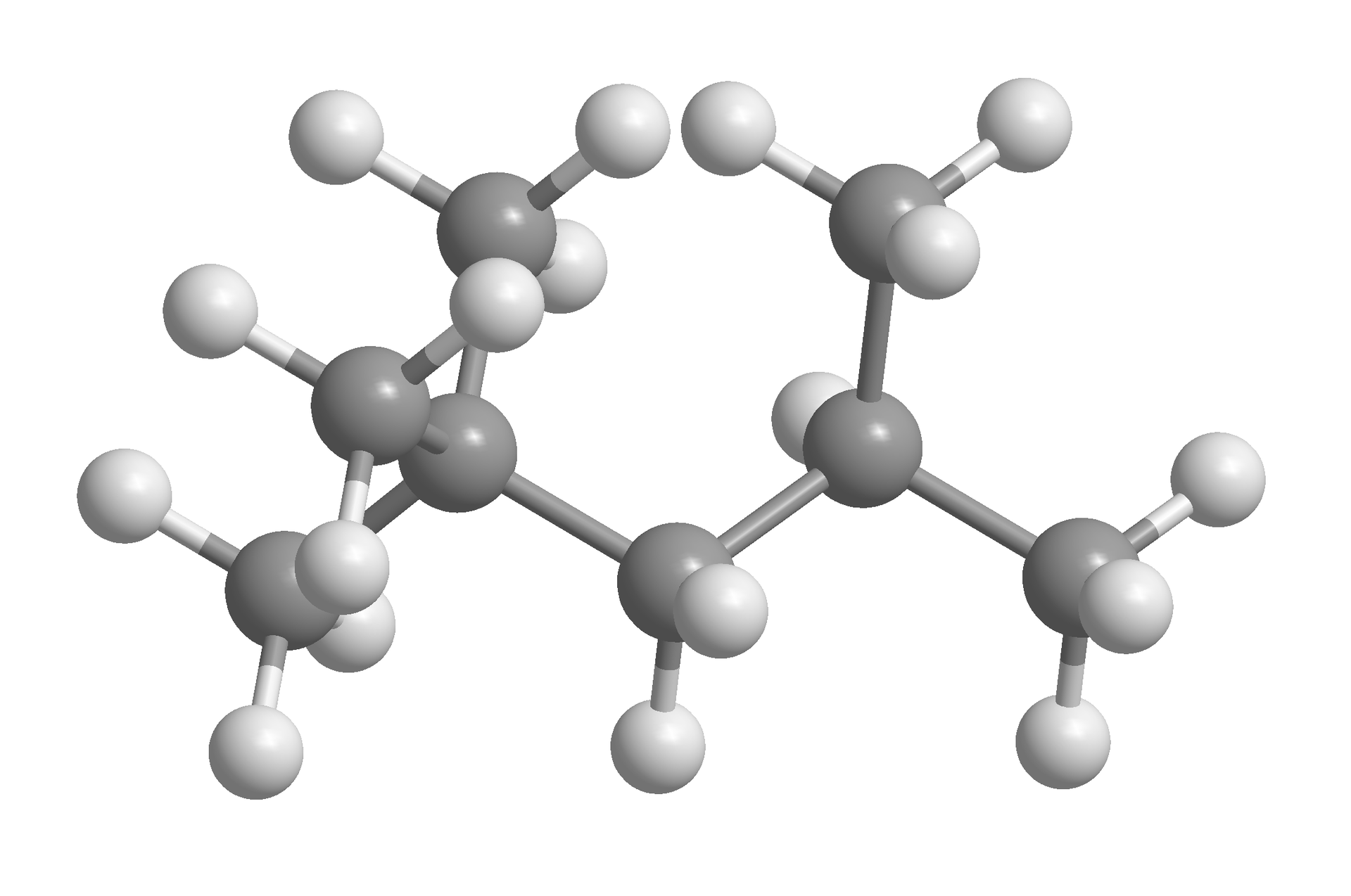
MMT | trikarbonyl(metyl‑‑cyklopentadienyl)mangan |  Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
MTBE | eter tert-butylowo‑metylowy | 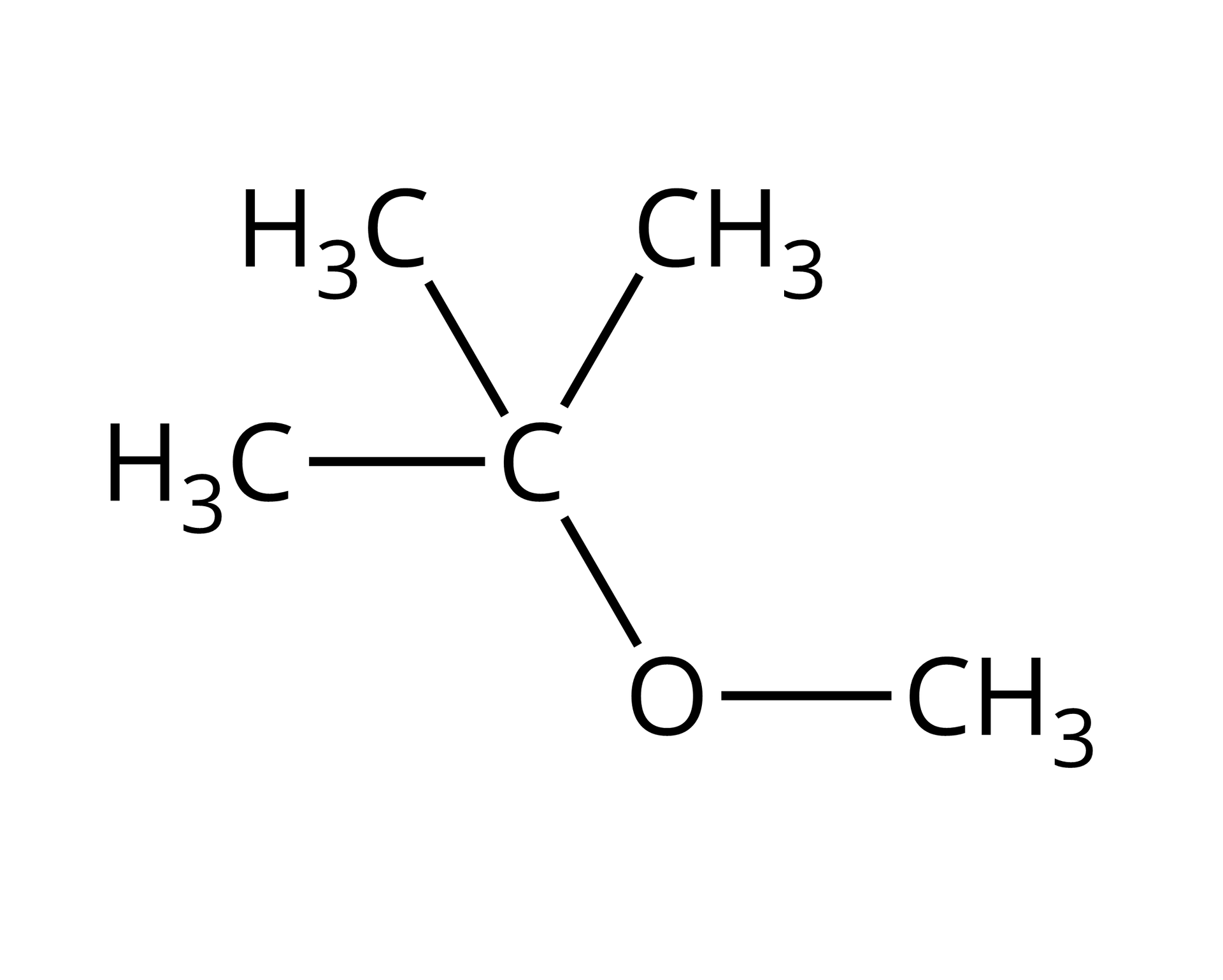 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
ETBE | eter tert-butylowo‑etylowy | 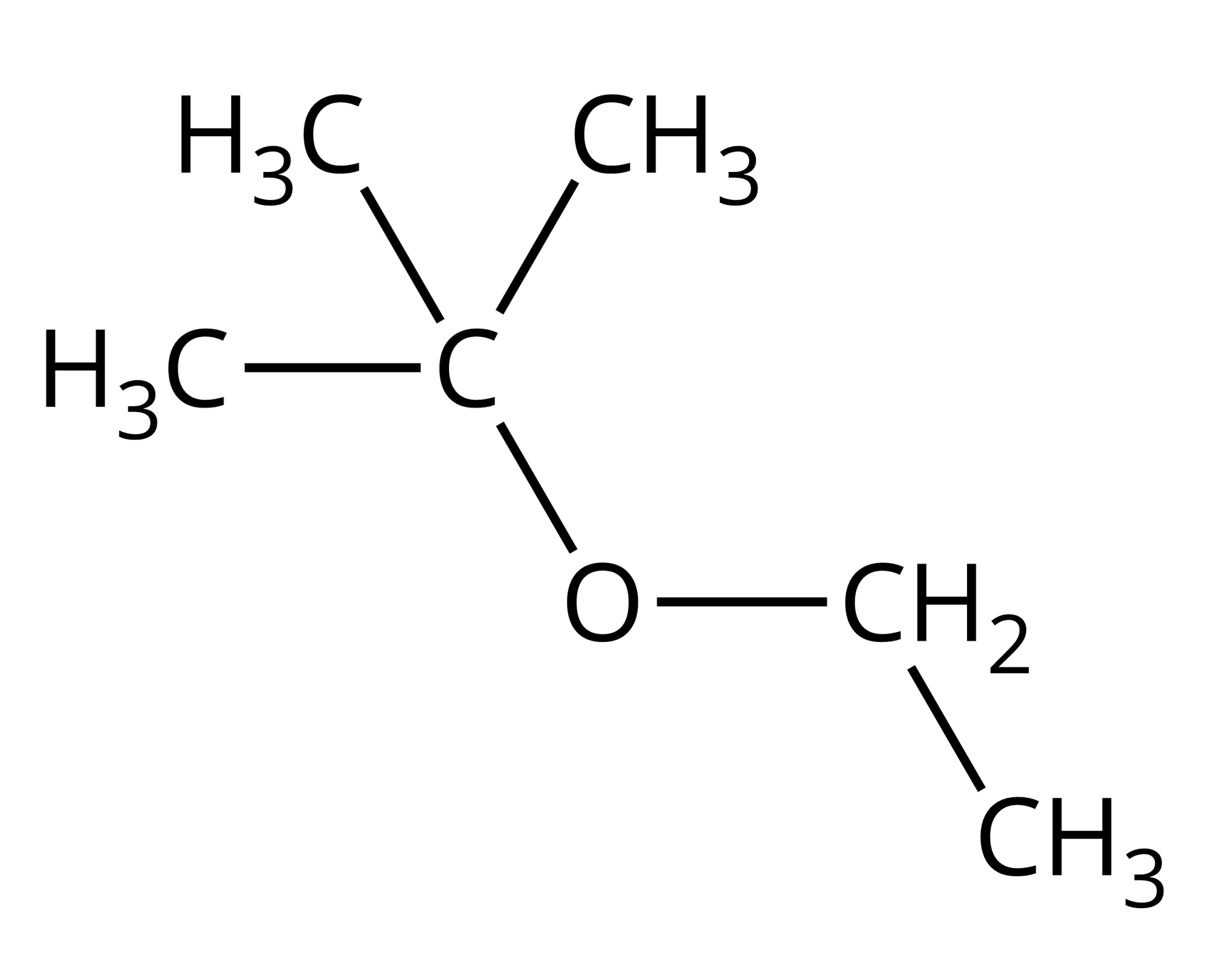 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. |
Prześledźmy teraz jedno z zadań typu maturalnego, pochodzące z Matury Próbnej z Wydziału Chemii Uniwersytetu Jagiellońskiego i Dziennika Polskiego z roku.
Oblicz liczbę oktanową mieszanki paliwowej, przygotowanej przez zmieszanie cykloheksanu – o gęstości i liczbie oktanowej – oraz heksanu – o gęstości i liczbie oktanowej . W obliczeniach pomiń proces kontrakcji objętości. Wynik napisz z dokładnością do jedności.
Krok Obliczenie objętości składników.
Aby obliczyć liczbę oktanową otrzymanej mieszaniny, musimy znać objętość każdego ze składników, użytego do przygotowania mieszaniny (w celu wyznaczenia procentu objętościowego każdego ze składników w mieszaninie). Zakładamy, że nie dochodzi do kontrakcji objętości, czyli jest ona równa sumie objętości poszczególnych składników.
Objętość każdego ze składników możemy obliczyć, wykorzystując gęstości oraz masy: cykloheksanu oraz heksanu. Zacznijmy od cykloheksanu – jego masa wynosi , a gęstość jest równa . Przekształćmy teraz wzór na gęstość w taki sposób, aby móc wyliczyć objętość.
Widzimy też, że masa została podana w gramach, a gęstość w . Trzeba więc przekształcić jednostkę gęstości w taki sposób, aby w liczniku również znajdowały się gramy. Zrobimy to, przekształcając aktualną jednostkę do . Wiemy, że to , a to .
Możemy zatem przeliczyć:
Teraz policzmy objętość cykloheksanu, korzystając z przekształconego wzoru.
cykloheksanu zajmuje objętość .
W analogiczny sposób możemy wyliczyć objętość heksanu, użytą w doświadczeniu bądź, jeśli wolimy posługiwać się proporcjami niż wzorem, zapisać:
heksanu zajmuje zatem objętość .
Całkowita objętość mieszanki to suma wyliczonych przez nas objętości cykloheksanu i heksanu:
Krok Obliczenie procentu objętościowego składników mieszaniny.
Policzmy teraz procent objętościowy każdego ze składników mieszaniny, a więc po prostu podzielmy objętość danego składnika przez sumę objętości obu składników mieszaniny.
Krok Obliczenie liczby oktanowej (LO).
Liczbę oktanową paliwa liczymy w podobny sposób, jak średnią masę atomową danego pierwiastka, znając rozpowszechnienie poszczególnych izotopów w przyrodzie. Z tym wyjątkiem, że zamiast masy atomowej danego izotopu, wstawiamy LO naszego składnika mieszaniny, mnożąc jej wartość przez odpowiedni procent objętościowy.
Słownik
paliwo syntetyczne otrzymywane w wyniku syntezy chemicznej; jej skład jest zależny od użytych surowców i metody, dzięki którym powstała
liczba będąca miarą odporności na niekontrolowany samozapłon paliwa silnikowego do silników z zapłonem iskrowym, który może powodować jego spalanie stukowe; równa procentom objętościowym zawartości izooktanu w takiej mieszaninie izooktanu i heptanu, która wywołuje identyczną liczbę stuków w silniku testowym jak analizowane paliwo
zjawisko, podczas którego zachodzi nierównomierne, wybuchowe spalanie paliw; zjawisko to występije w silnikach tłokowych o zapłonie iskrowym
dodatki chemiczne podnoszące sztucznie LO benzyny; zapobiegają występowaniu zjawiska spalania stukowego
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.