Przeczytaj
Fluor jako pierwiastek
![Ilustracja przedstawia podsumowane najważniejsze informacje dotyczące fluoru. Liczba atomów 9. Średnia liczba masowa: 18,998403. Temperatura topnienia [K] – 53,48, temperatura wrzenia [K] – 85,03. Gęstość g c m 3 : 1,696. Najczęstsze spotykane stopnie utlenienia: -I. Stan skupienia w warunkach normalnych: gaz. Konfiguracja elektronowa podpowłokowa skrócona (zawierająca rdzeń gazu szlachetnego) w stanie podstawowym: [ H e ] 2 s 2 2 p 5 .](https://static.zpe.gov.pl/portal/f/res-minimized/R1CE9VP8vfR4y/1653988159/4kksrFsV96sHMBYsgCFuiSs0MncKcUnQ.png)
Fluor jest położony w 17. grupie układu okresowego. Należy do grupy pierwiastków nazywanych halogenami lub fluorowcami (od nazwy pierwszego pierwiastka w grupie). To najmniejszy jej przedstawiciel, ponieważ jego promień atomowy wynosi 58 pm.

Fluor posiada siedem elektronów walencyjnych, które znajdują się na podpowłokach 2s i 2p. W warunkach normalnych tworzy cząsteczki homoatomowe .
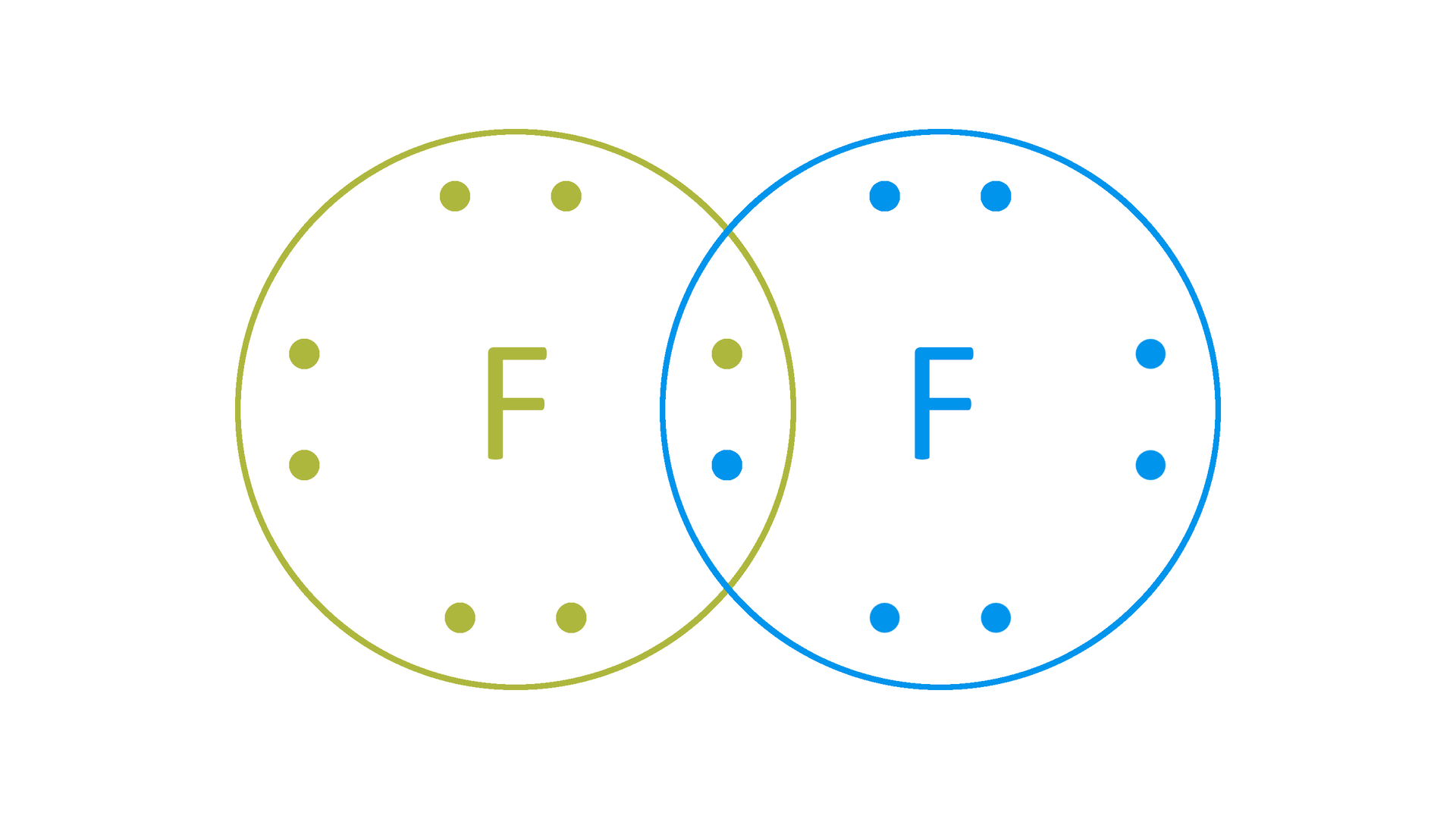
Izotopy fluoru
W przyrodzie występuje wyłącznie jeden stabilny izotop fluoru – . Pozostałe izotopy są promieniotwórcze i uzyskiwane sztucznie. Liczba masowa izotopów fluoru przyjmuje wartości od 17 do 23. Izotop wykorzystywany jest w pozytonowej emisyjnej tomografii komputerowej do znakowania glukozy.
Jakie właściwości fizyczne ma fluor?
Właściwości chemiczneWłaściwości chemiczne gazowego fluoru są bardzo specyficzne ze względu na bardzo dużą reaktywność tego gazu (reaguje on nawet z wybranymi gazami szlachetnymi).
Fluor w temperaturze pokojowej jest żółtozielonym gazem, cięższym od powietrza. Jego temperatura topnienia wynosi −219,7°C, a temperatura wrzenia jest równa −188,1°C. Z uwagi na gazowy stan skupienia, słabo przewodzi ciepło, jak również charakteryzuje się niskimi wartościami pojemności cieplnej.
Porównanie wybranych właściwości fizycznych fluorowców
symbol | nazwa | temperatura topnienia [°C] | temperatura wrzenia [°C] | stan skupienia w warunkach normalnych |
|---|---|---|---|---|
fluor | -219,7 | -188,1 | żółtozielony gaz | |
chlor | -101 | -34,04 | żółtozielony gaz | |
brom | -7,25 | 58,8 | czerwonobrunatna ciecz | |
jod | 113,6 | 185,2 | fioletowoczarne kryształy |
Indeks dolny Na podstawie Mizerski W., Tablice chemiczne, Warszawa 2008. Indeks dolny koniecNa podstawie Mizerski W., Tablice chemiczne, Warszawa 2008.
Czy fluor występuje gdzieś poza pastami do zębów?
Fluor dla większości osób kojarzy się wyłącznie z reklamami past do zębów. Mało kto wie, że znajduje się również w poli(tetrafluoroetylenie). Ów związek należy do grupy polimerów i znacznie częściej spotyka się go pod nazwą handlową TeflonIndeks górny ®®. Sprawia, że do pokrytych nim powierzchni nic nie przywiera. Jego niezwykłe właściwości wynikają z braku wolnych elektronów, które mogłyby utworzyć wiązanie m.in. z cząsteczkami żywności. Ten fakt wykorzystywany jest np. w patelniach czy naczyniach laboratoryjnych. Związkiem zawierającym fluor jest również kwas fluorowodorowy, który wykorzystuje się do trawienia szkła, np. podczas produkcji kryształowej zastawy.
Słownik
właściwości substancji, które można określić za pomocą zjawiska fizycznego, np. temperatura wrzenia oraz rozpuszczalność
właściwości substancji, które można zaobserwować podczas reakcji chemicznej, ale też toksyczność, palność czy reaktywność
metoda matowienia szkła przy użyciu kwasu fluorowodorowego; kwas wytrawia miejsca nieosłonięte powłoką ochronną, po jej usunięciu na szkle pozostaje matowa dekoracja; proces ten przebiega zgodnie z równaniem reakcji:
poli(tetrafluoroetylen), syntetyczny fluoropolimer o strukturze meru:
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa 2018.
Bielański A., Podstawy chemii nieorganicznej 2, Warszawa 2013, wyd. 6.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 335‑346.
Emsley J., Chemia. Przewodnik po pierwiastkach, Warszawa 1997, s. 70‑71.
Kałuża B., Kamińska F., Chemia. Podręcznik. Zakres rozszerzony, cz. 1, Warszawa 2013, s. 298‑299.
Waselowsky K., 225 doświadczeń chemicznych, Warszawa 1987, s. 51.


