Przeczytaj
Cień rzucony przez cząsteczkę

Wybitny niemiecki chemik, Emil Fischer, pod koniec wieku zaproponował rodzaj projekcji chemicznej, która umożliwiła prezentację cząsteczki na płaszczyźnie. Wprowadzony wzór projekcyjny (rzutowy) w sposób jednoznaczny opisywał kształt przestrzenny cząsteczki. Taki sposób przedstawiania cząsteczki nazwano projekcją Fischeraprojekcją Fischera – od nazwiska autora. Wzory projekcyjne (rzutowe) są stosowane dla cząsteczek, które zawierają atom asymetrycznyatom asymetryczny (tzw. centrum chiralności, atom chiralny). Co ważne, wzory projekcyjne pozwalają przekazać cenne informacje stereochemiczne bez konieczności rysowania wzorów trójwymiarowych cząsteczki. Obecnie projekcje Fischera są najczęściej używane do reprezentowania wzorów cukrów lub aminokwasów.
Jednym z bardziej znanych aldehydów z grupy aldoz jest aldehyd glicerynowy. Związek ten posiada jeden atom asymetryczny. Aby narysować wzór Fischera tego związku, cząsteczkę należy ustawić tak, aby dwa wiązania (spośród wiązań które tworzy centrum chiralne) ułożone były poziomo, a pozostałe dwa – pionowo. Co istotne, główny łańcuch węglowy umieszcza się w linii pionowej, a w poziomie podstawniki.
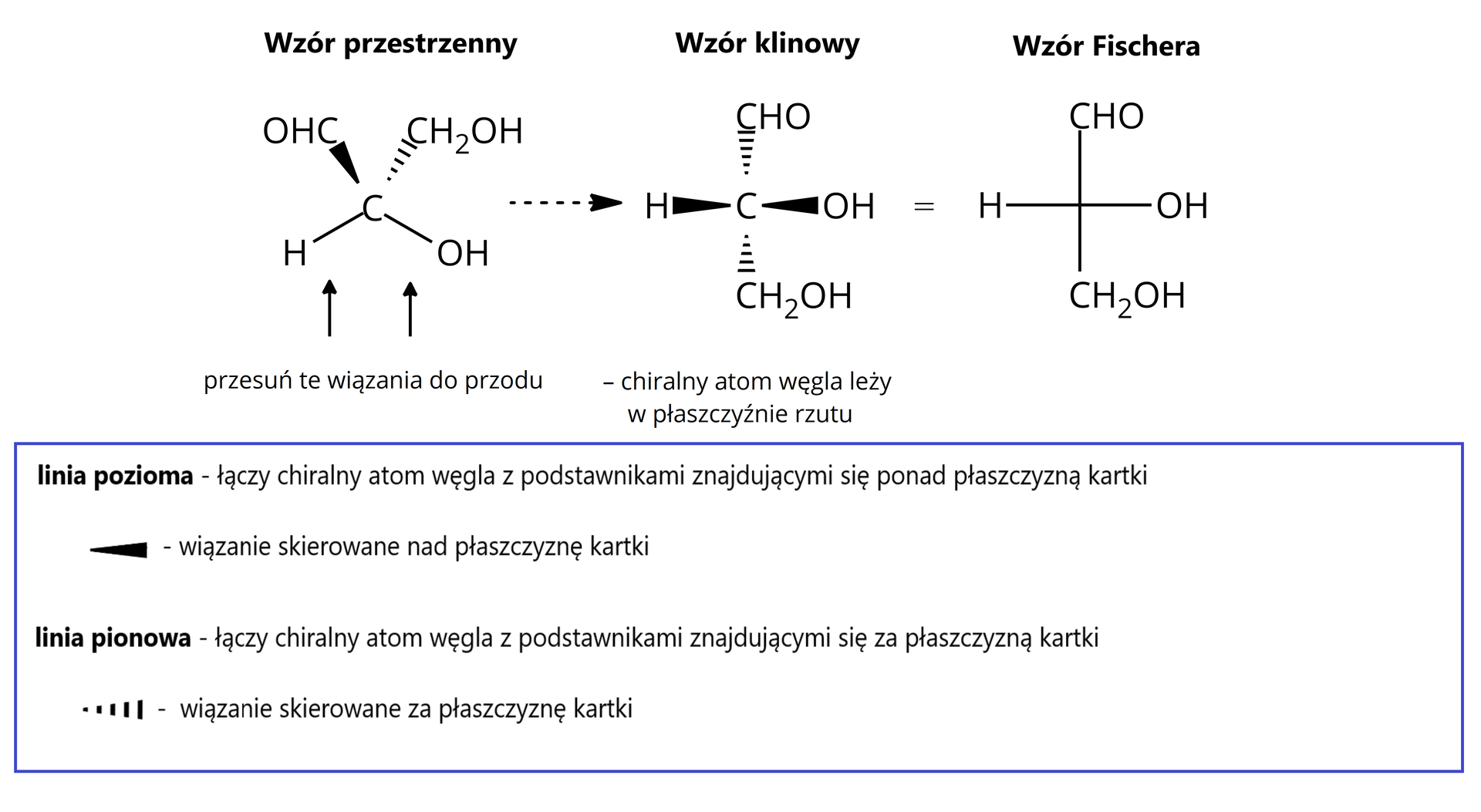
Aby zrozumieć jak powstaje wzór projekcyjny Fischera, spójrzmy na rysunek poniżej. Z rysunku wynika, że wzór projekcyjny to nic innego, jak cień cząsteczki otrzymany na skutek oświetlenia jej od przodu. Wzór Fischera otrzymany na płaszczyźnie reprezentowany jest przez krzyżujące się wiązania, a w punkcie ich przecięcia znajdują się atomy węgla.

Określanie konfiguracji absolutnej we wzorach Fischera
Aby ustalić konfigurację absolutnąkonfigurację absolutną wokół danego atomu asymetrycznego, należy zastosować następujące zasady:
Ustalamy pierwszeństwo podstawników wokół asymterycznego atomu.
Cząsteczkę ustawiamy w taki sposób, by podstawnik o najniższym pierwszeństwie znalazł się jak najdalej od obserwatora.
Obserwujemy atom asymetryczny od strony przeciwnej do podstawnika zaszeregowanego jako ostatni (najmniej ważny).
Określamy sposób przejścia po podstawnikach wokół asymetrycznego atomu, przemieszczając się od podstawnika o najwyższym pierwszeństwie do podstawnika o najniższym pierwszeństwie. Gdy:
przejście odbywa się zgodnie z ruchem wskazówek zegara, to konfiguracja absolutna jest oznaczana literą R (od łac. rectus – prawy);
przejście odbywa się przeciwnie do ruchu wskazówek zegara, to konfiguracja absolutna oznaczana jest literą S (od łac. sinister – lewy).
Co ważne, oznaczenia R, S można przypisać do dowolnego centrum stereogenicznego narysowanego we wzorze Fischera. Jeżeli cząsteczka posiada kilka atomów asymetrycznych, to możliwe jest istnienie większej liczby stereoizomerówstereoizomerów, przy czym atomy asymetryczne mogą mieć taką samą lub przeciwną konfigurację absolutną. W takim przypadku, konfigurację R i S wyznacza się oddzielnie dla każdego asymetrycznego atomu w cząsteczce.
W celu wyznaczenia liczby możliwych stereoizomerówstereoizomerów, należy skorzystać z poniższej reguły:
Maksymalna liczba stereoizomerów wynosi , gdzie to liczba atomów asymterycznych (centrów chiralności).
Przykład:
Jeżeli cząsteczka posiada trzy asymetryczne atomy węgla, to maksymalna liczba stereoizomerów wynosi czyli .
Wzór ten znajduje zastosowanie dla cząsteczek posiadających nierównocenne chiralne atomy, czyli takich, w których zestawy podstawników przy obu asymetrycznych atomach są różne. Jeżeli jednak są one identyczne, wówczas takie atomy noszą nazwę równocennych.
Pierwszeństwo podstawników określa się stosując reguły Cahna-Ingolda-Preloga:
Atomy o wyższych liczbach atomowych () mają pierwszeństwo przed atomami, których liczby atomowe są niższe. Gdy mamy do czynienia z izotopami pierwiastków, o pierwszeństwie decyduje wyższa liczba masowa, np.:
Jeżeli zastosowanie pierwszej reguły nie pozwala na uporządkowanie podstawników, wówczas rozpatruje się sumę liczb atomowych drugich, trzecich lub dalszych atomów (przyłączonych do asymetrycznego atomu), aż do zróżnicowania wartości sumy liczb atomowych.
Gdy z atomem asymetrycznym (centrum chiralności) połączone są atomy węgla związane z tlenem, wówczas pierwszeństwo ma grupa o wyższym stopniu utlenienia, np.:
Grupa ma pierwszeństwo przed grupą .
Atomy, które przyłączone są do atomu węgla wiązaniem wielokrotnym, są równoważne z odpowiednią liczbą atomów, połączonych wiązaniami pojedynczymi. Wówczas krotność wiązania należy pomnożyć przez liczbę atomową rozpatrywanego atomu.
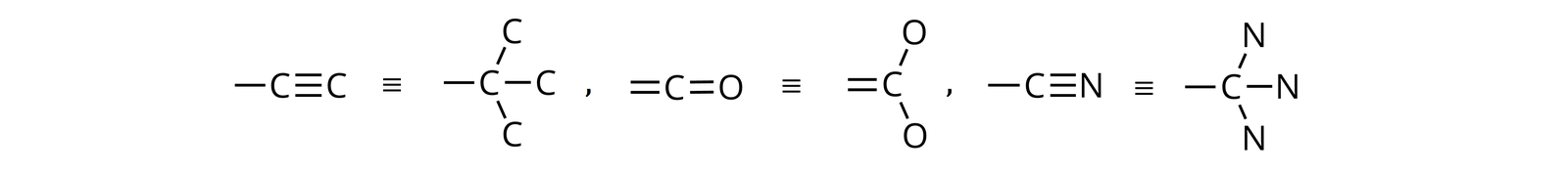
Określanie konfiguracji absolutnej cząsteczki zawierającej jeden atom asymetryczny
Określanie konfiguracji absolutnej -bromopropan--olu o podanym wzorze rzutowym.
Kierunek | Konfiguracja absolutna |
Zgodny z ruchem wskazówek zegara | R |
Przeciwny do ruchu wskazówek zegara | S |
Wzór rzutowy Fischera nie może być obracany na płaszczyźnie, ponieważ na skutek obrotu można otrzymać strukturę innej cząsteczki niż zakładamy. Obrót rzutu Fischera o w dowolnym kierunku zmienia konfigurację absolutną w centrum chiralnym.

Natomiast obrót o lub nie zmienia konfiguracji absolutnej centrum chiralności.
Słownik
(centrum stereogeniczne, centrum chiralności) atom związany z czterema różnymi podstawnikami
(łac. configuratio „ukształtowanie”, „porównanie”) sposób rozróżniania i nazewnictwa izomerów optycznych na podstawie rozmieszczania podstawników wokół chiralnego atomu węgla
przedstawienie trójwymiarowych konfiguracji wokół chiralnych atomów węgla w cząsteczce na płaszczyźnie
izomery przestrzenne, które różnią się ułożeniem atomów w przestrzeni; klasyfikuje się je na kilka sposobów; mogą to być: konformery (cząsteczki przechodzące wzajemnie w siebie przez obrót wokół pojedynczych wiązań), izomery konfiguracyjne (cząsteczki nie przechodzące wzajemnie w siebie przez obrót, ale przez zerwanie i odtworzenie wiązań ), izomery optyczne (należą do nich enancjomery i diastereoziomery)
Bibliografia
Encyklopedia PWN
Gorzynski Smith J., Organic Chemistry, Third Edition, New York 2011.
Hejwowska S., Marcinkowski R., Staluszka J., Chemia 2. Zakres rozszerzony, Gdynia 2011.
Kołodziejczyk A., Naturalne związki organiczne, Warszawa 2013.
Litwin M., Styka‑Wlazło Sz., Szymońska J., Chemia Ogólna i nieorganiczna, Warszawa 2005.
Saunders N., Saunders A., Clinton S., Parsonage M., Poole E., AS Chemistry for AQA, Oxford 2007.