Przeczytaj
Czym są kryształy molekularne?
yształy molekularne tworzą osobne zbiory cząsteczek. Co to właściwie oznacza? W kryształach molekularnych zbiory cząsteczek są połączone słabymi oddziaływaniami. Siłami „sklejającymi” cząsteczki w krysztale mogą być siły m.in.:
siły Van der Waalsasiły Van der Waalsa;
wiązania wodorowewiązania wodorowe.
Przykładem kryształu molekularnego może być siarka. Siarka w temperaturze pokojowej tworzy pierścienie, w których znajduje się osiem atomów siarki (). Pierścienie siarki oddziałują ze sobą dzięki siłom Van der Waalsa. Struktury siarki przedstawiono w galerii poniżej.
Jak widać, w komórce elementarnejkomórce elementarnej poszczególne pierścienie siarki nie są ze sobą połączone. Tworzą osobne cząsteczki, dlatego siarkę powinno się zapisywać jako cząsteczkę . Gdyby siarka tworzyła kryształy kowalencyjne, pierścienie te musiałyby być połączone wiązaniem – tak, jak ma to chociażby miejsce w krysztale diamentu, gdzie wszystkie atomy węgla są ze sobą połączone. Takie same połączenia, jak w krysztale siarki, występują m.in. w fosforze białym , w którym fosfor tworzy tetraedrycznetetraedryczne cząsteczki .

Przykładem najprostszego kryształu molekularnego, w którym występują wiązania wodorowe, jest cząsteczka lodu, co możesz zobaczyć na poniższych modelach.
W strukturze krystalicznej cząsteczki wody tworzą sieć wiązań wodorowych. Cząsteczka wody jest donorem i akceptorem dwóch wiązań wodorowych. Można zauważyć, że struktura lodu nie jest gęsto upakowana, a odległości między cząsteczkami są dość duże. Dzięki temu woda, przechodząc w stan stały (lód), zwiększa swoją objętość, a podczas topnienia ją zmniejsza.
Jakie oddziaływania występują w kryształach molekularnych?
Struktury krystaliczne związków organicznych są bardziej skomplikowane w interpretacji. W większości z nich występuje kilka oddziaływań międzycząsteczkowych. Oprócz oddziaływań dyspersyjnych, wiązań wodorowych, możemy wyróżnić takie oddziaływania, jak:
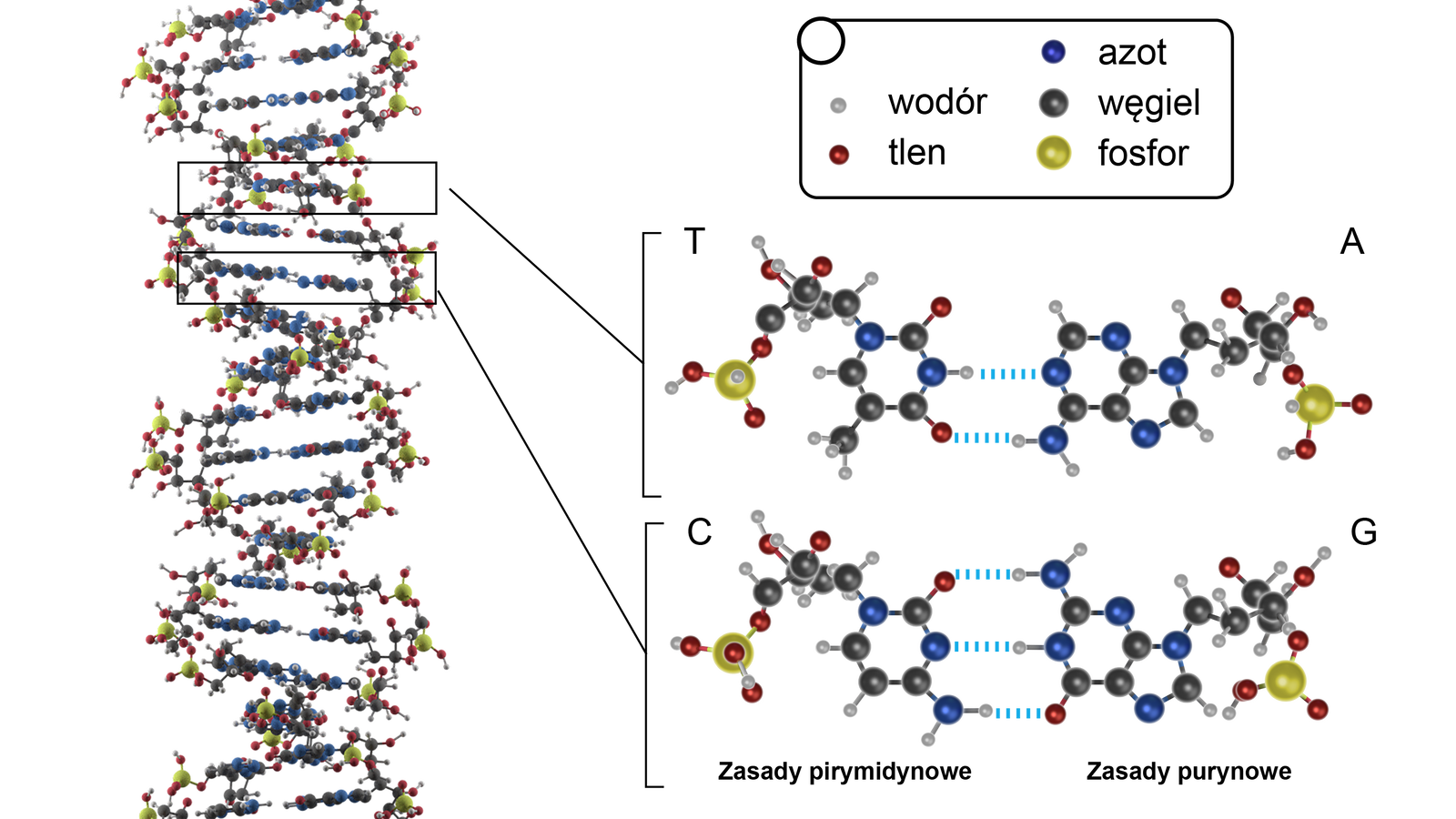
DNA jako kryształ molekularny
Jednym z ważniejszych osiągnięć nauki w w. było rozwiązanie struktury krystalicznej DNADNA – kryształu molekularnego. Na niżej zamieszczonych zdjęciach zostali ukazani naukowcy, którzy przyczynili się do odkrycia struktury krystalicznej DNA, za co otrzymali Nagrodę Nobla w r. Warto również wspomnieć o współudziale Rosalindy Franklin w tym odkryciu, autorki rentgenogramu sodowej soli DNA.
DNA – kwas deoksyrybonukleinowy – jest wielkocząsteczkowym związkiem organicznym i pełni rolę nośnika informacji genetycznej. W strukturze DNA możemy m.in. wyróżnić oddziaływania wodorowe – między zasadami azotowymi – czy oddziaływania stakingoweoddziaływania stakingowe między sąsiednimi nukleotydaminukleotydami DNA, które dodatkowo stabilizują strukturę.
Inne przykłady
Innymi przykładami substancji, które tworzą kryształy molekularne, są gazy szlachetnegazy szlachetne: (neon), (argon), cząsteczki dwuatomowe, takie jak (wodór), (tlenek węgla()), (azot). Jednak najliczniejszą grupą związków, tworzącą kryształy molekularne, są związki organiczne.
Z racji tego, że kryształy molekularne są zbudowane z odrębnych cząsteczek, struktury krystaliczne związków stabilizowane są przez słabsze oddziaływania międzycząsteczkowe. Kryształy molekularne charakteryzuje niska temperatura topnienia. Są to kryształy kruche, które nie przewodzą prądu elektrycznego.
Słownik
słabe oddziaływania międzycząsteczkowe, związane z kwantową naturą powłok elektronowych, elektrycznie obojętnych atomów lub cząsteczek oraz z ruchem elektronów w cząsteczce
rodzaj oddziaływania elektrostatycznego pomiędzy atomem wodoru a atomem pierwiastka elektroujemnego o wolnych parach elektronowych; to oddziaływanie może być międzycząsteczkowe lub wewnątrzcząsteczkowe
kwas deoksyrybonukleinowy; wielkocząsteczkowy biopolimer obecny we wszystkich komórkach organizmów, w których jest nośnikiem informacji genetycznej
(gr. di- „dwa razy”, gr. pólos „biegun”) ten typ oddziaływania występuje między dwoma cząsteczkami, które w jednym fragmencie cząsteczki posiadają nadmiar elektronów, dlatego występuje na nich częściowy ładunek ujemny, a w drugim fragmencie występuje deficyt elektronów, co prowadzi do powstania w tym miejscu częściowego ładunku dodatniego
helowce; pierwiastki chemiczne, które tworzą grupę układu okresowego: hel (), neon (), argon (), krypton (), ksenon () i radon ()
równoległościan, który stanowi podstawowy, powtarzający się okresowo w przestrzeni element sieci przestrzennej; kształt i rozmiary komórki elementarnej określają stałe sieciowe: długości krawędzi: , , , i kąty: , , między nimi
(gr. tetrakys „czterokrotnie”) czworościan foremny

oddziaływanie , słabe oddziaływanie chmury elektronowej między pierścieniami aromatycznymi
(łac. arōma, -ătis „przyprawa”) związki wykazują aromatyczność, kiedy są płaskie – powstają w wyniku sprzężenia się wiązań podwójnych; najprostszym związkiem organicznym jest benzen
estry nukleozydów i kwasu ortofosforowego(V); w nukleozydach reszta hydroksylowa () części cukrowej jest połączona z cząsteczką kwasu ortofosforowego() wiązaniem estrowym; stanowią składniki kwasów nukleinowych (DNA i RNA), niezbędne są też w metabolizmie i przekazywaniu sygnałów w komórce
Bibliografia
Bernal J. D., Fowler R. H., A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions, „The Journal of Chemical Physics” 1933, 1, p. 515.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2007.
Borchardt‑Ott W., Crystallography an intoduction, Third Edition, w York 2011.
Encyklopedia PWN
Rettig S. J., Trotter J., Refinement of the structure of orthorhombic sulfur, alfa‑S8, „Acta Crystallographica” 1987, pp. 2260‑2262.
Simon A., Borrmann H., Craubner H., Phosphorus and Sulfur and the Related Elements, Crystal structure of ordered white phosphorus (beta‑P)1987, 30, p. 507‑510.
Wyckoff R. W., Crystal G., Structures 1, Second Edition, New York 1963, 1, p. 7‑83.
Van Meerssche M., Feneau‑Dupont J., Krystalografia i chemia strukturalna Warszawa 1984.






