Przeczytaj
Do czego odnosi się pojęcie „korozja”?
Pojęcie „korozja” jest stosowane w odniesieniu do niszczenia struktury:
metali – mechanizm elektrochemiczny lub chemiczny;
materiałów niemetalicznych, np. betonu i żelbetu – chemiczne i fizykochemiczne niszczenie spoiwa i kruszywa, elektrochemiczna korozja zbrojenia;
drewna (zgnilizna korozyjna drewna) – procesy mikrobiologiczne i chemiczne;
skał, szkła, tworzyw sztucznych – topnienie, rozpuszczanie, ługowanie.
Rodzaje korozji metali
W zależności od rodzaju środowiska, wyróżniamy kilka typów korozji.
Korozja chemiczna
Zachodzi w suchych gazach, przy wysokich temperaturach oraz w cieczach, które nie są elektrolitami, jak np. ropa naftowa, benzen, fenol (niszczenie łopatek turbin w zetknięciu z gorącymi gazami spalinowymi, korozja zbiorników, przewodów, powodowana działaniem gazów: , , , ).
Przykładem korozji chemicznej jest czernienie srebra:
Korozja elektrochemiczna
Korozja elektrochemiczna powstaje wskutek działania krótko zwartych ogniw na styku metalu z elektrolitem. Ogniwa te powstają w rezultacie niejednorodności chemicznej (lub fizycznej) metalu – np. na styku różnych metali bądź z powodu niejednorodności krystalicznej w strukturze metalu.
Korozja metali to proces spowodowany różnymi czynnikami. Największe straty gospodarcze przynosi elektrochemiczna odmiana korozji. Niszczy ona stopystopy żelaza (czystego żelaza, które koroduje stosunkowo powoli, nie używa się jako materiału konstrukcyjnego). Stopy żelazaStopy żelaza, różne gatunki stali i żeliwa zawierają dodatek grafitu. Kryształy grafitu, a także kryształy cementytucementytu () tworzą z żelazem mikroogniwa galwaniczne. W obecności elektrolitu (woda wraz z rozpuszczonymi gazami i solami), powodującego zamknięcie obwodu, zaczynają zachodzić niekorzystne procesy korozyjne.
Żelazo w mikoroogniwie jest zawsze anodą (elektrodą ujemną), natomiast grafit lub cementyt, które mają wyższe potencjały niż żelazo, są katodami (elektrodami dodatnimi).
Na anodzie żelazo ulega utlenieniu.
Anoda (-):
Na katodzie redukcji ulega tlen rozpuszczony w wodzie.
Katoda (+): lub
Sumarycznie równanie reakcji wygląda następująco:
Wodorotlenek żelaza(II) ulega utlenieniu pod wpływem tlenu atmosferycznego do połączeń żelaza(III) o brunatnym zabarwieniu, czyli rdzy:
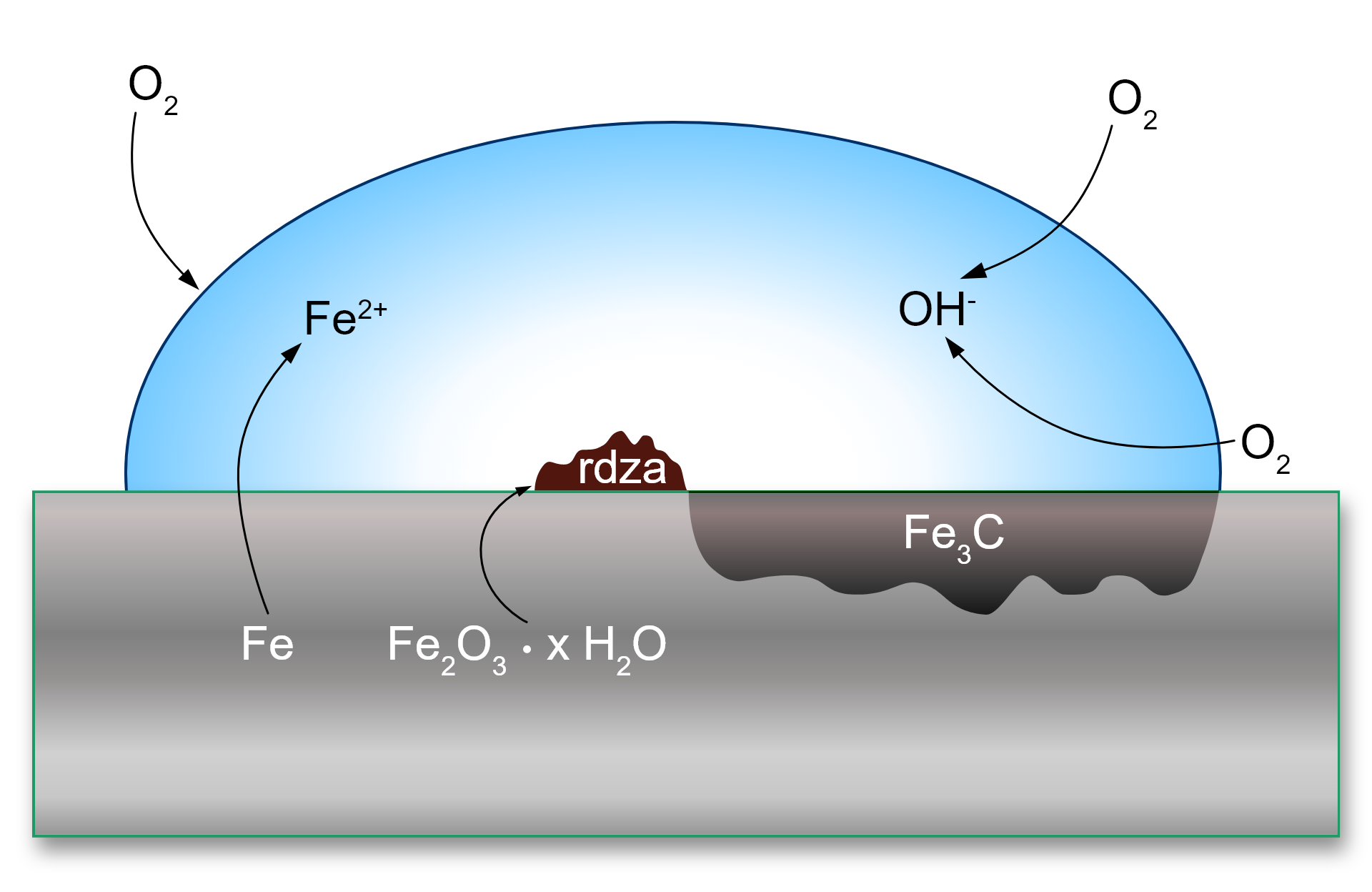
W zależności od rodzaju i charakteru zniszczenia korozyjnego, rozróżnia się:
Słownik
substancja składająca się z dwóch lub więcej pierwiastków chemicznych, z których co najmniej jeden, ale występujący w przeważającej ilości, jest metalem
stopy, których głównym składnikiem jest żelazo, a dodatkami stopowymi są różne pierwiastki metaliczne i niemetaliczne
węglik żelaza ; składnik strukturalny wielu stopów żelaza
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.
Bogdańska Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich, Warszawa 1995.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka–Wlazło Sz., Szymońska J., Chemia ogólna i nieorganiczna, Warszawa 2002.
Pazdro K. M., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Warszawa 2009.
Surowska B., Wybrane zagadnienia z korozji i ochrony przed korozją, Lublin 2002.