Przeczytaj
Teorie o budowie atomu
Na temat budowy materii dyskutowali już starożytni greccy filozofowie. Do najbardziej trafnych stwierdzeń w tamtych czasach należały wnioski Leucippusa i Demokryta, którzy głosili, że cała materia składa się z małych, skończonych cząstek. Dali im nazwę a–tomos, co w języku greckim oznacza „niepodzielny”. Według nich miały to być poruszające się cząstki o różnych kształtach i rozmiarach, z możliwością łączenia się.
Z kolei Arystoteles głosił inną teorię, opartą o istnienie czterech żywiołów. W myśl tej teorii cała materia znana ludziom miała być tworzona z różnych kombinacji ognia, ziemi, powietrza i wody, a co więcej, mogła być nieskończenie dzielona.
Powyższe teorie były tworzone przez filozofów i nie opierały się na doświadczeniach, lecz na obserwacjach przemian fizycznych zachodzących w przyrodzie – mowa tu np. o topnieniu, parowaniu, skraplaniu czy krzepnięciu.
Budowa atomu wg Johna Daltona
Teoria atomistyczna Johna Daltona to pierwsza próba zbudowania logicznego opisu materii, oparta na dwóch prawach:
Zachowania masy
Masa substratów w reakcji chemicznej jest równa masie otrzymanych produktów.
Prawo to sformułowali niezależnie od siebie dwaj uczeni: Michaił Łomonosow () oraz Antoine Lavoisier ().
Stałości składu Prousta
Różne próbki tego samego związku chemicznego zawierają składniki pierwiastkowe w jednakowych proporcjach.
Prawo to sformułowane zostało przez Josepha Louisa Prousta w roku.

Teoria atomistyczna została opublikowana w roku, a wiele jej postulatów jest aktualnych we współczesnej teorii atomu. Hipotezy, jakie wyciągnął Dalton, są następujące:
materia jest zbudowana z bardzo małych cząstek, które zwane są atomamiatomami; atom stanowi najmniejszą jednostkę pierwiastka i jest niepodzielny;
pierwiastek to zbiór jednego rodzaju atomów, które mają charakterystyczną dla tego pierwiastka masę i jest ona taka sama dla wszystkich atomów tego pierwiastka; makroskopowa próbka danego pierwiastka zawiera bardzo dużą liczbę atomów, z których wszystkie mają identyczne właściwości chemiczne;
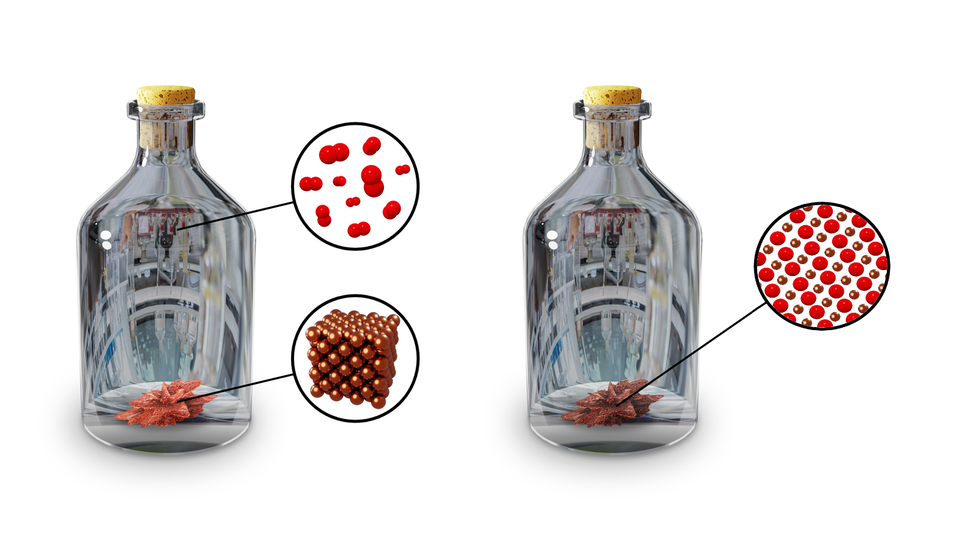
R17gyZnxi4ptS  Miedziana moneta o masie ok. zawiera około atomów miedzi. Organizacja atomów miedzi została zobrazowana po prawej stronie.Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0.
Miedziana moneta o masie ok. zawiera około atomów miedzi. Organizacja atomów miedzi została zobrazowana po prawej stronie.Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0.atomy jednego pierwiastka mają różne właściwości od atomów innych pierwiastków;
związek chemiczny zbudowany jest z atomów dwóch lub więcej pierwiastków, które, w przypadku danego związku chemicznego, połączone są ze sobą zawsze w tych samych stosunkach liczb całkowitych;
R5ctqOW4gJb5b  Tlenek miedzi() jest związkiem, który powstaje w wyniku połączenia kationów miedzi (brązowe kule) oraz anionów tlenkowych (czerwone kule) – w stałym stosunku .Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0.
Tlenek miedzi() jest związkiem, który powstaje w wyniku połączenia kationów miedzi (brązowe kule) oraz anionów tlenkowych (czerwone kule) – w stałym stosunku .Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0.w czasie tworzenia związków chemicznych atomy nie ulegają zniszczeniu ani też ponownemu tworzeniu, lecz są odpowiednio przeorganizowane w celu utworzenia nowych substancji.
Ponadto Dalton, jako konsekwencję swojej teorii atomistycznej, sformułował jedno z podstawowych praw stechiometrycznych – prawo stosunków wielokrotnych.
Stosunki wielokrotne
Jeśli dwa pierwiastki chemiczne mogą się łączyć z utworzeniem różnych związków chemicznych, to stała masa jednego pierwiastka będzie reagować z masami drugiego pierwiastka w stosunku małych liczb całkowitych.
Miedź i chlor tworzą zielony krystaliczny chlorek miedzi() oraz brązowy krystaliczny chlorek miedzi(). Stosunek masowy w pierwszym związku to chloru do miedzi, a w drugim chloru do miedzi. Chociaż podane liczby wydawać się mogą przypadkowe, to jednak ich wzajemny stosunek daje zaskakujący i użyteczny wynik małych liczb całkowitych.
Odkrycie Josepha Thomsona
Czy John Dalton był nieomylny w swoich postulatach? Dziś wiemy, że jego teoria nie była całkowicie słuszna. Otóż atomy nie tyle są niepodzielne, co po prostu zbudowane z mniejszych elementów, jakimi są jadra atomowejadra atomowe i elektronyelektrony.
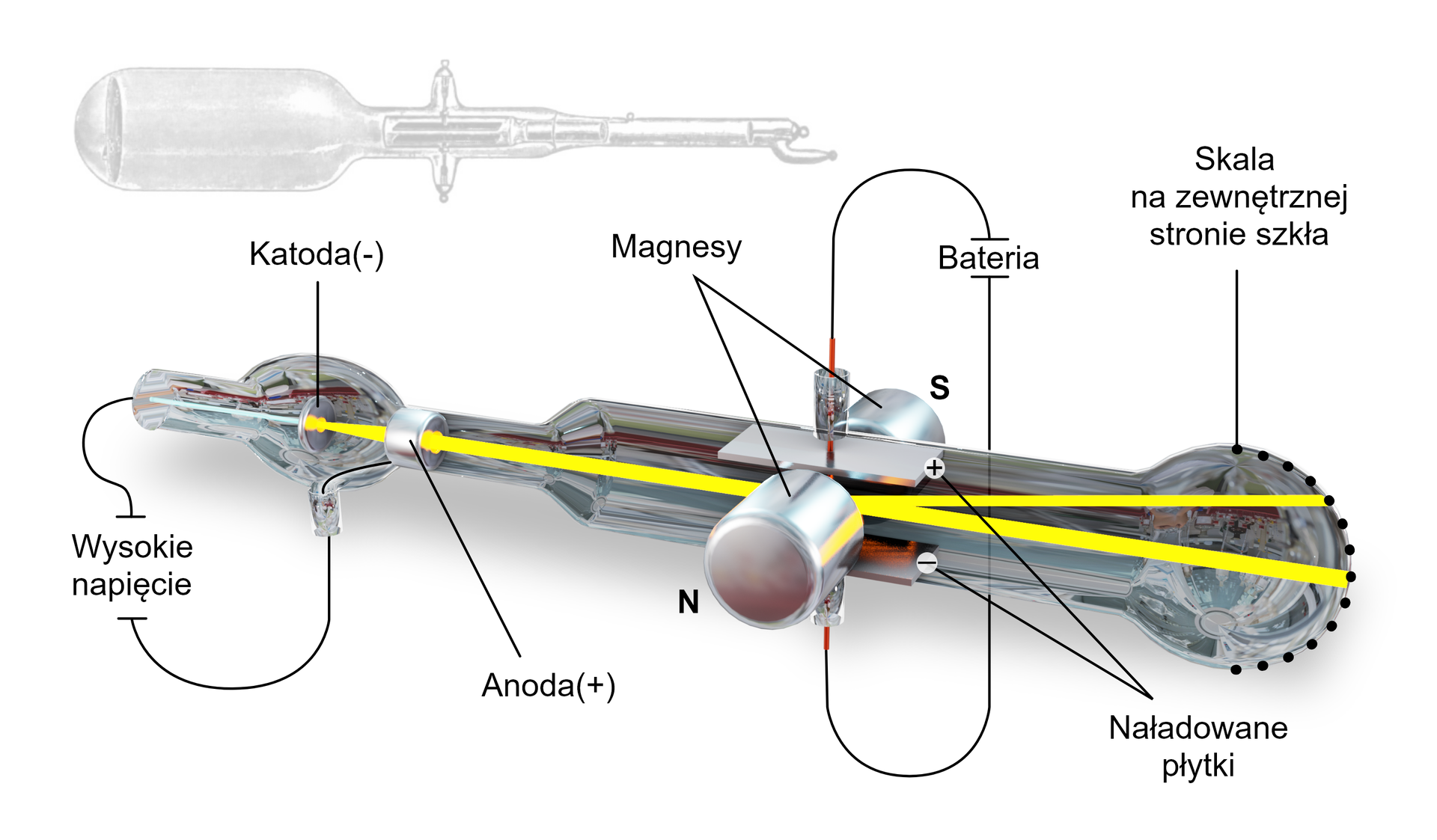
Informacji na ten temat dostarczyli naukowcy, którzy w wieku zgłębiali wiedzę na temat atomów. Jednym z najbardziej znaczących fenomenów ówczesnego wieku było odkrycie elektronu przez angielskiego fizyka Josepha Thomsona. Dokonał tego przy użyciu lampy katodowej, składającej się z zamkniętej szklanej rurki z dwoma metalowymi elektrodami we wnętrzu. Z elektrody zostało usunięte prawie całe powietrze, a potem przyłożono wysokie napięcie, które spowodowało pojawienie się widzialnej wiązki, zwanej promieniowaniem katodowym. Wspomniana wiązka została odchylona w kierunku ładunku dodatniego i oddalona od ładunku ujemnego (niezależnie od metalu tworzącego elektrody). Na podstawie swojego eksperymentu, Thomson obliczył stosunek masy do ładunku cząstek tworzących promień katodowy () i wysunął wnioski o istnieniu ujemnie naładowanych, subatomowych składników wszystkich atomów – elektronów.
Ku poznaniu budowy atomu
W roku amerykański fizyk Robert A. Millikan, poddając krople oleju działaniu promieni rentgenowskich (ładując je elektrycznie), wyznaczył ładunek pojedynczego elektronu ().
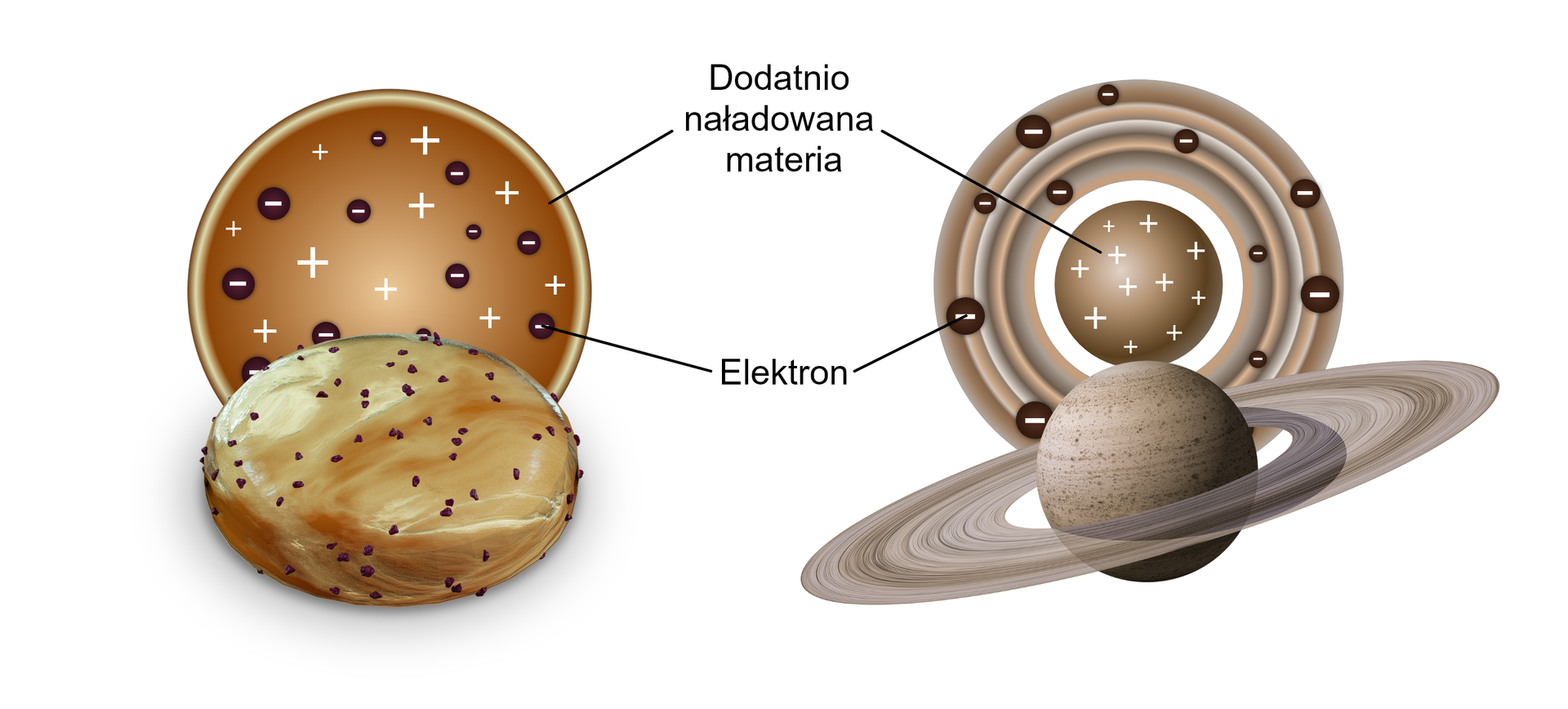
Kolejnym znaczącym krokiem w zrozumieniu budowy atomu było odkrycie, jakiego dokonał brytyjski fizyk Ernest Rutherford. Otóż wykorzystując wiązkę szybkich, dodatnio naładowanych cząstek alfa (otrzymanych w wyniku rozpadu promieniotwórczego radu), skierował je na cienką złotą folię i dzięki badaniu ich rozproszenia, za pomocą luminescencyjnego ekranu, odkrył, że atom zawiera dodatnio naładowane jądro. W modelu atomu Rutherforda bardzo małe dodatnio naładowane jądro, zawiera większość masy atomu, a wokół jądra krążą ujemnie naładowane elektrony.

Jego model jest czasami nazywany planetarnym modelem atomu. Zachowanie elektronów w atomie porównywano bowiem do zachowania planet krążących wokół Słońca. Chociaż planety są przyciągane przez Słońce siłą grawitacyjną, poruszają się z wystarczającą energią, aby pozostać na stabilnych orbitach wokół Słońca. Mogłoby się wydawać, że elektrony zachowują się w ten sam sposób. Model ten nie wyjaśniał jednak, dlaczego atomy emitują promieniowanie tylko o określonych częstotliwościach. Dopiero inne ważne odkrycia wieku pozwoliły na uzupełnienie szczegółów dotyczących budowy i zachowania atomu.
W roku Niels Bohr, opierając się na teorii Alberta Einsteina i Maxa Plancka, zaproponował nowy model budowy atomu, w którym elektrony krążą po torach zwanych orbitami stacjonarnymi. Według postulatów ogłoszonych przez naukowca:
elektrony poruszające się po danej orbicie posiadają określoną energię;
przejściu elektronu z jednego poziomu na inny poziom towarzyszy emisja lub pochłonięcie takiej porcji energii, która jest równoważna różnicy energii pomiędzy poziomami.

Ze schematu wynika, że elektrony krążące po powłoce znajdującej się najbliżej jądra mają najniższą energię, a energia elektronu rośnie w miarę oddalania się od jądra. Ponadto różnice energii elektronów z kolejnych powłok są, w miarę wzrostu numeru powłoki, coraz mniejsze.
Niestety, model przyjęty przez Bohra nie mógł być z powodzeniem zastosowany dla atomów wieloelektronowych, ponieważ w odróżnieniu od drobin posiadających jeden elektron (np. wodór, zjonizowany atom helu, dwukrotnie zjonizowany atom litu) wyniki eksperymentalne odbiegały od założeń teoretycznych. Rozbieżności te były tym większe, im więcej elektronów zawierał badany atom. Model ten stanowił jednak ważny etap na drodze do poznania budowy atomu.
W roku austriacki fizyk Erwin Schrödinger wykorzystał dualizm korpuskularno‑falowydualizm korpuskularno‑falowy elektronu w celu opracowania i rozwiązania złożonego równania matematycznego, które dokładnie opisało zachowanie elektronu w atomie wodoru. Opierając się na koncepcji de Broglie'a, że cząstki mogą wykazywać charakter falowy fal, Schrödinger wysunął teorię, że zachowanie elektronów w atomach można wyjaśnić, traktując je matematycznie jako fale materii.
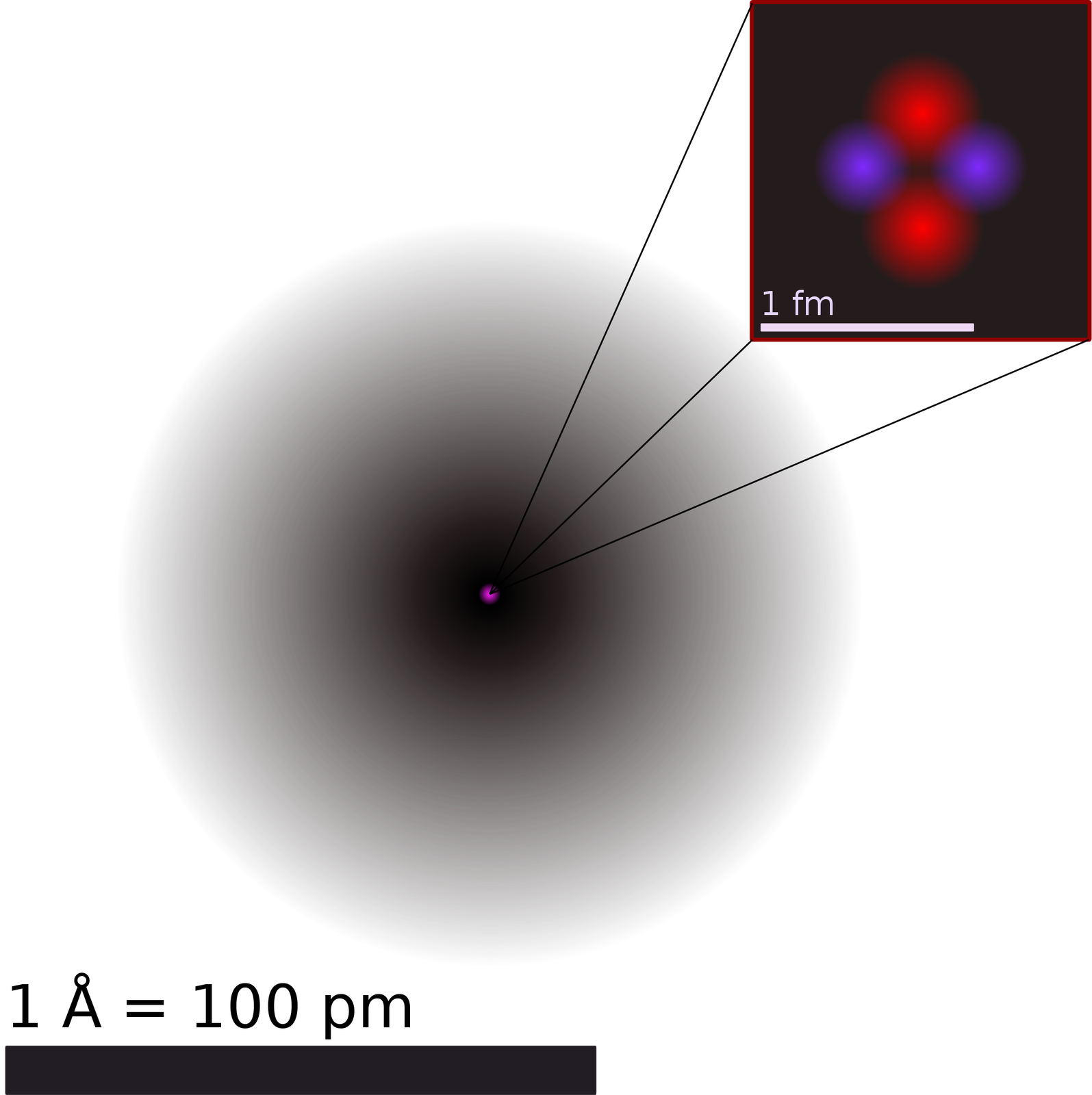
Z rozwiązania równania falowego dla atomu wodoru naukowiec uzyskał funkcje falowe nazywane orbitalamiorbitalami atomowymi określające prawdopodobieństwo znalezienia elektronu w danym punkcie wokół jądra, a także wartości energii elektronu związanego w atomie. Otrzymane wartości energii były identyczne z założeniami modelu Bohra i wartościami obserwowalnymi przez niego doświadczalnie. Wynik ten stanowił pierwszą weryfikację teorii Schrödingera.
Na tej podstawie powstał kwantowo–mechaniczny model atomu, w którym jądro atomowe jest otoczone przez chmurę gęstości elektronowej. W chmurze tej nie można dokładnie określić, gdzie znajdują się elektrony, natomiast wiadomo, że prawdopodobnie można je znaleźć w danych regionach przestrzeni zwanych orbitalami.
Obecnie przyjęty kwantowo–mechaniczny model atomu uznawany jako najbardziej „realistyczny” opiera się na szeregu założeń naukowych, takich jak:
Dualizm korpuskularno–falowy – zgodnie z hipotezą de de Broglie’a wszystkie cząstki można postrzegać jako fale materii.
Rozwiązanie równania Schrödingera – w oparciu o założenie de Broglie'a Schrödinger zaproponował kwantowo–mechaniczny model atomu, traktujący również elektrony jako fale materii. Z rozwiązania równania Schrödingera uzyskał szereg funkcji falowych określających prawdopodobieństwo znalezienia elektronu w przestrzeni.
Zasada nieoznaczoności Heisenberga – zgodnie z tą zasadą nie można jednocześnie określić energii ani położenia elektronu.
Teoria Nielsa Bohra – zgodnie z tą teorią w atomie istnieje więcej niż jeden poziom energetyczny, na którym może znajdować się elektron.
Eksperyment Sterna-Gerlacha – dowodzi, że elektrony posiadają spinowy moment pędu, a elektron może mieć jedną z dwóch możliwych wartości spinu: i . Dwa elektrony zajmujące ten sam orbital muszą mieć przeciwne spiny.
Co istotne, zaproponowany model budowy atomu stanowił punkt wyjścia do kolejnych badań i odkryć. W kolejnych latach Frederick Soddy, izolując pierwiastki od rud radioaktywnych, odkrył izotopy (odmiany pierwiastków). Wreszcie w roku James Chadwick udowodnił istnienie obojętnych cząstek w jądrze, które dziś znamy pod nazwą neutronów. Od tamtego czasu fizycy odkryli także, że protony i neutrony tworzące jądro same w sobie są podzielne i dzielą się na cząstki zwane kwarkami.
Powyższe odkrycia doprowadziły do poznania do dziś uznawanej budowy atomów. Należy jednak zdawać sobie sprawę, że w tak specjalistycznych badaniach liczy się nie tylko dobry eksperymentator, lecz decydujące są również precyzyjne narzędzia (np. komputery) i wszelkiego rodzaju instrumenty, które pozwalają osiągnąć sukces – a te, wraz z rozwojem nauki i techniki, są coraz lepsze. Dowodem na to są fotografie atomów otrzymane przy użyciu skaningowego mikroskopu tunelowego STM (STM z ang. scanning tunnelling microscope) czy film nagrany przy użyciu transmisyjnego mikroskopu elektronowego TEM (TEM z ang. transmission electron microscope), przedstawiający tworzenie się wiązań między atomami (styczeń roku). Dlatego badania dotyczące budowy atomów nadal trwają i być może, w niedalekiej przyszłości, naukowcy zdołają się dowiedzieć czegoś więcej na ten temat.
Słownik
najmniejsza część pierwiastka chemicznego, która zachowuje jego właściwości chemiczne
cząstka elementarna (niepodzielna) zajmująca przestrzeń wokół jądra atomu posiadająca ładunek ujemny
centralna część atomu, tworzą ją nukleony (protony i neutrony); prawie cała masa atomu zgromadzona jest w jądrze
cząstka obojętna (nie posiada ładunku elektrycznego) będąca składnikiem jądra atomowego; neutrony nie są cząstkami elementarnymi, składają się z mniejszych elementów, tzw. kwarków (górnego i dwóch kwarków dolnych)
cząstka o ładunku dodatnim będąca składnikiem jądra atomowego; składa się z jednego kwarka dolnego i dwóch kwarków górnych
liczba protonów w jądrze atomowym, która jest równa liczbie elektronów danego atomu; informuje nas też o miejscu pierwiastka w układzie okresowym
liczba nukleonów w jądrze atomowym, równa sumie liczby protonów i liczby neutronów
funkcja falowa, opisująca stan jednego elektronu, zależna od współrzędnych określających jego położenie w atomie (orbital atomowy) i w cząsteczce (orbital molekularny, orbital cząsteczkowy)
właściwość materii (np. fotonów, elektronów) polegająca na przejawianiu, w zależności od sytuacji, właściwości falowych (np. dyfrakcja) lub korspuskularnych (np. pęd)
Bibliografia
Encyklopedia PWN
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Halliday D., Resnick R., Walker J., Podstawy fizyki, tłum. Babiński A. i inni, t.5, Warszawa 2015.
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
https://openstax.org/books/chemistry-atoms-first-2e/pages/2-2-evolution-of-atomic-theory [dostęp 23.10.2020].
https://www.youtube.com/watch?v=gr4jLuqrzbw&feature=emb_logo [dostęp 23.10.2020].
Pigoń K, Ruziewicz Z., Chemia fizyczna, t. 2, Warszawa 2007.