Przeczytaj
Co to jest elektroliza?
Całokształt zjawisk towarzyszących przepływowi prądu elektrycznego przez roztwory elektrolitówelektrolitów lub ich formę stopioną nazywamy elektroliząelektrolizą. Proces ten zachodzi pod wpływem zewnętrznego czynnika – prądu elektrycznego, dlatego też jest procesem wymuszonym.
Aby przeprowadzić elektrolizę niezbędne są:
źródło prądu stałego np. bateria czy akumulator;
elektrody;
w celu badania (analizy) elektrolizy:
woltomierzwoltomierz;
amperomierzamperomierz.
Elektrodami w procesie elektrolizy są zazwyczaj przewodniki metaliczne zanurzone w roztworze elektrolitu, odprowadzające i doprowadzające prąd elektryczny z lub do układu. W szczególnych przypadkach elektrodą może być również naczynie wykonane z metalu, w którym znajduje się elektrolit. W procesie elektrolizy możemy wyróżnić dwie elektrody:
katodę,
anodę.
Katoda, czyli elektroda połączona z ujemnym biegunem
W trakcie procesu elektrolizy odpowiednie drobiny (kationy lub cząsteczki wody) pobierają elektrony z powierzchni katody. Zachodzący tam proces nazywany jest procesem katodowym:
gdy obecne są kationy metalu:
gdy w roztworze znajdują się kwasy, zasady, sole metali 1. i 2. grupy układu okresowego– wtedy na katodzie zachodzi proces:
(elektroliza wodnego roztworu kwasu)
lub:
(elektroliza, wody, zasad i wodnych roztworu soli metali 1. i 2. grupy układu okresowego)
Procesy chemiczne zachodzące na powierzchni katody są procesami redukcji, polegającymi na pobieraniu elektronów przez drobiny.
Anoda, czyli elektroda połączona z dodatnim biegunem
W trakcie procesu elektrolizy odpowiednie drobiny (aniony lub cząsteczki wody) oddają elektrony do powierzchni anody. Zachodzący tam proces nazywany jest procesem anodowym:
gdy obecne są w roztworze aniony halogenkowe , w procesie anodowym powstają cząsteczki halogenów:
(elektroliza wodnych roztworów zawierających aniony halegenkowe)
w przypadku obecności zasad, kwasów tlenowych lub ich soli, produktem elektrolizy jest tlen:
(elektroliza zasady)
lub:
(elektroliza wodnych roztworów kwasów tlenowych i soli tlenowych)
Procesy chemiczne zachodzące na powierzchni anody są procesami utleniania, polegającymi na oddawaniu elektronów przez drobiny.
Czym jest elektrorafinacja?
Pozyskiwane z rud metale występują najczęściej związane w postaci związków chemicznych, takich jak sole czy tlenki. Dlatego też należy je oczyścić w odpowiedni sposób. W pierwszym etapie rudy metali przechodzą obróbkę hutniczą – są oczyszczane z tlenków i soli w odpowiednich warunkach. Wstępnie oczyszczone metale doczyszcza się w procesie elektrorafinacji.
Zanieczyszczony metal umieszczany jest w roztworze własnej soli pełniąc funkcję anody. Katodą jest natomiast ten sam metal, ale o wyższej czystości (pozbawiony zanieczyszczeń innymi metalami lub tlenkami metali). Po przyłożeniu do układu napięcia, anoda zaczyna roztwarzać się, a czysty metal osadza się na katodzie. Zanieczyszczenia przechodzą do roztworu w postaci kationów lub osadzają się w tzw. szlamie anodowym. W ten sposób można oczyszczać metale takie jak miedź, srebro, ołów i cynk.
Zachodzące reakcje można opisać równaniami:
reakcja anodowa:
reakcja katodowa:
Gdzie:
– atom metalu;
– liczba całkowita.
Rozpatrzmy to na przykładzie oczyszczania miedzi. Po procesie hutniczym miedź może być zanieczyszczona metalami, takimi jak np. cynk, złoto czy ołów. Wszystkie te metale mają praktyczne zastosowanie, dlatego też w trakcie procesu elektrorafinacji wszystkie pozostałości są odpowiednio magazynowane i przerabiane w innych procesach.
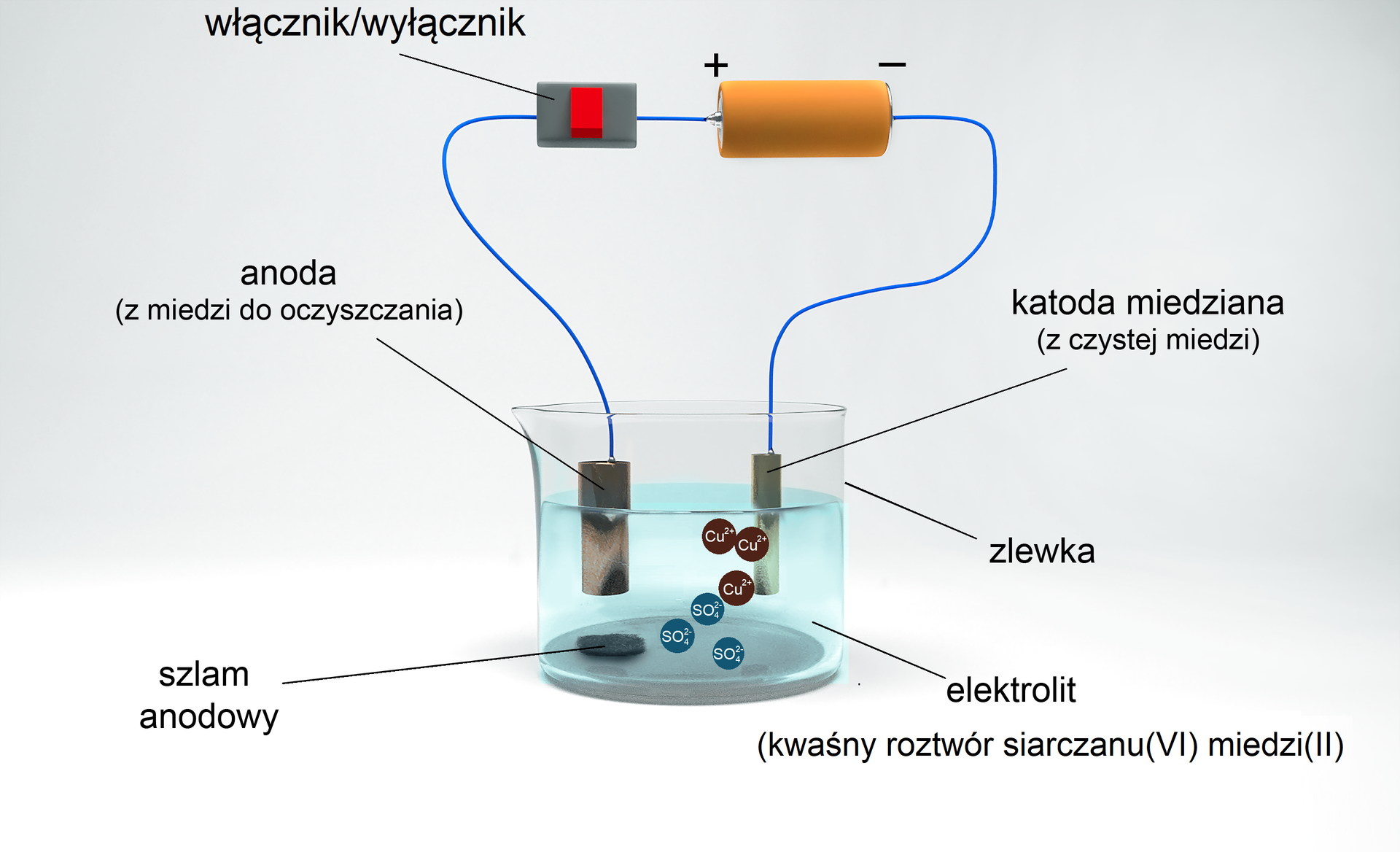
W procesie elektrorafinacji miedzi, anodą jest metaliczna miedź zanieczyszczona innymi metalami. Zanieczyszczenia przechodzą do roztworu lub wytrącają się pod postacią szlamu. Na anodzie zachodzi reakcja utleniania miedzi (oraz obecnych w metalu niektórych metalicznych zanieczyszczeń, których potencjał jest niższy niż potencjał miedzi). W roztworze elektrolitu znajdują się jony miedzi i aniony .
Równanie reakcji zachodzącej na anodzie, czyli reakcji anodowej:
Gdy w anodzie obecne są metale takie jak cynk lub żelazo, zachodzą dodatkowe reakcje chemiczne:
Zanieczyszczenia te przechodzą do roztworu w formie kationów. Jeżeli miedź zanieczyszczona jest innymi pierwiastkami szlachetnymi, takimi jak na przykład złoto o znacznie wyższym potencjale, metal ten wytrąca się do szlamu anodowego.
Na katodzie zachodzi reakcja redukcji (reakcja katodowa) opisana równaniem:
Sumaryczne równanie reakcji:
Napięcie w procesie elektrorafinacji jest dobrane w taki sposób, aby pozostałe metale nie wytrącały się na katodzie. Możemy zauważyć, że w trakcie tego procesu masa katody zwiększa się. Zwiększenie napięcia mogłoby doprowadzić do procesów ubocznych, takich jak rozkład wody.
Zastosowania elektrorafinacji
Metale pozyskane w wyniku oczyszczania metodą elektrorafinacji wykazują się wysoką czystością (w trakcie procesu można usunąć 99% zanieczyszczeń). Dlatego też metale takie mogą być wykorzystywane w elektronice lub w jubilerstwie.
Słownik
(gr. ḗlektron „bursztyn”, hodós „droga”) chem. układ złożony z przewodnika elektronowego (metal, półprzewodnik), stykającego się z przewodnikiem jonowym (najczęściej ciekły elektrolit), w którym może przebiegać reakcja elektrodowa utleniania‑redukcji
(gr. ḗlektron „bursztyn”, lýsis „rozłożenie”) podstawowy proces elektrochemiczny, polegający na chemicznej przemianie składników elektrolitu, a często i materiału elektrod, przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) chem. przewodnik elektryczny jonowy (zwany też przewodnikiem drugiego rodzaju), w którym poruszające się jony przenoszą ładunki elektryczne, a przewodzenie prądu zawsze jest związane z transportem masy
przyrząd służący do pomiaru napięcia elektrycznego
przyrząd służący do pomiaru natężenia prądu elektrycznego
Bibliografia
Encyklopedia PWN
Hejwowska S., Chemia 3, Warszawa 2006.
Śliwa A., Obliczenia chemiczne, Warszawa 1987, wyd. 2.