Przeczytaj

Koncepcja hybrydyzacjihybrydyzacji powstała w roku za sprawą naukowca Linusa Paulinga. W świetle teorii hybrydyzacji energia orbitali poszczególnych atomów ulega redystrybucji. Orbitale mieszają się i powstają z nich nowe – orbitale hybrydyzowane, które posiadają jednakowy kształt i energię. Suma energii powstałych orbitali zhybrydyzowanych jest równoważna z sumą energii orbitali pierwotnych. Biorą one udział w tworzeniu wiązań pomiędzy atomami. Aby zrozumieć dokładnie to zjawisko, należy przyjrzeć się bliżej rozkładowi elektronów w atomie.
Konfiguracja elektronowa
Każda powłoka, dla której główna liczba kwantowa () wynosi kolejno od do , mieści pewną ilość elektronów, co przedstawia tabela poniżej. Odzwierciedleniem ilości elektronów na poszczególnych powłokach elektronowych jest konfiguracja elektronowakonfiguracja elektronowa, która jest swego rodzaju mapą elektronów.
Numer powłoki () | |||||||
Symbol powłoki elektronowej | |||||||
Maksymalna liczba elektronów na powłoce () |
Orbitale, a dokładnie obszary orbitalne, są modelem reprezentującym rozkład i zachowanie się elektronów w cząsteczkach. Można powiedzieć, że obszar, w którym prawdopodobieństwo napotkania elektronu jest największe, to orbital. W rzeczywistości orbital jest funkcją falową, a jego przestrzeń ma rozmyte granice. Jak wynika z rysunku poniżej, energia orbitali rośnie wraz ze wzrostem numeru powłoki. Największą energią charakteryzują się zatem elektrony obsadzające orbitale typu . Powłoki elektronowe oraz kolejność ich zapełniania zobaczysz na rysunku poniżej.

Zgodnie z zakazem Pauliego na pojedynczym orbitalu mogą się znajdować co najwyżej dwa elektrony o przeciwnych spinach (oznaczamy je strzałkami). Zapełnianie orbitali prowadzone jest zgodnie z ich wzrastającą energią. A więc na początku zapełniany jest sferyczny orbital , potem , a następnie trzy orbitale , po jednym elektronie każdy. Dopiero kolejne trzy elektrony zapełniają pojedynczo obsadzone orbitale . Na powłokach można wyróżnić orbitale , , i , z których jednak obsadzonych jest tylko tyle, na ile starczy elektronów.
Z punktu widzenia tworzenia wiązań najistotniejsze jest obsadzenie najbardziej zewnętrznej powłoki elektronowej, czyli powłoki walencyjnej. Elektrony położone na niej są najsłabiej związane z jądrem i najchętniej biorą udział w tworzeniu wiązań. Elektrony te znajdują się zatem na orbitalach zwanych orbitalami walencyjnymi. Najważniejsze pierwiastki w chemii organicznej, takie jak wodór, węgiel, azot, tlen i fluorowce, mają w stanie podstawowym na powłoce walencyjnej elektrony ulokowane wyłącznie na orbitalach i , dlatego to właśnie te orbitale biorą udział w tworzeniu wiązań.
Graficzna reprezentacja orbitali
Aby zrozumieć, jak mieszają się orbitale i jakie przyjmują kształty, prześledźmy, jak wyglądają orbitale przed zmieszaniem. Jak pokazano poniżej, orbital typu ma kształt kuli. Łatwo zapamiętać, że kształtem przypomina piłkę tenisową. Orbital ma bardzo małą gęstość elektronów w pobliżu centrum, ale narasta ona do maksimum (gdy oddalamy się od środka), a następnie zmniejsza się poza kontur – trochę jak wydrążona piłka tenisowa. Orbital jest jest większy od orbitalu , ale ma kulę gęstości elektronowej wewnątrz zewnętrznej sfery. Przypomina to jedną piłkę tenisową wewnątrz drugiej. Między dwiema kulami znajduje się powierzchnia, gdzie istnieje zerowe prawdopodobieństwo znalezienia elektronu. Nazywamy tę powierzchnię węzłem lub powierzchnią węzłową. Orbital jest jeszcze większy niż orbital oraz i ma trzy węzły.

Orbitale typu p są podobne do „ósemek” albo płatków stokrotki. W przypadku orbitali typu p mówimy, że są zdegenerowane. Wynika to z faktu, że istnieją trzy możliwe orbitale , położone względem siebie prostopadle, wzdłuż osi , i (odpowiednio , i ). Orbitale p znajdują się na poziomach energetycznych wyższych niż pierwszy, stąd na poziomie drugim otrzymujemy orbitale , i , a następnie na poziomie trzecim , , itd.
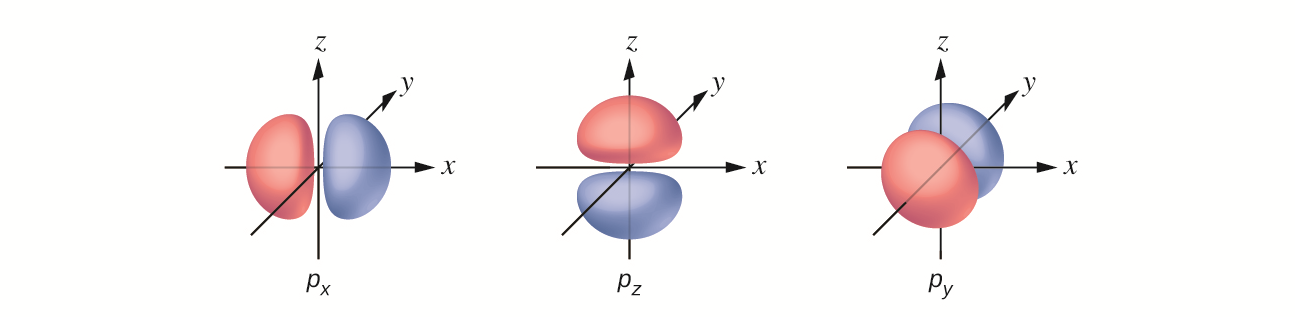
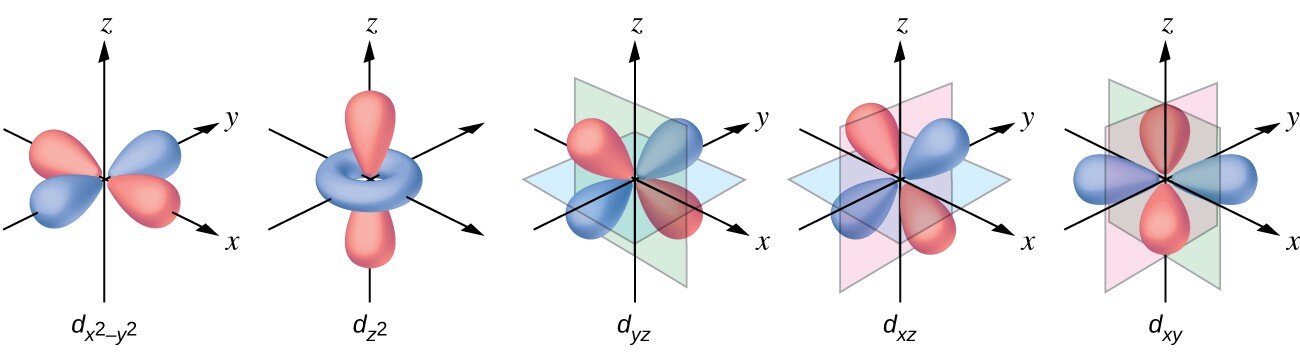
Oprócz orbitali i istnieją również inne zestawy orbitali, które są charakterystyczne dla elektronów znajdujących się na wyższych poziomach energii. Na trzecim poziomie znajduje się zestaw pięciu orbitali (o skomplikowanych kształtach i nazwach) oraz orbitale i (, , ). Na trzecim poziomie jest w sumie dziewięć orbitali. Z kolei orbital typu kształtem przypomina czterolistną koniczynę. Orbitale typu przedstawiono poniżej.
Hybrydyzacja
Dlaczego hybrydyzacja jest taka ważna?
W tworzeniu wiązań biorą udział elektrony walencyjne. Skoro zatem elektrony te znajdują się na orbitalach, możemy powiedzieć, że to orbitale atomów łączą się tworząc wiązania. W rzeczywistości orbitale zachodzą na siebie. Z fizycznego punktu widzenia, hybrydyzacja polega na matematycznym mieszaniu funkcji falowych. Nowo powstałe funkcje opisują zupełnie inne orbitale atomowe, które nazywamy orbitalami zhybrydyzowanymiorbitalami zhybrydyzowanymi. Hybrydyzację możemy utożsamić z mieszaniem dwóch roztworów. Jeśli mieszamy dwa roztwory o różnych barwach i stężeniach, po zmieszaniu otrzymujemy zupełnie nowy roztwór. Podobnie jest z orbitalami, po ich zmieszaniu rozkład gęstości elektronowej jest bowiem inny niż w orbitalach bazowych. Zatem przez hybrydyzację możemy rozumieć połączenie dwóch lub więcej orbitali różnego typu.
Nowo powstałe orbitale, orbitale zhybrydyzowane, biorą udział w tworzeniu wiązań.
Przykład 1.
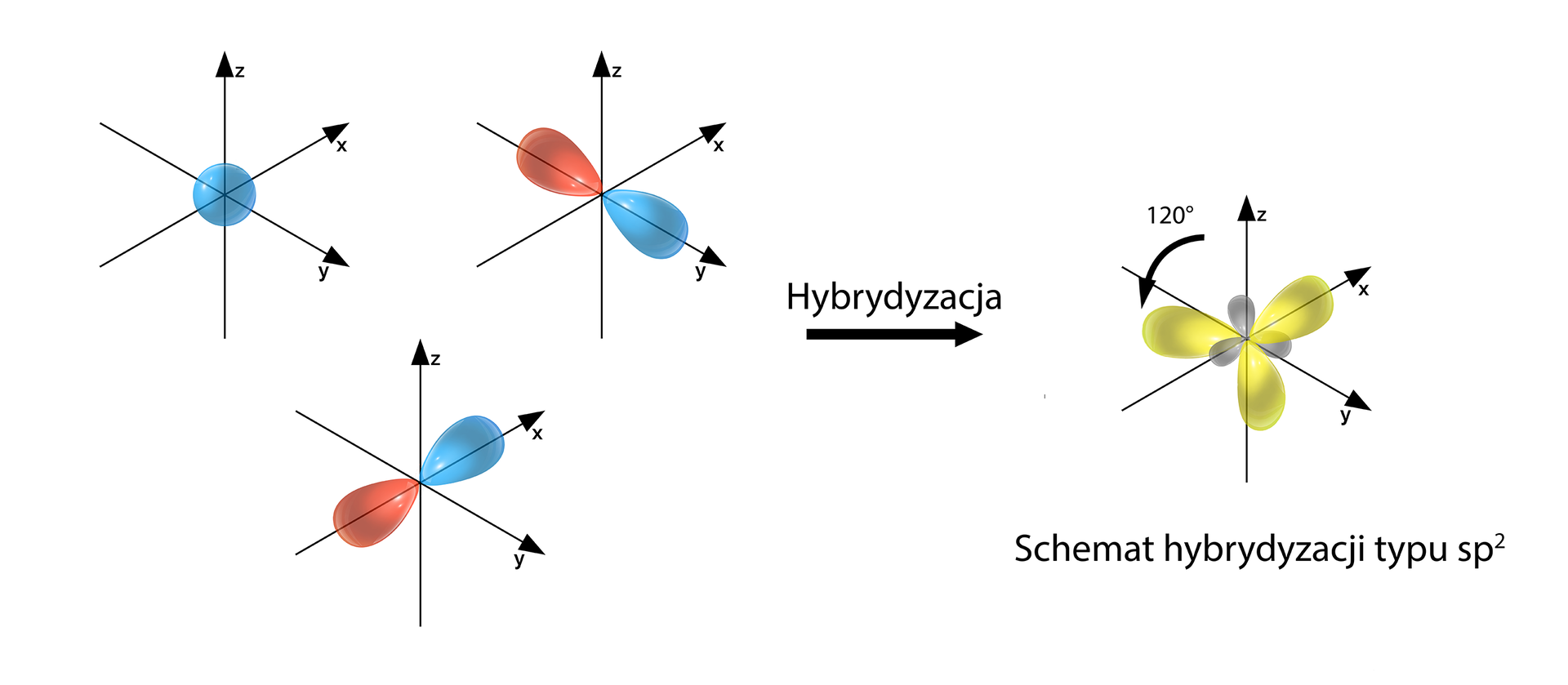
Gdy mieszaniu (hybrydyzacji) ulega orbital i orbitale , to powstają orbitale zhybrydyzowane . Jak wynika z rysunku poniżej, suma orbitali powstałych w wyniku hybrydyzacji oraz ewentualnie pozostałych niezhybrydyzowanych orbitali nie zmienia się. Elektrony obsadzające orbitale zhybrydyzowane mają identyczną energię (mówimy, że są zdegenerowane). Orbitale te mają też identyczny kształt.
Typy hybrydyzacji
W zależności od liczby i typu orbitali, które uczestniczą w hybrydyzacji, można wyróżnić różne jej typy i odpowiadające im przestrzenne rozmieszczenie orbitali zhybrydyzowanych. Jak zatem określić typ hybrydyzacji? Odpowiedź jest prosta – należy policzyć, ile orbitali bierze udział w hybrydyzacji, a ich liczba wskaże typ hybrydyzacji. Poniżej znajdziesz tabelę pomocniczą oraz graficzne odzwierciedlenie utworzonych orbitali zhybrydyzowanych.
Typ hybrydyzacji | |||
Orbitale biorące udział w hybrydyzacji | , | , , | , , , |
Liczba orbitali |


Słownik
(łac. hibrida ,,mieszaniec”) zabieg matematyczny z udziałem odpowiednich orbitali walencyjnych atomu centralnego cząsteczki umożliwiający interpretację kształtu cząsteczki; efektem hybrydyzacji jest utworzenie zestawu orbitali zhybrydyzowanych
równocenne pod względem kształtu i energii orbitale atomowe będące wynikiem mieszania się orbitali atomowych o różnych kształtach i energii
elektrony atomu, które, w stanie podstawowym i przy założeniu występowania tylko centralnego pola jądra atomu, wykazują taką samą energię oznaczoną główną liczbą kwantową
rozkład gęstości prawdopodobieństwa położenia elektronów w atomie w funkcji odległości od jądra
sytuacja, kiedy jednej wartości energii układu odpowiada wiele stanów kwantowych układu
Bibliografia
Basiński A., Bielański A., Gumiński K. i inni, Chemia fizyczna, Warszawa 1966, s. 86‑110.
Jones L., Atkins P., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Pfennig B. W., Principles of Inorganic Chemistry, New Jersey 2015.
Słownik Języka Polskiego PWN
Usnalski W., Chemia w szkole średniej, Warszawa 1998.