Przeczytaj
Rodzaje wiązań chemicznych
- Nazwa kategorii: Rodzaje wiązań chemicznych
- Nazwa kategorii: Wiązanie jonowe
- Nazwa kategorii: Wiązanie metaliczne
- Nazwa kategorii: Wiązania kowalencyjne
- Nazwa kategorii: Wiązanie kowalencyjne niespolaryzowane
- Nazwa kategorii: Wiązanie kowalencyjne spolaryzowane
- Nazwa kategorii: Wiązanie koordynacyjne Koniec elementów należących do kategorii Wiązania kowalencyjne
- Elementy należące do kategorii Rodzaje wiązań chemicznych
- Elementy należące do kategorii Wiązania
kowalencyjne
Wiązanie jonowe
Wiązanie jonoweWiązanie jonowe jest oddziaływaniem elektrostatycznym pomiędzy jonami pierwiastków, które tworzą związek. Zwyczajowo (dla uproszczenia) przedstawia się wzory sumaryczne związków jonowych, np. soli, podając tylko skład pierwiastkowy związku. Wzór chlorku sodu czy bromku potasu zupełnie nie oddaje charakteru połączenia między atomami. Aby pokazać charakter jonowy tego związku, stosuje się następujący zapis:
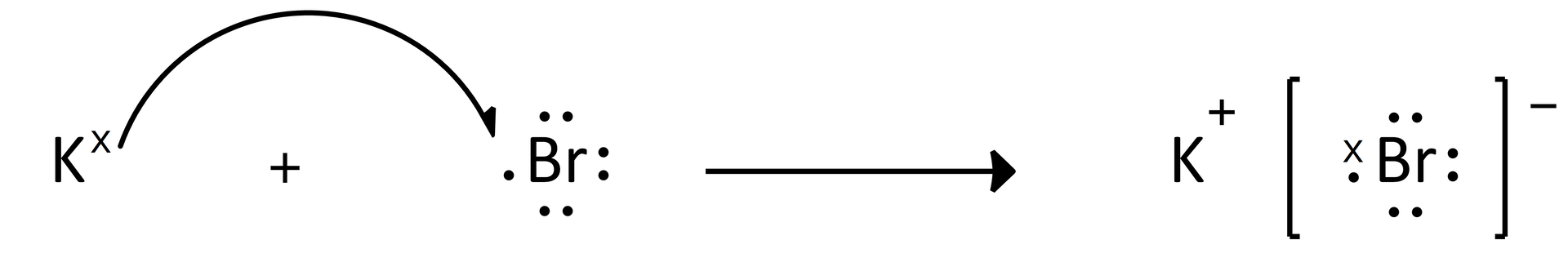
W procesie tworzenia się wiązania jonowego, pierwszym etapem jest powstawanie jonów. W przypadku reakcji potasu i bromu, zachodzi proces powstawania kationu i anionu :
Zapoznaj się z danymi zawartymi w poniższym układzie okresowym i odpowiedz na pytanie – jak zmieniają się rozmiary atomów sodu i fluoru?
Zapoznaj się z opisem ilustracji. Odpowiedz na pytanie – jak zmieniają się rozmiary atomów sodu i fluoru?
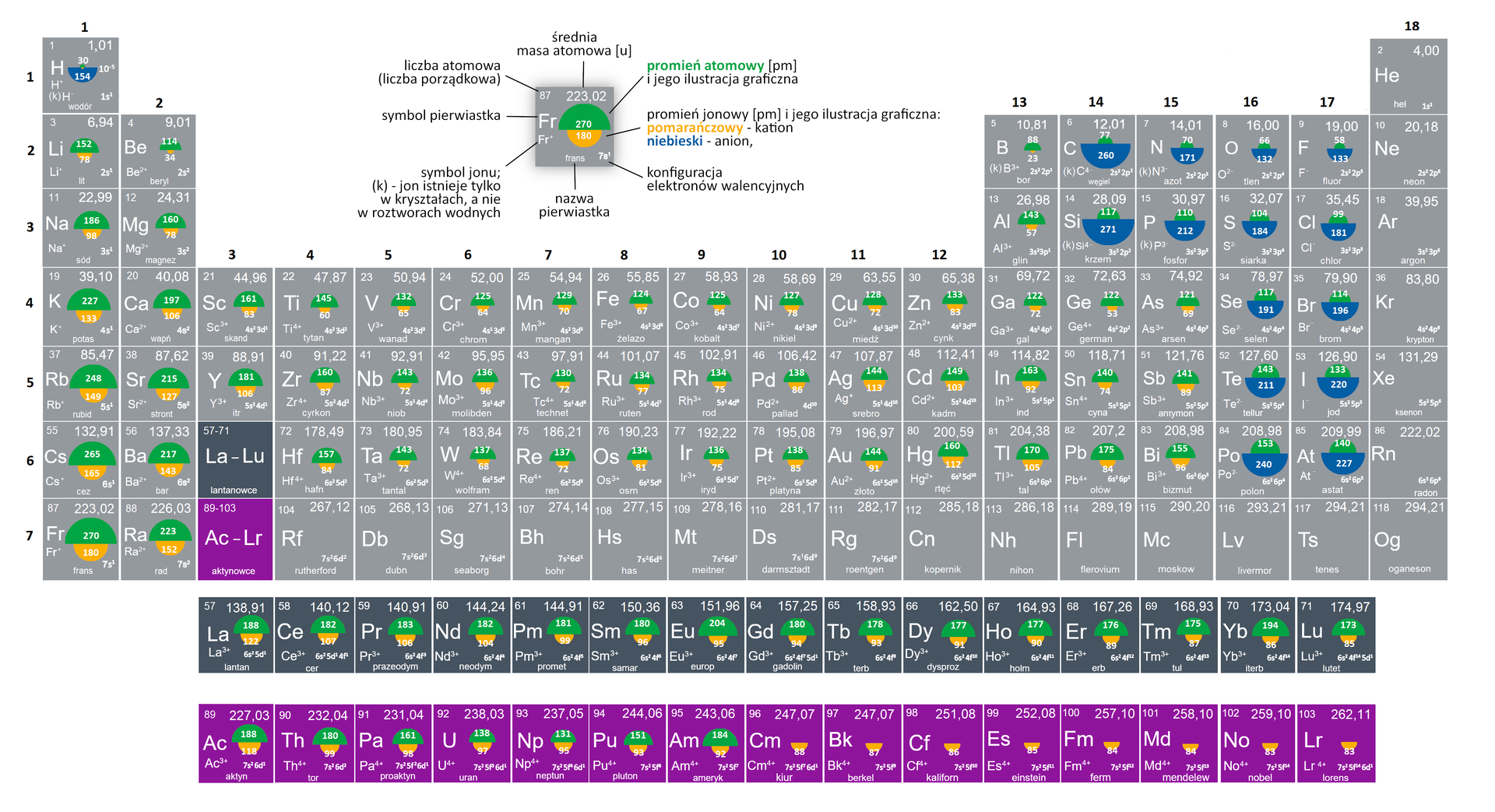
Zastanów się i odpowiedz, dlaczego tak się dzieje?
Wiązania kowalencyjne niespolaryzowane
Wiązanie kowalencyjneWiązanie kowalencyjne niespolaryzowane powstaje w wyniku tworzenia się pomiędzy atomami wspólnych par elektronowych, które najczęściej przedstawia kreska pomiędzy atomami.
Jeżeli w związku tworzą się wiązania wielokrotne, to zaznaczamy je równoległymi kreskami leżącymi pomiędzy atomami, które tworzą to wiązanie.
Wiązania kowalencyjne spolaryzowane
W przypadku, gdy atomy tworzące wiązanie kowalencyjne różnią się elektroujemnościąelektroujemnością, następuje polaryzacja wiązania i mówimy, że jest to wiązanie kowalencyjne spolaryzowane.
Przyjęto, że wiązanie kowalencyjne spolaryzowane tworzy się pomiędzy atomami, dla których różnica elektroujemności jest następująca:
Istnieją wyjątki, tj. wodorek sodu i inne wodorki metali aktywnych, dla których pomimo występującej różnicy elektroujemności niższej niż występuje wiązanie jonowe.
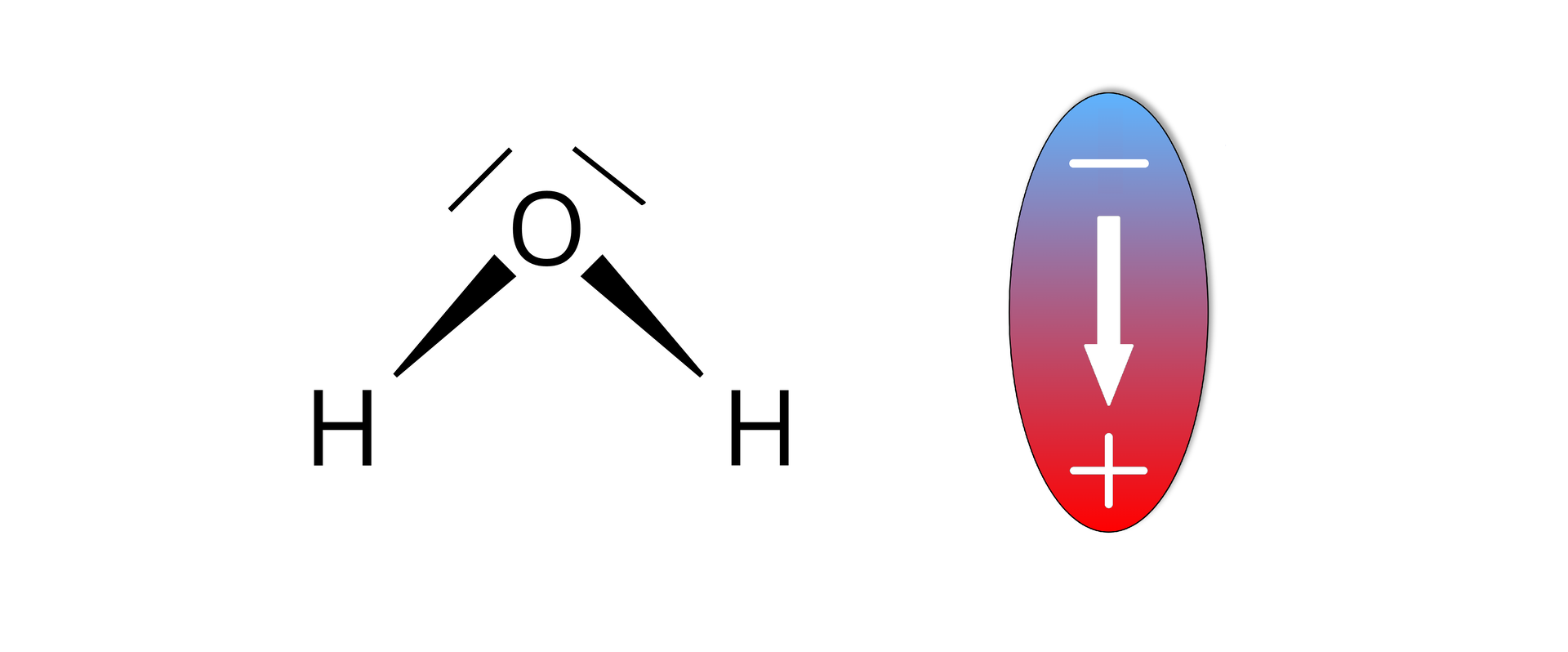
Polaryzację wiązania kowalencyjnego spolaryzowanego przedstawiamy albo za pomocą pogrubionej kreski, albo zaznaczając ładunki cząstkowe przy atomach.
DipolDipol elektryczny i elektryczny moment dipolowy
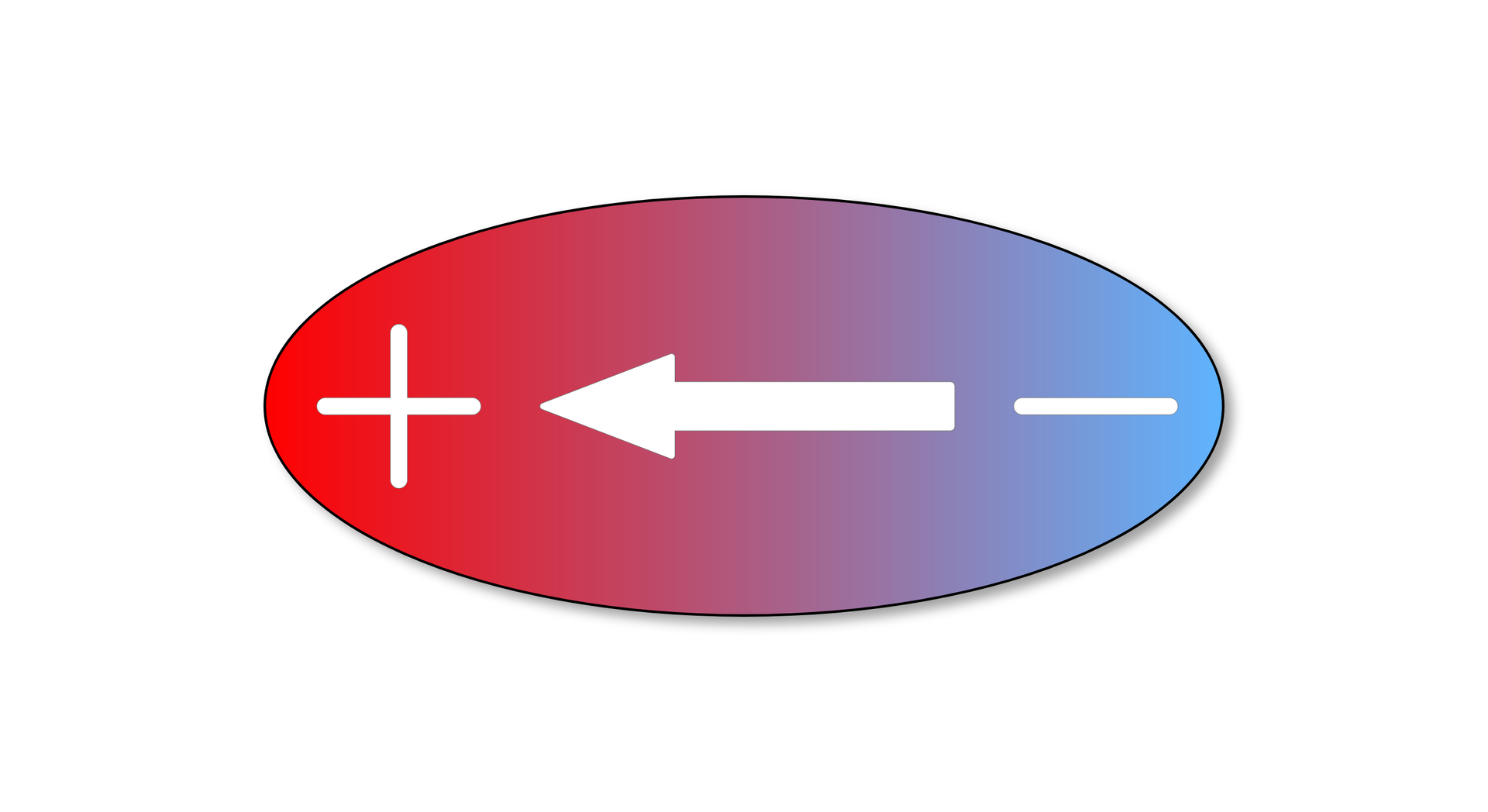
Cząsteczka spolaryzowana (posiadająca bieguny dodatni i ujemny) z fizycznego punktu widzenia jest dipolem. Do wielkości, które charakteryzują dipol, należy moment dipolowy (wielkość wektorowa).
Wiązanie koordynacyjne
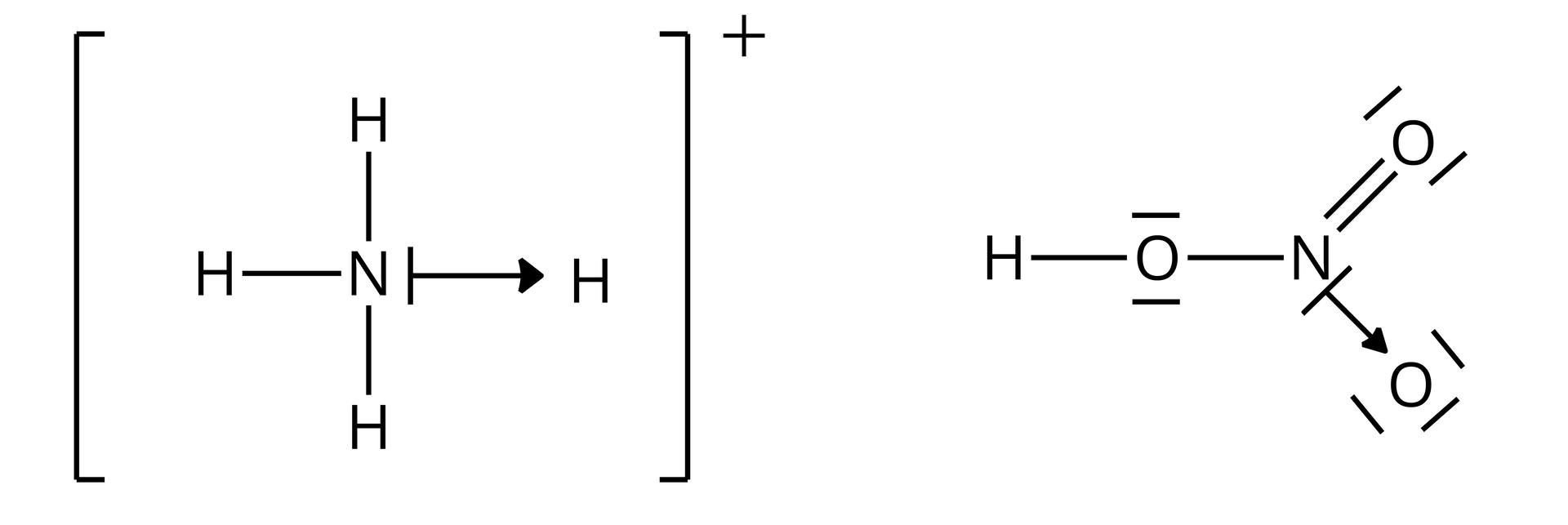
Wiązanie koordynacyjne jest rodzajem wiązania kowalencyjnego. Tworzy je para elektronowa, pochodząca od jednego atomu tworzącego wiązanie – donora, przesunięta w kierunku drugiego atomu – akceptora. Wiązanie to zaznacza się strzałką skierowaną w stronę akceptora, np. w jonie amonowym – czy w cząsteczce kwasu azotowego() – .
Słownik
(dipol elektryczny) układ dwóch jednakowych – co do wartości, lecz przeciwnego znaku – ładunków elektrycznych ( i ), znajdujących się w małej odległości od siebie
zdolność tworzących wiązanie atomów do przyciągania uwspólnionych elektronów
oddziaływanie elektrostatyczne pomiędzy jonami pierwiastków tworzących związek
wiązanie polegające na uwspólnianiu elektronów walencyjnych przez tworzące je atomy i powstawaniu wiążących par elektronowych
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 335 -441.
Litwin M., Styka‑Wlazła S., Szymońska J., Chemia ogólna i nieorganiczna. Część 1. Podręcznik dla liceum, Warszawa 2004, s. 45‑61.
Pauling L., Pauling P., Chemia, Warszawa 1989, s. 128‑170.
Sawicka J., Janich‑Kilian A., Cejnert‑Mania W., Urbańczyk G., Tablice chemiczne, Gdańsk 2002, s. 31‑39.