Przeczytaj
Konfiguracja elektronowa atomów chromu
Konfiguracja elektronowa chromu jest przedstawiana w następujący sposób:

Chrom występuje na , , i stopniu utlenienia. Najczęściej spotykanymi związkami są związki chromu() i chromu(), ponieważ są najbardziej trwałe. Natomiast związki chromu() oraz chromu() taką trwałością się już nie charakteryzują.
Jakie stopnie utlenienia chromu można odnaleźć w jego związkach?
Chrom na stopniu utlenieniastopniu utlenienia występuje najczęściej pod postacią tlenku chromu() o wzorze sumarycznym . Jest to związek bardzo nietrwały, szybko utlenia się do związków chromu na stopniu utlenienia, co znacząco zmniejsza jego możliwości zastosowania w preparatyce chemicznej.
Ma charakter zasadowy, co oznacza, że reaguje z kwasami – choćby z kwasem siarkowym() i kwasem chlorowodorowym:
Podczas ogrzewania tlenku chromu() w obecności tlenu, atom chromu ulega utlenieniu, a produktem reakcji jest tlenek chromu() o wzorze sumarycznym .
Związek ten powstaje również w wyniku rozkładu wodorotlenku chromu() pod wpływem temperatury:

Tlenek chromu() jest związkiem amfoterycznym, więc reaguje zarówno z kwasami (np. kwasem solnym), jak i z zasadami (np. z wodnym roztworem wodorotlenku potasu). W wyniku reakcji z roztworem wodorotlenku sodu powstaje związek kompleksowy: heksahydroksychromian() sodu o wzorze sumarycznym: . Anion nazywany jest anionem heksahydroksychromianowym().
Szarozielony wodorotlenek chromu() – podobnie jak tlenek chromu() – jest amfoteryczny. Można go otrzymać w wyniku reakcji dobrze rozpuszczalnej soli chromu() z rozpuszczalnym w wodzie wodorotlenkiem, takim jak wodorotlenek sodu czy wodorotlenek potasu. Skrócony jonowy zapis tej reakcji wygląda następująco:
Badanie charakteru chemicznego wodorotlenku chromu()
Jaki charakter chemiczny mają wodorotlenek chromu() i wodorotlenek glinu()?
Wodorotlenek chromu(), podobnie jak wodorotlenek glinu(), jest związkiem amfoterycznym.
dwie probówki z niewielką ilością wodorotlenku chromu();
dwie probówki z niewielką ilością wodorotlenku glinu();
cztery korki do zatkania probówek;
wodny roztwór kwasu chlorowodorowego;
wodny roztwór wodorotlenku sodu.
Do jednej probówki z wodorotlenkiem chromu() dodaj wodnego roztworu kwasu chlorowodorowego, a do drugiej wodnego roztworu wodorotlenku sodu.
Obie probówki zatkaj korkiem i wstrząśnij. Zanotuj obserwacje.
Do jednej probówki z wodorotlenkiem chromu() dodaj wodnego roztworu kwasu chlorowodorowego, a do drugiej wodnego roztworu wodorotlenku sodu.
Obie probówki zatkaj korkiem i wstrząśnij. Zanotuj obserwacje.
Wnioski:
Chrom na stopniu utlenienia występuje również w formie soli. Sole chromu() mają zielone lub niebieskie, a nawet fioletowe zabarwienie. Bezwodny chlorek chromu() jest fioletowy, natomiast jego heksahydrat o wzorze lub jest zielony. Siarczan() chromu() jest niebieski.
Poza wymienionymi powyżej tlenkiem chromu() i związkami chromu() istnieją również związki tlenu z chromem na i stopniu utlenienia. Tlenek chromu(), , jest czarnym ciałem stałym i ma dobre właściwości ferromagnetyczne.
Przed rozpowszechnieniem płyt CD i DVD, tlenek chromu() był stosowany do produkcji taśm magnetycznych, na przykład kaset magnetofonowych.

Chrom na stopniu utlenieniastopniu utlenienia tworzy z tlenem pomarańczowoczerwony (czerwonobrunatny) tlenek, który ma charakter kwasowy – reaguje więc z zasadami, ale nie z kwasami.

Ponadto tlenek chromu() ma właściwości kwasotwórcze, czyli tworzy istniejące tylko w postaci wodnych roztworów kwasy: chromowy() – i dichromowy() – .
Co więcej, w roztworach wodnych mogą tworzyć się również kwasy polichromowe(). Jak już zostało wspomniane, kwasy te nie występują w stanie wolnym, a tylko w postaci wodnych roztworów. Jako wolne, mogą za to występować ich sole: chromiany()chromiany() i dichromiany()dichromiany().
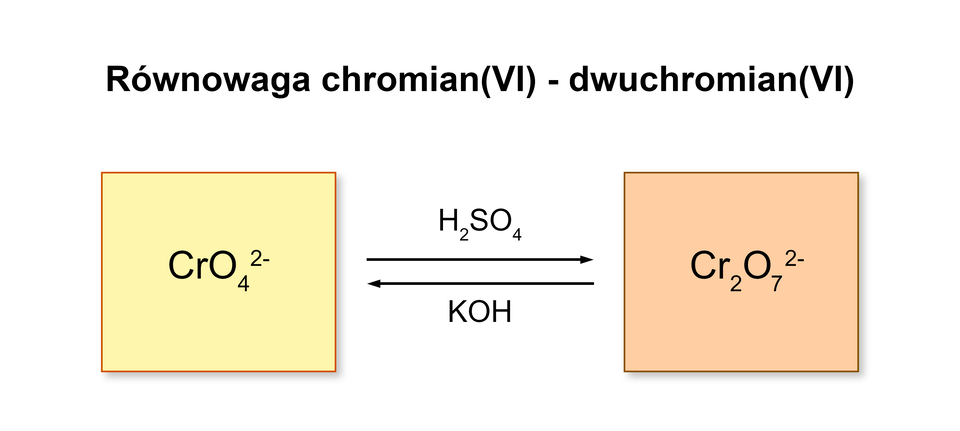
Roztwory wodne zawierające jony chromianowe() – – mają barwę żółtą, a te posiadające jony dichromianowe() – – barwę pomarańczową. Pomiędzy nimi ustala się równowaga. W roztworach o odczynie kwasowym dominują jony , a w roztworach o odczynie zasadowym jony .
W laboratorium zakwaszone roztwory, które zawierają jony dichromianowe(), stanowią użyteczne środki utleniające.
Reakcja redukcji przebiega zgodnie z równaniem:
Przykładem takiej reakcji może być redukcja etanolu przy użyciu dichromianu() potasu:
Zmiana barwy jest bardzo charakterystyczna i łatwa do zaobserwowania, dlatego była wykorzystywana w alkomatach. Dichromian() potasu lub amonu utleniał w nich alkohol, a sam redukował się do związków chromu(). Zmiana barwy była rejestrowana przez czujnik, który obliczał zawartość alkoholu w wydychanym powietrzu, na podstawie barwy powstałego związku.
Ta metoda nie jest już wykorzystywana, ponieważ dichromian() potasu jest silnym utleniaczem. Stąd wiele związków, które posiadają grupę hydroksylową, mogą być przez niego utlenione, dając fałszywie pozytywne wyniki. Ponadto związki chromu() są toksyczne.

Modele jonów: chromianowego() i dichromianowego()
Reakcję rozkładu dichromianu() amonu wykorzystuje się często podczas pokazów chemicznych, ponieważ jest ona bardzo widowiskowa. Doświadczenie przedstawiane jest jako „wybuch wulkanu”.

Roztwór dichromianu() potasu jest często stosowanym utleniaczemutleniaczem. Jego roztwór w kwasie siarkowym nazywany jest chromianką i ma bardzo silne właściwości utleniające. Do niedawna była ona masowo stosowana w laboratoriach do mycia szkła, w celu usunięcia pozostałości substancji organicznych, zwłaszcza do odtłuszczania. Obecnie jej stosowanie jest zabronione, ponieważ jest silnie żrąca, a związki chromu na stopniu utlenienia są rakotwórcze. Związki organiczne usuwa się ze szkła za pomocą kąpieli w ługach (np. stężone roztwory lub ).

Słownik
sole kwasu chromowego() zawierają anion
sole kwasu dichromowego() zawierają anion
w ujęciu kinetycznym – stan, do którego dąży układ w miarę przebiegu reakcji odwracalnej
ładunek, jaki zgromadziłby się na atomie danego pierwiastka, który wchodzi w skład związku chemicznego, przy założeniu, że wszystkie wiązania chemiczne w związku mają charakter wiązań jonowych
atom, jon lub cząsteczka, które w reakcji redoks są donorem elektronu (elektronów)
atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
proces przyjmowania elektronów, związany z obniżaniem stopnia utlenienia utleniacza
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1977.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, s. 297–327, Warszawa 2002.
Hasssa R., Mrzigod A., Mrzigod J., Sułkowski W., Chemia 2, s. 326‑335, Warszawa 2003.