Przeczytaj
Fosfor jest pierwiastkiem chemicznym o symbolu , który zajmuje trzynaste miejsce pod względem rozpowszechnienia w skorupie ziemskiej. Jest również niemetalem, znajdującym się w trzecim okresie i w piętnastej grupie układu okresowego (azotowce). Fosfor odkrył w r. hamburski lekarz Henning Brand. Wydzielił go w postaci fosforu białego, z moczu, podczas długotrwałego prażenia. W przyrodzie fosfor nie występuje w stanie wolnym, lecz w postaci minerałów tj.: fosforyt – , fluoroapatyt – oraz chloroapatyt –
Fosfor w stanie stałym występuje w kilku odmianach alotropowychalotropowych. Należą do nich: fosfor biały, fosfor czerwony, fosfor fioletowy i fosfor czarny.
Hennig Brand odkrył fosfor biały, próbując otrzymać kamień filozoficzny. Niemiecki alchemik strzegł tajemnicy produkcji fosforu i sprzedawał świecący w ciemności preparat drożej niż złoto. Z litrów moczu uzyskiwał fosforu. Inną wydajniejszą metodę produkcji opracował następnie R. Boyle ( rok), a jego asystent A. G. Hanckwitz, zwiększył jej wydajność do produkcji przemysłowej.
Kamień filozoficzny to hipotetyczna substancja, której bezskutecznie poszukiwali alchemicy. Substancja ta, według przypuszczeń, mogłaby przemieniać metale w złoto.
Fosfor biały

Fosfor biały to woskowata substancja, która topi się w temperaturze (). Ta odmiana fosforu nie rozpuszcza się w wodzie, lecz w benzynie i dwusiarczku węgla. Występuje w postaci czteroatomowych cząsteczek , gdzie atomy ułożone są w czworościan foremny (tetraedr). Wiązania w miedzy atomami fosforu są utworzone w z orbitali i zaledwie w z orbitali i .

Fosfor biały jest bardzo toksyczny (dawka śmiertelna ) i skrajnie łatwopalny, ulega samozapłonowisamozapłonowi na powietrzu, dlatego przechowywany jest pod wodą. Jest stosowany do produkcji materiałów wybuchowych (tj. granaty, napalm), flar ostrzegawczych i trutki na szczury. Przez długi czas służył do tworzenia świecących napisów. Zastosowanie to wynikało ze specyficznej zdolności do emitowania światła, czyli chemiluminescencjichemiluminescencji. Fosfor biały na powietrzu ulega reakcji utlenienia, czego efektem energetycznym jest świecenie w ciemnościach. W wyniku reakcji utlenienia z fosforu białego powstaje dekatlenek tetrafosforu – tlenek fosforu(), powszechnie używany w chemii środek suszący.
Fosfor biały jest otrzymywany w postaci par, na skutek ogrzewania fosforanu() wapnia z piaskiem i z koksem w piecu (temperatura ), bez dostępu powietrza.
Podczas tej reakcji fosfor wydziela się w postaci stężonych par, które ulegają kondensacji w wyniku przepuszczenia ich przez warstwę wodną. Ta odmiana alotropowa fosforu jest najmniej trwała i można z niej otrzymać inne trwałe odmiany, które są produktami polimeryzacji cząsteczek .
Fosfor czerwony

W w. szwedzki naukowiec Jacob von Berzelius odkrył, że fosfor biały pod wpływem światła słonecznego przybiera czerwoną barwę i traci zdolność do emitowania światła w ciemności. W taki sposób został odkryty fosfor czerwony, czyli kolejna odmiana alotropowa fosforu. Fosfor czerwony, jak sama nazwa wskazuje, to substancja koloru ciemnoczerwonego, nietoksyczna i mniej reaktywna niż fosfor biały. Na powietrzu zapala się w temperaturze () i, w przeciwieństwie do fosforu białego, jest nierozpuszczalny. Fosfor czerwony posiada łańcuchową strukturę, przypuszczalnie tworzącą się na skutek pękania niektórych wiązań w cząsteczkach .
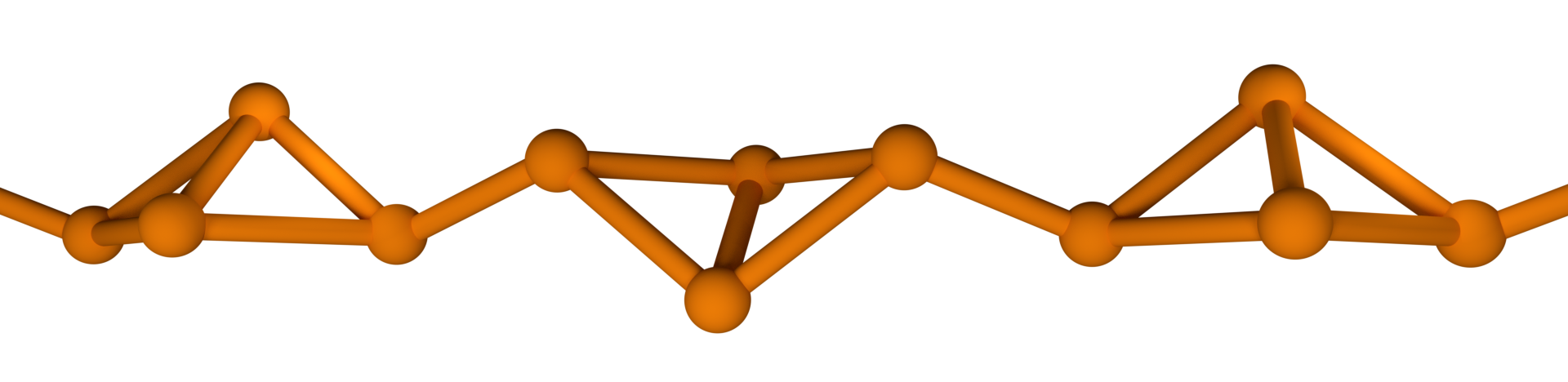
Fosfor czerwony można otrzymać w wyniku ogrzewania fosforu białego z jodem (katalizator) w temperaturze ok () bez dostępu powietrza.

Fosfor czerwony jest powszechnie stosowany do produkcji drasek w opakowaniu zapałek. Draska znajdująca się na boku pudełka zapałek zawiera: fosfor czerwony, spoiwo oraz zmielone szkło. Na skutek potarcia główką zapałki o draskę następuje wzrost temperatury do około i zapalenie się zapałki. Jest to efekt zachodzący na skutek reakcji chemicznej między fosforem czerwonym i chloranem potasu (znajdującym się w główce zapałki). Dawniej ( w.) przez długi czas stosowane były zapałki fosforowe, zawierające fosfor biały, które zapalały się przy energicznym potarciu, o dowolną suchą i szorstką powierzchnię.
Fosfor fioletowy

Fosfor fioletowy został odkryty w r. przez niemieckiego chemika i fizyka J. W. Hitorffa. Topi się w temperaturze (). Jest krystaliczną odmianą fosforu o skomplikowanej strukturze. Krystalizuje w układzie jednoskośnym.
Fosfor fioletowy jest mało reaktywny i nie rozpuszcza się w żadnej substancji. Otrzymuje się go na skutek długotrwałego ogrzewania fosforu czerwonego w temperaturze ok () oraz w wyniku krystalizacji roztworu fosforu białego w stopionym ołowiu lub bizmucie.
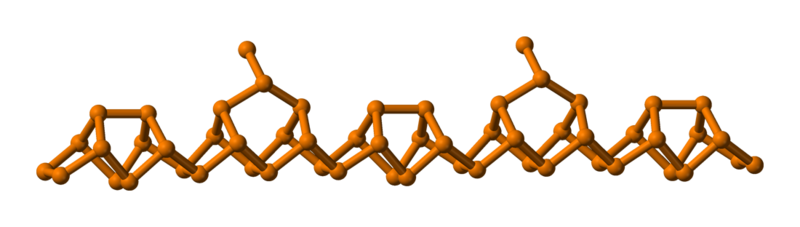
Fosfor czarny

Fosfor czarny został odkryty w w. przez amerykańskiego fizyka P. W. Bridgmana. Ma on szarą barwę i metaliczny połysk. Tym samym przypomina on grafit i podobnie jak on przewodzi prąd. Z tego względu jest badany pod kątem zastosowań w elektronice. Fosfor czarny topi się w temperaturze ok. (). Jest najbardziej trwałą odmianą fosforu. Posiada strukturę warstwową, w której każdy atom fosforu powiązany jest z trzema sąsiednimi atomami, kąty między wiązaniami wynoszą . Fosfor czarny, w porównaniu do pozostałych odmian alotropowych, posiada najgęstsze rozmieszczenie atomów w sieci przestrzennej.

Fosfor czarny można otrzymać z fosforu czerwonego i białego w wyniku ogrzewania. Stosując fosfor biały, należy wygrzewać go w temperaturze () pod ciśnieniem .
Słownik
(gr. állos „obcy”, „inny”, trópos „sposób”, „postać”) występowanie tego samego pierwiastka chemicznego w dwóch lub więcej odmianach, znajdujących się w tym samym stanie skupienia
zjawisko emisji fal świetlnych na skutek reakcji chemicznych
samorzutne zapoczątkowanie spalania, które nie wymaga inicjującego działania iskry elektrycznej lub płomienia
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Chmielewski H., Bańkowski Z., Gajewski W., Kowalski H., Encyklopedia techniki chemia, Warszawa 1965.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
Lindqvist S., A history of bombing, London 2001, s. 105.
