Przeczytaj
Tlen jest pierwiastkiem o liczbie atomowej 8, położonym w 2. okresie i 16. grupie układu okresowego pierwiastków. Jego podpowłokową konfigurację elektronową w stanie podstawowym można przedstawić w następujący sposób:

Budowa cząsteczki dwuatomowej tlenu
Tlen w przyrodzie praktycznie nie występuje w postaci atomowej, ale zazwyczaj w postaci cząsteczek dwuatomowych . Atomy tlenu, tworząc cząsteczkę , łączą się przy pomocy dwóch wiązań kowalencyjnych niespolaryzowanych. Dzięki temu każdy z atomów zyskuje oktet elektronowy – w cząsteczce tlenu każdy atom ma bowiem do dyspozycji, prócz swoich sześciu elektronów, dwa elektrony przekazane do wspólnych par przez drugi z atomów tlenu.
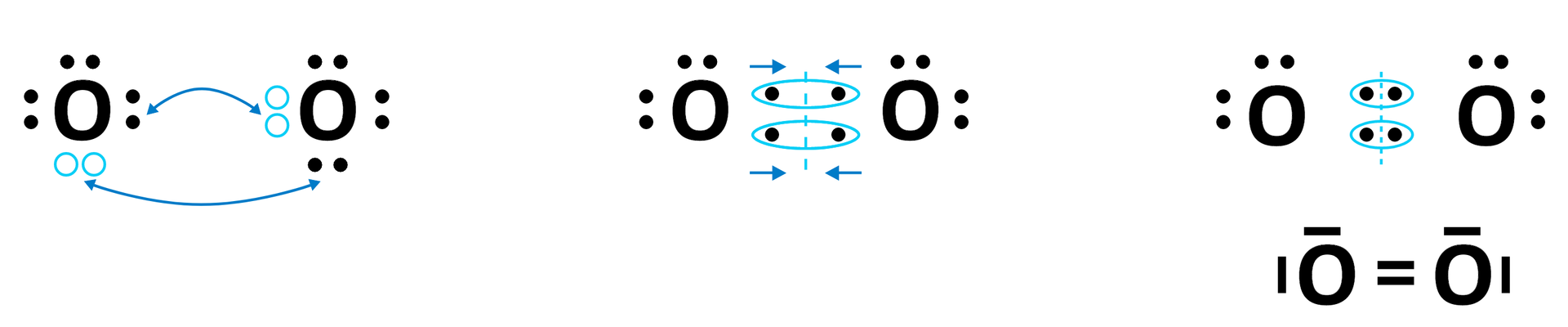
W wyniku takiego „uwspólnienia”, połączenie przybiera postać wiązania podwójnego .
Strukturę cząsteczki możemy zapisać wzorem elektronowym Lewisa:

Rozważmy tworzenie się cząsteczki tlenu w oparciu o teorię orbitali molekularnych (zakładamy, że oś jest osią łączącą jądra atomów).

Powstawanie orbitali cząsteczkowych w cząsteczce tlenu jest wynikiem nakładania się orbitali atomowych. Wyższe położenie orbitali oznacza wyższy poziom energii elektronów, które te orbitale zajmują. Aby rozważyć diagram poziomów energii orbitali molekularnych dla cząsteczki , należy na diagramie energetycznym umieścić elektronów walencyjnych (po sześć od każdego atomu ). Orbitale wypełniamy zgodnie ze znanymi nam zasadami – regułą Hunda i zasadą Pauliego. Wypełniamy diagram, zaczynając od orbitalu o najniższej energii. Do wypełnienia orbitali i potrzebne są dwa elektrony na każdy z orbitali, dwa kolejne elektrony są potrzebne do wypełnienia orbitalu , a do wypełnienia zdegenerowanych orbitali i są potrzebne łącznie cztery elektrony. Zgodnie z pierwszą zasadą Hunda, ostatnie dwa muszą być rozmieszczone na oddzielnych orbitalach z równoległymi spinami, co daje wielokrotność trzech (stan tripletowy) z dwoma niesparowanymi elektronami. Z diagramu można obliczyć rząd wiązania (RW):
Z diagramu wynika, że cząsteczka tlenu w stanie podstawowym zawiera dwa niesparowane elektrony, tzn. że wzór elektronowy cząsteczki tlenu nie zawiera wiązania podwójnego tylko pojedyncze, które ponadto posiada dwa niesparowane elektrony. W związku z tym model elektronowy cząsteczki powinien wyglądać inaczej:

Istnienie (dwurodnikowejdwurodnikowej) cząsteczki tlenu tzw. formy trypletowej , posiadającej dwa niesparowane elektrony, potwierdzono eksperymentalnie. To właśnie teoria orbitali molekularnych pozwoliła wytłumaczyć ten fakt.
Tlen, który ma dwa niesparowane elektrony (trypletowy), mógłby wejść w reakcję tylko z cząsteczką mającą również dwa niesparowane elektrony. Jednak większość cząsteczek posiada niestety elektrony sparowane, co ogranicza reaktywność tlenu. Znacznie bardziej reaktywna jest forma tlenu singletowego , która powstaje w wyniku wzbudzenia cząsteczek i przegrupowaniu się elektronów, tak by zostały one sparowane.

Tlen tworzy związki chemiczne z większością pierwiastków, a ich rodzaj zależy od właściwości pierwiastka, który wiąże się z tlenem.
Zastanów się i podaj przykłady dowolnego związku jonowego i kowalencyjnego tlenu.
Związki jonowe tlenu
Związki kowalencyjne tlenu
Słownik
związki tlenu z innymi pierwiastkami, w których tlen występuje na stopniu utlenienia
atom, cząsteczka lub fragment cząsteczki z co najmniej jednym niesparowanym elektronem, oznaczonym przy wzorze rodnika „”
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 943‑951.
Bartosz G., Druga twarz tlenu, Warszawa 1995, s. 17‑25.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 208‑240.
Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna. Część 1. Podręcznik dla liceum, Warszawa 2004, s. 51‑63.



