Przeczytaj
Wszelkie rozważania dotyczące właściwości tlenu, wynikających z jego konfiguracji elektronowej, należy rozpocząć od dokładnego jej zapisu.
Na podstawie analizy układu okresowego można stwierdzić, że tlen „leży” w jego 2. okresie i 16. grupie, a jego liczba atomowa wynosi 8. Co z tego wynika?
Drugi okres → atom ma „do dyspozycji” dwie powłoki elektronowe K (n = 1) oraz L (n = 2), złożone odpowiednio z podpowłok 1s (K) oraz 2s i 2p (L) (n – główna liczba kwantowa).
Liczba atomowa Z = 8 → atom „posiada” łącznie osiem elektronów.
16. grupa → 6 elektronów znajduje się na powłoce walencyjnejpowłoce walencyjnej.
Uwzględniając wszystkie powyższe informacje, konfigurację elektronową atomu tlenu w stanie podstawowym można przedstawić na diagramie energetycznym, stosując odpowiednie reguły obsadzania orbitali elektronami, czyli „zabudowy” powłok i podpowłok (reguła Hundareguła Hunda, zakaz Pauliegozakaz Pauliego).

Różnice w energiach orbitali, obliczonych w wyniku najprostszych obliczeń kwantowo‑mechanicznych, wynoszą odpowiednio: ok. 18,7 eV pomiędzy 1s i 2s oraz 0,75 eV pomiędzy 2s i 2p (1 eV ≈ 96,5 ). Można zatem zauważyć olbrzymią lukę energetyczną pomiędzy elektronami rdzenia atomu a elektronami powłoki walencyjnej.
Przedstaw konfigurację elektronową atomu tlenu w stanie podstawowym, stosując zapis pełny podpowłokowy, zapis graficzny („klatkowy”) oraz podpowłokowy skrócony z wykorzystaniem rdzenia gazu szlachetnego.
Opisz konfigurację elektronową atomu tlenu w stanie podstawowym w zapisie pełnym podpowłokowym, podpowłokowym skróconym z wykorzystaniem rdzenia gazu szlachetnego.
Zauważyć można, iż do osiągnięcia korzystniejszej energetycznie konfiguracji helowca, czyli pełnego zapełnienia powłoki walencyjnej L, „brakuje” dwóch elektronów, które powinny zostać „umieszczone” na podpowłoce 2p. Podpowłoka typu 2s jest już w pełni „zabudowana”.


Na podstawie analizy konfiguracji elektronowej można zatem powiedzieć, że:
minimalny stopień utlenieniastopień utlenienia tlenu wynosi -II; przyjęcie „dodatkowych” dwóch elektronów zachodzi „względnie łatwo” - tlen będzie zatem dobrym utleniaczem, samemu ulegając redukcji do formy . Przyjęcie należy rozumieć jako przyjęcie w sensie utworzenia jonu lub uwspólnienie elektronów;
teoretycznie maksymalny stopień utlenienia tlenu wynosi +VI; nie jest on jednak obserwowany, ponieważ oderwanie nawet jednego elektronu od atomu tlenu zachodzi niezmiernie rzadko; tlen w związkach z innymi pierwiastkami „osiąga” zatem najczęściej ujemne stopnie utlenienia.
„Łatwość” w oderwaniu bądź „przyłączeniu” elektronów można wyrazić poprzez odpowiednie wielkości fizyczne. I tak, energię potrzebną do oderwania jednego elektronu od atomu nazywa się I energią jonizacjiI energią jonizacji, natomiast energię wydzieloną przez przyłączenie „dodatkowego” elektronu do atomu – powinowactwem elektronowympowinowactwem elektronowym.

Na podstawie analizy powyższego zestawienia zauważyć należy, iż tlen spośród przedstawionych pierwiastków posiada drugą, co do wielkości wartość energii powinowactwa elektronowego (zaraz po fluorze), przy jednocześnie względnie wysokiej wartości energii jonizacji. Dane te pośrednio wskazują na optymalną drogę uzyskania przez tlen stabilnej konfiguracji elektronowej – uprzywilejowane będzie w tym wypadku przyłączenie dodatkowych elektronów.
Wiemy już zatem, że teoretycznie stopień utlenienia atomów tlenu powinien zawierać się w przedziale od -II do +VI. W praktyce jednak obserwuje się najczęściej stopnie utlenienia: -II (tlenki), -I (nadtlenki), -1/2 (ponadtlenki), (cząsteczka tlenu), I i II (związki z fluorem). Postarajmy się zatem znaleźć wytłumaczenie tej prawidłowości.
W tym celu rozważmy budowę cząsteczki ditlenu , złożonej z dwóch atomów tlenu. Tlen w przyrodzie występuje bowiem głównie w postaci cząsteczki dwuatomowej. Odbywa się to poprzez „uwspólnienie” czterech elektronów (po dwa na każdy atom).
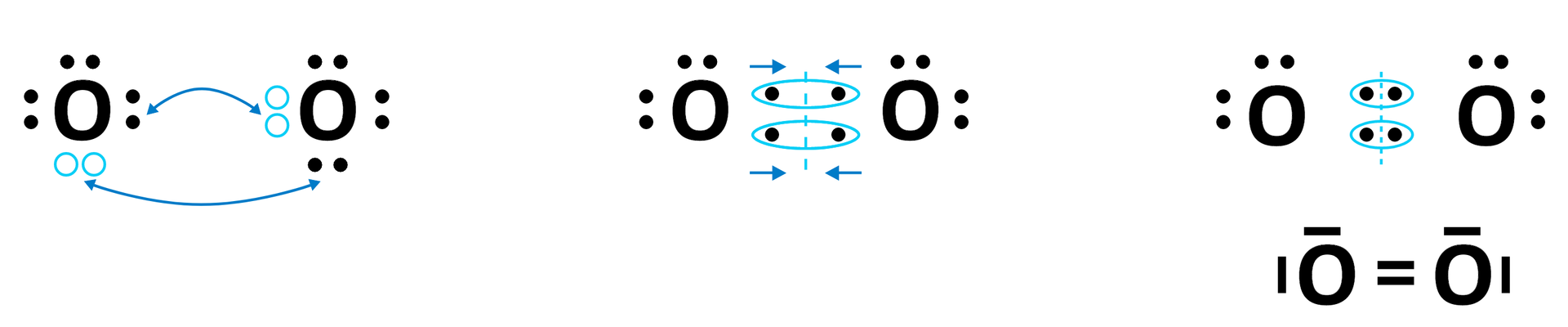
W wyniku takiego „uwspólnienia” połączenie przybiera postać wiązania podwójnego . Ze względu na „równy wkład” obu atomów do wiązania, stopień utlenienia tlenu w cząsteczce wynosi zero – elektrony nie są „przesunięte” w stronę żadnego z atomów.

Do zerwania wiązania , warunkującego zajście reakcji, potrzeba energii rzędu 500 . Dla porównania, zerwanie wiązania potrójnego w chemicznie biernej cząsteczce azotu wymaga dostarczenia ok. 950 , natomiast bardzo reaktywnego fluoru – tylko 150 . Wartości te tłumaczą chociażby fakt, iż do zainicjowania reakcji spalania często potrzeba dostarczyć początkowej porcji energii (np. w postaci iskry elektrycznej lub mechanicznego pocierania draski zapałki).
Dodatkowych informacji na temat właściwości cząsteczki tlenu dostarczyć może teoria orbitali molekularnych. W ujęciu kwantowo‑mechanicznym, poprzez efektywne nałożenie się walencyjnych orbitali atomowych, powstaną odpowiednie orbitale molekularne:
orbitale typu 2s, o symetrii sferycznej, nakładają się czołowo, tworząc orbital wiążący oraz antywiążący typu sigma;
para orbitali typu 2p także nałoży się czołowo, w wyniku czego powstanie orbital wiążący oraz antywiążący typu sigma;
pozostałe dwie pary orbitali typu 2p, poprzez nakładanie boczne, utworzą zestaw wiążących oraz antywiążących orbitali molekularnych typu pi.
W sposób zwięzły zestaw wyjściowych orbitali atomowych oraz powstały zbiór orbitali molekularnych przedstawić można graficznie na diagramie energetycznym.

„Zapełniając” poszczególne poziomy energetyczne zgodnie z regułami zabudowy, dojść można do dość ciekawej obserwacji – cząsteczka tlenu w stanie podstawowym posiada dwa niesparowane elektrony, obsadzające antywiążące orbitale typu pi. Ma zatem właściwości paramagnetyczneparamagnetyczne – w odróżnieniu od substancji diamagnetycznychdiamagnetycznych będzie oddziaływać z polem magnetycznym. Można o niej także powiedzieć, iż jest podwójnym rodnikiemrodnikiem, a cząsteczkę tlenu występującą w tej formie określa się tlenem trypletowym.
Warto jednak dodać, że istnieje również forma tlenu, w której nie występują niesparowane elektrony i nazywa się ją tlenem singletowym. Diagram energetyczny dla tlenu singletowego prezentuje się następująco:
![Na ilustracji znajduje się diagram energetyczny przedstawiający zestaw wyjściowych orbitali atomowych oraz powstały zbiór orbitali molekularnych w wyniku nałożenia się walencyjnych orbitali atomowych dla tlenu singletowego. Konfiguracja elektronowa atomu tlenu: [He] 2s22p4 Atom tlenu ma dwa elektrony na orbitalu 2s. Wynika z tego obsadzenie dwoma elektronami orbitalu σ 2 s − 2 s i σ ∗ 2 s − 2 s dwoma elektronami (orbital o wyższej energii). Wyżej energetyczne są orbitale 2p. W przypadku atomu tlenu dwa pojedyncze elektrony znajdują się na orbitalu 2pz oraz 2py, a na orbitalu 2px znajdują się dwa elektrony. Wynika z tego obsadzenie dwoma elektronami orbitalu: σ 2 p x − 2 p x . Dwa elektrony znajdują się na orbitalu π 2 p y − 2 p y i π 2 p z − 2 p z . Mają one tę samą energię. Powyżej znajdują się orbitale π ∗ 2 p y − 2 p y na którym znajdą się dwa elektrony i π ∗ 2 p z − 2 p z , na którym nie ma żadnych. Najwyższą energię ma orbital antywiążący σ ∗ 2 p x − 2 p x i jest on nieobsadzony.](https://static.zpe.gov.pl/portal/f/res-minimized/R1ethgd3cyNIk/1642516234/1b5Jl2IndXpVZ0FIn3zCMpRs2tguBBNe.png)
Okazuje się jednak, że w tej formie energia cząsteczki tlenu jest wyższa niż dla tlenu trypletowego. Z tego powodu tlen singletowy charakteryzuje się mniejszą stabilnością, dlatego w przyrodzie występuje naturalnie w znikomych ilościach.
Większość cząsteczek organicznych w stanie podstawowym posiada wszystkie elektrony sparowane. Stanowi to pewną formę „zabezpieczenia” przed działaniem tlenu, posiadającego w swojej trwałej odmianie dwa elektrony niesparowane. Zaobserwować można także mniej stabilną formę tlenu, zwaną singletową, w której dwa elektrony na orbitalach pi są sparowane. W tym stanie jest ona jednak wysoce niestabilna i łatwiej ulega reakcjom. Powrót takiej formy wzbudzonej do formy podstawowej może odbywać się przez spontaniczną emisję światła o kolorze czerwonym, co często wykorzystywane jest w pokazach chemicznych. Wzbudzenie, wywołane pochłonięciem światła, skutkuje natomiast niebieskawą barwą ciekłego tlenu.
Ze względu na niezapełnione orbitale typu pi* oraz sigma* („wolne miejsce”), cząsteczka tlenu może „przyjąć” dodatkowe elektrony – posiada zatem właściwości utleniające. W wyniku takiego działania każdy z atomów tlenu ulegnie redukcji kolejno do stopnia utlenienia równego , -I i ostatecznie -II.
Można się w tym miejscu zastanowić, dlaczego atomy tlenu, które już formalnie posiadają konfigurację gazu szlachetnego, „chcą przyjmować” kolejne elektrony. Szkic odpowiedzi postaramy się przedstawić na możliwie najprostszym przypadku nadtlenku jonowego (w wiązaniach jonowych elektrony są bowiem „przekazywane”, a nie „uwspólnianie”).
Dodajmy zatem do „stabilnej” struktury dwa atomy potasu. Każdy z nich, celem uzyskania stabilnej konfiguracji, jest skłonny „oddać” po jednym elektronie, jednakże potencjalni biorcy posiadają już korzystny energetycznie stan. Wobec tak „hojnej propozycji”, silnie elektroujemne atomy tlenu „rozseparowują” („zrywają uwspólnienie”) jedną z uprzednio utworzonych par elektronowych (wiązań), dzięki czemu są zdolne do „przyjęcia” jeszcze po jednym elektronie.

Sumarycznie na każdy atom tlenu przypada wówczas jeden dodatkowy elektron. Stopień utlenienia tlenu w nadtlenkach (także kowalencyjnych – elektrony są wówczas „uwspólniane”, a nie „oddawane”, jak w przypadku wiązań jonowych) wynosi zatem -I.
W przypadku ponadtlenku potasu (), schemat przepływu elektronów jest dość podobny. Atom potasu, chcąc osiągnąć stabilną konfigurację gazu szlachetnego, „oddaje” jeden elektron cząsteczce , na skutek czego na każdy atom tlenu formalnie przypada „pół” elektronu – stopień utlenienia tlenu w ponadtlenkach wynosi wobec tego .
Skoro cząsteczka tlenu, przyjmując kolejne elektrony, ulega redukcji, zastanówmy się zatem, czemu w tlenkach nie występuje ugrupowanie , któremu odpowiada formalny stopień utlenienia -II. W tym celu posłużmy się znów diagramem orbitali molekularnych dla cząsteczki ditlenu.

Jak widzimy, „nadmiarowe” elektrony lokowane są na orbitalach o charakterze antywiążącym (oznaczone symbolem *), niekorzystnych energetycznie. Oznacza to, iż dodatek każdego kolejnego elektronu „osłabia” stabilność wyjściowej struktury . Dlatego też, nadtlenki i ponadtlenki należą do substancji bardzo reaktywnych i względnie mało stabilnych.
Uwaga! Wraz ze wzrostem liczby „nadmiarowych” elektronów, atomy tlenu w powyższych jonach wykazują coraz większe właściwości redukujące, samemu chcąc utlenić się do stabilnych form.
Na podstawie powyższego diagramu energetycznego orbitali oblicz rzędy wiązań w cząsteczce tlenu oraz poszczególnych jej jonach. Następnie odpowiedz na pytanie: czy wobec tego jon może istnieć?
Obecnie wiele badań dotyczy praktycznego wykorzystania tzw. reaktywnych form tlenu, czyli takich jego postaci, które wyjątkowo łatwo ulegają licznym reakcjom chemicznym. Wśród przykładów można tu wymienić chociażby rodnik hydroksylowy czy nadtlenek wodoru . W efekcie, te „ekologiczne” cząsteczki występują bowiem naturalnie w przyrodzie, wchodząc w reakcje
z otoczeniem, w którym się znajdują, ulegając tym samym reakcjom utlenienia‑redukcji. Otoczeniem tym często są węglowodory, ulegające, na skutek takiego działania, rozkładowi do prostych, nieszkodliwych produktów. Reaktywne formy tlenu mogą zatem być (i są) z powodzeniem wykorzystywane chociażby do oczyszczania wody z zabrudzeń pochodzenia organicznego.
Wszystkie wymienione do tej pory stopnie utlenienia tlenu były ujemne. Jak już wspomnieliśmy, tlen posiada znaczną wartość energii powinowactwa elektronowego – odnosi zatem znaczną korzyść z „dołączania” kolejnych elektronów.
Mówiąc o „dołączaniu” elektronów, posługujemy się jednak pewnym skrótem myślowym. „Pełne przekazanie” elektronu od jednego atomu do drugiego zachodzi w wiązaniach o charakterze jonowym (jak w ). W przypadku wiązań kowalencyjnych spolaryzowanych, mówimy o przesunięciu „uwspólnionych” w postaci wiązania elektronów w stronę bardziej elektroujemnego z atomów. Przykład niech stanowi mechanizm powstawania cząsteczki wody z atomów.

Niech ostatnim punktem rozważań będzie zatem pytanie, czy istnieją jednak połączenia, w których atom tlenu posiada dodatni stopień utlenienia? Pytanie to można sformułować także w nieco bardziej sugestywny sposób – czy istnieje pierwiastek, który byłby w stanie „pozbawić” atom tlenu jego elektronu?
Rozwiązanie zagadki stanowi fluor. Ze względu na najwyższą wartość elektroujemności w całym układzie okresowym, atom fluoru jest w stanie „przesunąć” elektrony atomu tlenu „w swoją stronę”. Należy jednak pamiętać, że nadal jest to połączenie kowalencyjne spolaryzowane, nie jonowe.
Dwoma związkami stanowiącymi swego rodzaju wyjątek, w których atom tlenu przyjmuje dodatni stopień utlenienia, są difluorek tlenu (st. utlenienia tlenu +II) oraz difluorek ditlenu (stopień utlenienia tlenu +I).


Bardzo reaktywną odmianą alotropową tlenu jest ozon, zbudowany z trzech atomów tlenu (). W stanie gazowym ma niebieską barwę, a jego zapach przypomina woń powietrza po burzy. Powstaje na skutek promieniowania UV o długości fali mniejszej niż 242 nm, oddziałującego na cząsteczki ditlenu (), w wyniku czego następuje ich rozpad na dwa atomy tlenu. Następnie reagują one z tlenem cząsteczkowym, doprowadzając do utworzenia cząsteczki ozonu ().
Odmianą alotropową tlenu jest także tetratlen, który nazywany jest ,,czerwonym tlenem''. Powstaje przy ciśnieniu 20 GPa, kiedy cząsteczki tlenu oddziałują ze sobą, tworząc cząsteczkę .
Słownik
zasada kwantowo‑mechaniczna, określająca porządek lokowania elektronów na orbitalach mających najniższą energię w taki sposób, aby jak największa liczba elektronów pozostała niesparowana
zasada kwantowo‑mechaniczna, mówiąca o tym, iż na jednym orbitalu nie mogą znaleźć się dwa elektrony o tym samym spinie
hipotetyczny ładunek, jaki posiadałby dany atom w cząsteczce, gdyby wszystkie wiązania miały charakter jonowy
energia potrzebna do usunięcia (wybicia) jednego elektronu z chmury elektronowej atomu lub cząsteczki
energia, która wydziela się na skutek przyłączenia jednego dodatkowego elektronu do chmury elektronowej atomu/ cząsteczki
drobina chemiczna, posiadająca co najmniej jeden niesparowany elektron
cząsteczka oddziałująca efektywnie z polem magnetycznym, często na skutek posiadania niesparowanych elektronów, czyli niezerowego spinu
cząsteczka nieoddziałująca w efektywny sposób z polem magnetycznym (nie przyciągana przez magnes), często na skutek braku niesparowanych elektronów
najdalej odsunięta od jądra atomu powłoka elektronowa; osadzone na niej elektrony (zwane elektronami walencyjnymi) są najsłabiej związane z atomem, dzięki czemu biorą udział w tworzeniu wiązań chemicznych
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012, wyd. 6.
Glavas S., Toby S., Reaction between ozone and hydrogen sulfide, „The Journal of Physical Chemistry”, 1975, t. 79, s. 779‑782.
Mizerski W., Tablice Chemiczne, Warszawa 2013.
Olszyna K. J., Heicklen J., The Reaction of Ozone with Ammonia, „Advances in Chemistry”, 1972, t. 113, s. 191‑210.
Plass R. i inni, Cyclic Ozone Identified in Magnesium Oxide (111) Surface Reconstructions, „Physical Review Letters” 1998, t. 81, s. 4891‑4894.
Sichel J. M., CNDO‑MO Study of the Ozonide Ion and Related Species, „Journal of Chemistry” 1973, t. 51, s. 2124‑2128.
Temple Researcher Attempting To Create Cyclic Ozone, ScienceDaily. Temple University 2005, online: http://www.sciencedaily.com/releases/2005/02/050205122519.htm, dostęp: 06.10.2021.
