Przeczytaj
Gdzie występuje wiązanie metaliczne?
Metale stanowią najliczniejszą grupę pierwiastków w układzie okresowym pierwiastków chemicznych.

Wśród pierwiastków metalicznych wyróżnić można:
metale alkaliczne (1. grupa układu okresowego);
metale ziem alkalicznych (2. grupa układu okresowego);
pierwiastki bloku d;
lantanowce i aktynowce;
metale bloku p.
Łącznie w układzie okresowym występuje 86 pierwiastków metalicznych, w których wiązaniem chemicznym odpowiadającym za szereg właściwości tych metali jest wiązanie metalicznewiązanie metaliczne. Oznacza to, że zarówno w czystej próbce miedzi, jak i próbce glinu jedynym wiązaniem jest wiązanie metaliczne. Warto nadmienić, że pojęcie wiązania metalicznego stosowane jest dla scharakteryzowania wiązania chemicznego, obecnego w stopach metalistopach metali (np. brąziebrązie, mosiądzumosiądzu). Poniżej przedstawiono przykłady obecności sieci metalicznej w różnych przedmiotach.
Cechy wiązania metalicznego
Wiązanie metaliczne jest słabsze niż wiązanie jonowe lub kowalencyjne. Energia wiązaniaEnergia wiązania metalicznego mieści się w granicach od 1 eV do 8 eV w przeliczeniu na atom.
Przykład:
1. grupa, energia wiązania – 1 eV;
2. grupa, energia wiązania 1,5 – 2,0 eV;
metale bloku d, energia wiązania 3 – 8 eV.
W tabeli poniżej podano wartości energii wiązania dla wybranych metali w jednostce oraz .
Metal | Energia wiązania | |
|---|---|---|
68 | 0,7 | |
324 | 3,4 | |
406 | 4,2 | |
859 | 8,8 | |
Indeks górny Źródło: William D. Callister Jr. , David G. Rethwisch, Materials Science and Engineering: An Introduction, 8th Edition, USA 2009, p. 31. Indeks górny koniecŹródło: William D. Callister Jr. , David G. Rethwisch, Materials Science and Engineering: An Introduction, 8th Edition, USA 2009, p. 31.
Siła wiązania metalicznego zależy od:
liczby elektronów ulegających delokalizacji – im więcej elektronów w chmurze elektronowej, tym wiązanie jest silniejsze. Metale przejściowe mogą zaangażować elektrony 3d w delokalizację, jak również 4s. Zatem wiązania w metalach przejściowych są silniejsze niż w metalach alkalicznych.
ładunku kationu – im wyższy, tym silniejsze przyciąganie między elektronami, które ulegają delokalizacji, a jonami metali. Jeśli weźmiemy pod uwagę takie pierwiastki, jak magnez i sód, to zauważymy, że magnez tworzy jony dwudodatnie, a sód jednododatnie. Zatem w magnezie występuje silniejsze oddziaływanie pomiędzy kationami a elektronami chmury elektronowej.
Kryształy metaliczne
Na skutek delokalizacji elektronów sieć krystaliczna w metalach przyjmuje postać trójwymiarową. W węzłach sieci krystalicznej usytuowane są kationy metalu, natomiast elektrony chmury elektronowej poruszają się swobodnie pomiędzy kationami.
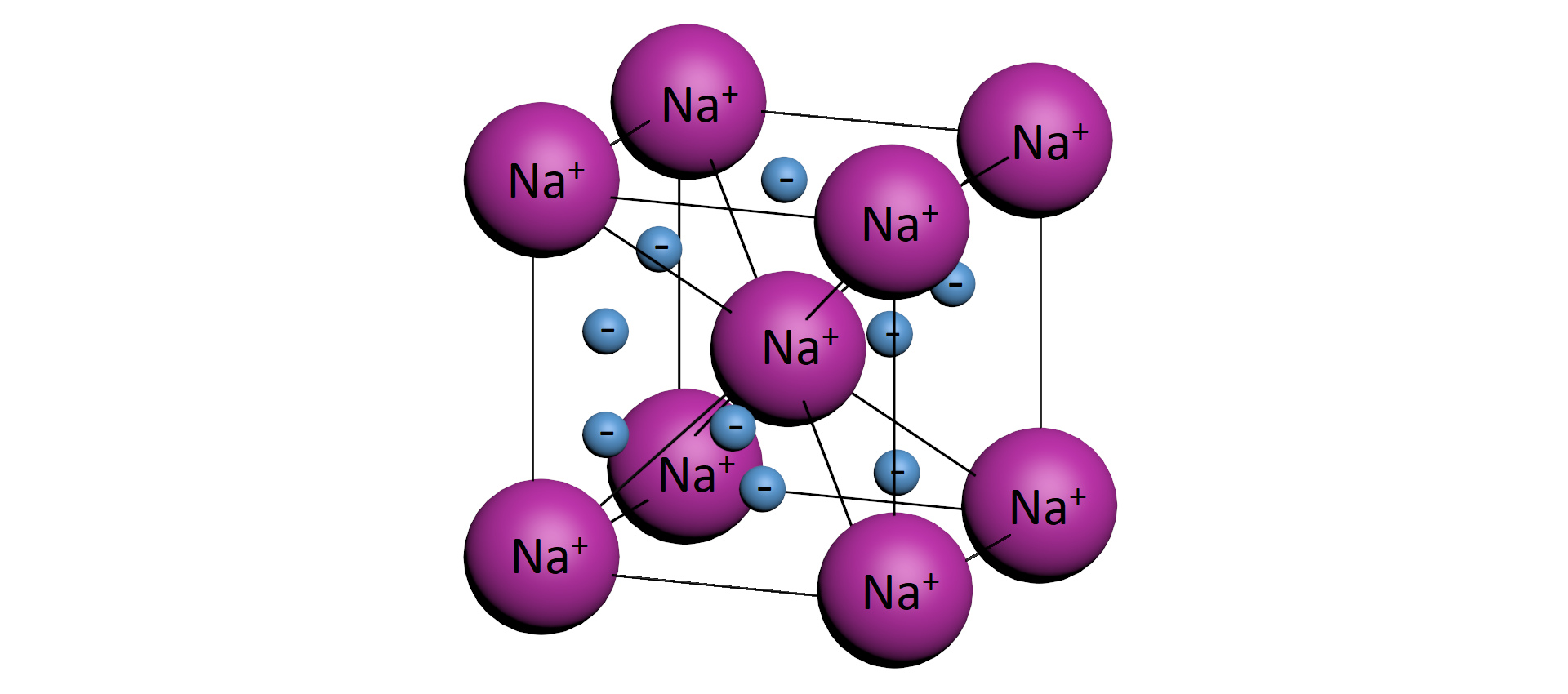
Kryształy metaliczneKryształy metaliczne są elektrycznie obojętne, ponieważ gaz elektronowygaz elektronowy równoważy dodatni ładunek rdzenia atomowego (kationów).
Słownik
zdelokalizowane elektrony otaczające kationy metali w sieci krystalicznej metalu lub stopu
elektrostatyczne oddziaływanie (bezkierunkowe) jonów dodatnich metali i elektronów walencyjnych, które, poruszając się w całej objętości metalu, tworzą tzw. gaz elektronowy
elektrony, które występują na zewnętrznych powłokach elektronowych atomu (wyjątki blok d i f), zajmują orbitale o największej energii (dla danego pierwiastka), biorą udział w tworzeniu wiązań chemicznych i decydują o właściwościach chemicznych pierwiastka
krystaliczne ciało stałe, w którym rdzenie atomowe są utrzymywane razem przez gaz elektronowy należący do całej sieci krystalicznej
jednorodna mieszanina dwóch lub więcej metali lub metalu z innymi pierwiastkami niemetalicznymi
stop miedzi z cyną o procentowej zawartości masowej miedzi (80‑90%)
stop miedzi i cynku o procentowej zawartości masowej cynku (10–45%)
najmniejsza ilość energii, jaką należy dostarczyć aby rozerwać wiązanie; energię wiązania wyraża się w elektronowoltach w przeliczeniu na atom lub jako jednostkę energii na jednostkę liczności materii
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 1‑2 , Warszawa 2010.
Callister W, D., Rethwisch D. G., Materials Science and Engineering: An Introduction, 8th Edition, USA 2009.
Cox P. A., Chemia nieorganiczna. Krótkie wykłady, Warszawa 2012.
Taber K., Teaching Secondary Chemistry, 2nd Edition, London 2012.
Metlic Bonding, online: https://chem.libretexts.org/Courses/Northern_Alberta_Institute_of_Technology/CHEM1130_Principles_in_Chemistry_I/3%3A_Chemical_Bonding._Solubility/3.9%3A_Metallic_Bonding, dostęp: 11.05.2021.
Moebs W., Ling S. J., Sanny J., Wiązania w ciałach stałych [w:] Fizyka dla szkół wyższych, t. 3, 2018, online: https://cnx.org/contents/u2KTPvIK@4.5:zXYdgkJ4@3/9-3-Wi%C4%85zania-w-cia%C5%82ach-sta%C5%82ych, dostęp: 11.05.2021.


