Przeczytaj
Reakcje nieodwracalne
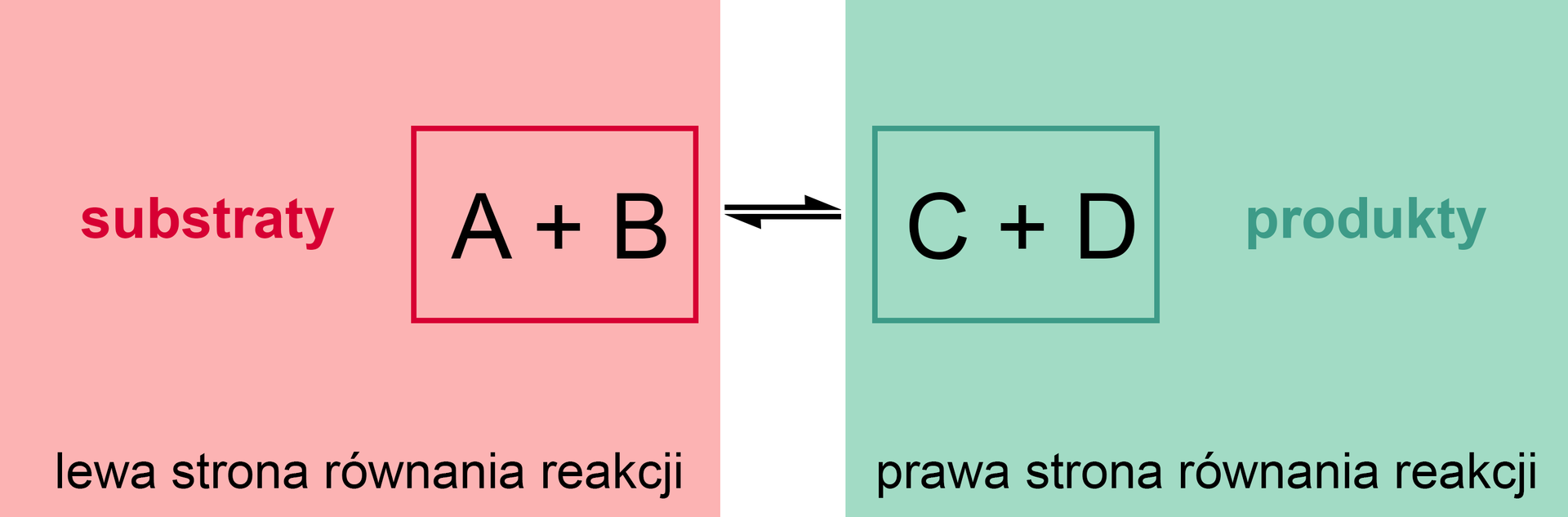
Przeważnie zapis równań reakcji chemicznych polega na umieszczeniu wzorów substratów reakcji po lewej stronie strzałki reakcji, a wzorów produktów po prawej stronie. Reakcja chemiczna więc, w ujęciu równania, jest to proces, który przebiega od lewej do prawej strony. Taki zapis odpowiada reakcjom nieodwracalnymreakcjom nieodwracalnym, trwającym do samego końca, tj. do wyczerpania substratu. Wówczas w równaniu stechiometrycznym reakcjistechiometrycznym reakcji stawia się strzałkę w jednym kierunku. Z praktycznego punktu widzenia wcale nie jest tak łatwo odnaleźć reakcje nieodwracalne. Przy założeniu, że przebiegają w układzie zamkniętymukładzie zamkniętym, zawsze może następować odtwarzanie substratów kosztem wydajności produktów. Dla uproszenia, gdy reakcja między nowo powstałymi produktami przebiega w znacznie mniejszym stopniu, niż ta między substratami, to w reakcji umieszcza się jedną strzałkę (w prawo). Przykładem tego może być synteza chlorku potasu.
W przypadku powyższej reakcji – będącej przykładem reakcji kwasu solnego (chlorowodorowego) z wodorotlenkiem potasu – mamy do czynienia z powstaniem soli i wody. Reagują one w znacznie mniejszym stopniu niż ze sobą substraty, dlatego dla tej reakcji odwracalność można pominąć.
Innymi przykładami reakcji nieodwracalnych są reakcje strącania, w wyniku których otrzymuje się nierozpuszczalne osady bądź reakcje przebiegające w układzie otwartymukładzie otwartym, gdzie część reagentów może opuszczać przestrzeń reakcyjną, jak np. reakcja magnezu z kwasem solnym, z czego wydziela się wodór.
Reakcje odwracalne
Inna sytuacja ma miejsce w przypadku reakcji odwracalnychreakcji odwracalnych – nie biegną one do samego końca, lecz w trakcie ich przebiegu równolegle tworzone są cząsteczki produktów i odtwarzane cząsteczki substratów. Wówczas, w równaniu stechiometrycznym reakcji, stosuje się dwie przeciwnie skierowane strzałki. Przykładami takich reakcji są: reakcje estryfikacji, reakcje dysocjacji elektrolitycznej słabych elektrolitów oraz, przy założeniu układu zamkniętego, synteza jodowodoru lub synteza amoniaku, przedstawiona poniżej.
Czy wiesz, w jaki sposób Napoleon Bonaparte przyczynił się do odkrycia odwracalności reakcji chemicznych? W 1798 r. zwerbował do udziału w swojej kampanii wybitnego francuskiego chemika, Claude'a Louisa Bertholleta. Badacz, obserwując egipskie jeziora, zauważył osadzający się węglan sodu na jego brzegach. Opierając obserwacje o swoją wiedzę, zdał sobie sprawę, że węglan sodu musi powstawać właśnie w wyniku reakcji odwracalnej otrzymywania węglanu wapnia.
Przykłady reakcji odwracalnych:
W przemianach fizycznych zachodzą również procesy odwracalne, jest to np. parowanie bromu, w wyniku którego ze stężonego roztworu wydzielany jest gazowy brom, i odwrotnie – jego skondensowane opary powodują ponowne skraplanie ciekłego bromu.
Równowaga chemiczna
Analizując poniższy przykład reakcji odwracalnej – syntezy amoniaku – zauważa się, że w wyniku reakcji cząsteczek wodoru i cząsteczek azotu tworzone są cząsteczki amoniaku.
W miarę upływu czasu reakcji, stężenie cząsteczek substratów zaczyna maleć i reakcja biegnie wolniej. Inaczej zaś sytuacja wygląda dla dużej ilości cząsteczek produktu, które, zderzając się ze sobą, odtwarzają cząsteczki substratów. Trwa to do czasu zrównania się tych dwóch szybkości reakcji. Wtedy stężenia substratów i produktów są stałe, a takie zjawisko nazwane jest stanem równowagi dynamicznej. Ustalenie stanu równowagi reakcji nie oznacza, że reakcja została zahamowana. Procesy tworzenia i rozpadu cząsteczek ciągle następują, jednak posiadają takie same szybkości.
Równowaga chemicznaRównowaga chemiczna jest procesem dynamicznym, czyli takim, dla którego ciśnienie i temperatura nie ulegają zmianie. Z powyższym zjawiskiem jest związana ważna wielkość – stała równowagi reakcji. Jest ona równa ilorazowi iloczynu stężeń produktów do iloczynu stężeń substratów (podniesionych do potęg zgodnych ze współczynnikami stechiometrycznymi), które zostały zmierzone w stanie równowagi.
Dla powyższej reakcji stała równowagi reakcjistała równowagi reakcji K ma postać:
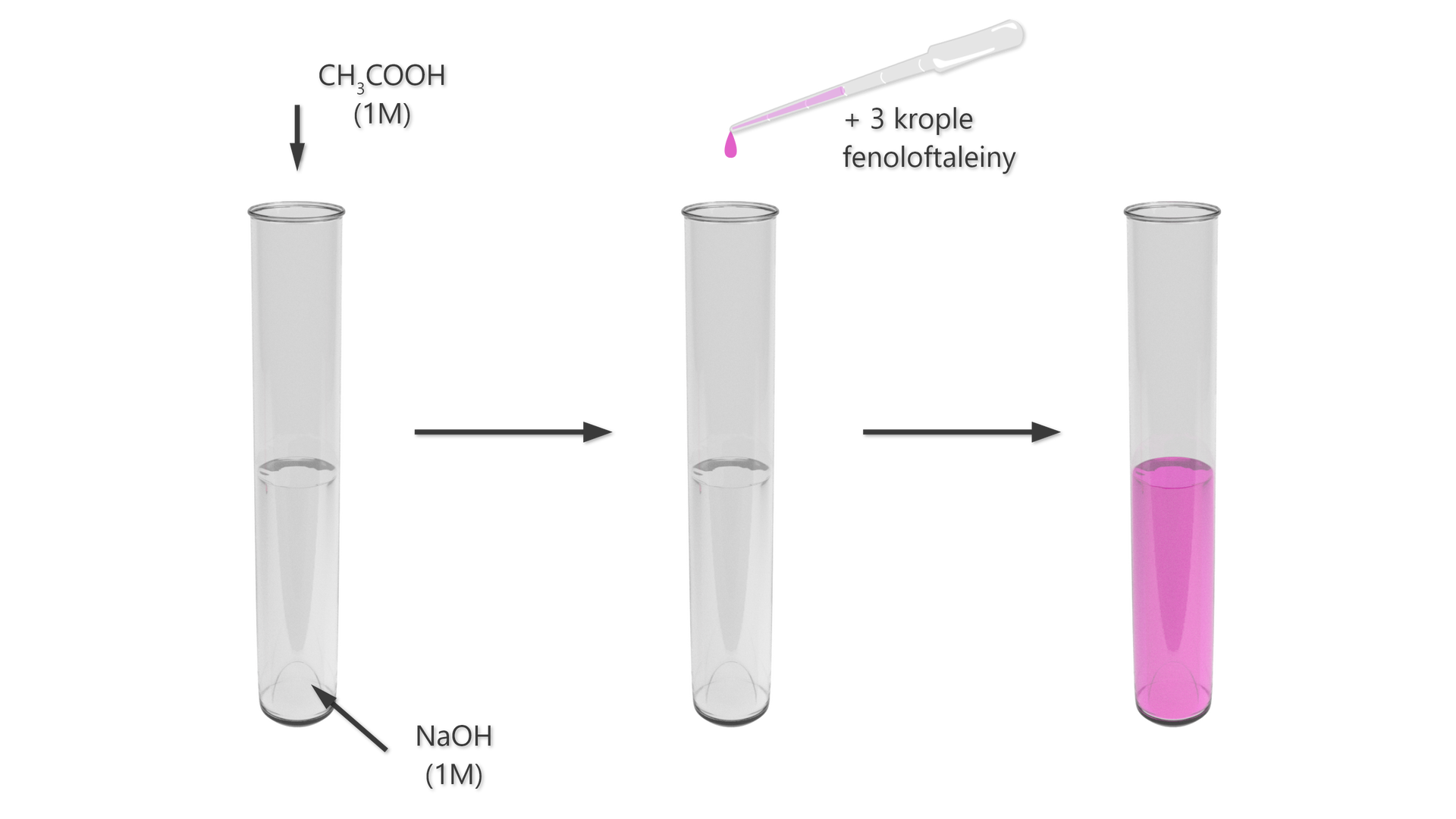
Zapoznaj się z poniższym doświadczeniem. Uzupełnij hipotezę, obserwacje oraz wnioski.
Doświadczenie nr 1
Schemat:
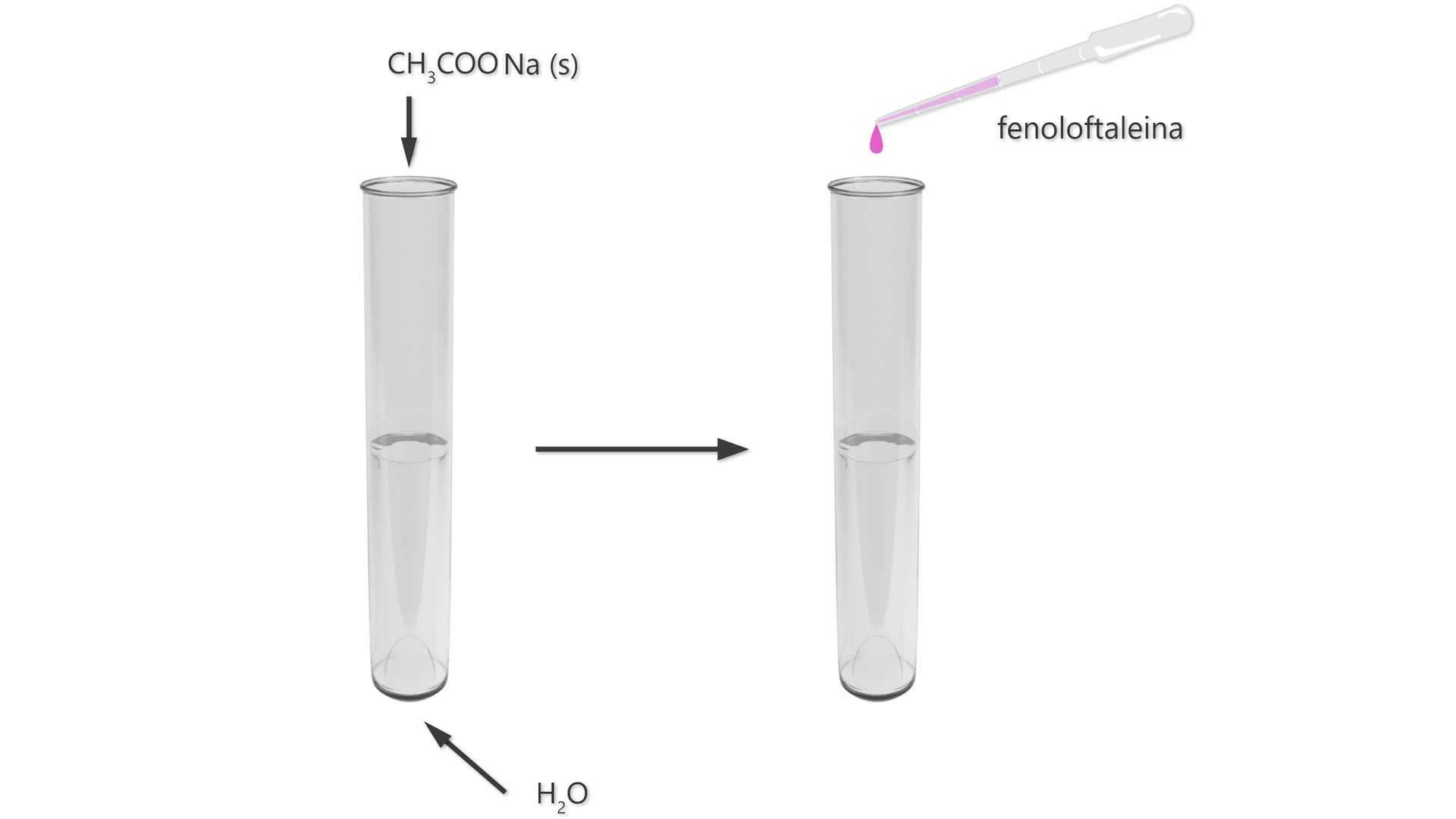
Zapoznaj się z poniższym doświadczeniem. Uzupełnij problem badawczy, obserwacje oraz wnioski.
Doświadczenie nr 2
Schemat:
Słownik
stan, do którego dąży układ reakcyjny w trakcie przebiegu reakcji odwracalnej
reakcja przebiegająca tylko w jednym kierunku
reakcja, która przebiega w obu kierunkach celem osiągnięcia stanu równowagi
współczynnik opisujący stan równowagi reakcji odwracalnych; jest on równy ilorazowi iloczynu stężeń produktów do iloczynu stężeń substratów (podniesionych do potęg zgodnych ze współczynnikami stechiometrycznymi), które zostały zmierzone w stanie równowagi
zapis przebiegu reakcji chemicznej, uwzględniający stechiometryczne ilości substratów i produktów reakcji (ilość odpowiednich pierwiastków po lewej stronie jest równa tej po prawej stronie)
układ reakcyjny, który może wymieniać z otoczeniem materię i energię
układ, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z otoczeniem energię
układ, który nie może i nie wymienia z otoczeniem ani materii, ani energii
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa, 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia, 2005.
www.openstax.org/books/chemistry‑atoms‑first‑2e/pages/13‑introduction 6 [dostęp 12.11.2020].
www.chem1.com/acad/webtext/chemeq/Eq‑01.html#NAP [dostęp 12.11.2020].


