Przeczytaj
Budowa formaldehydu (metanalu)
Formaldehyd (metanal) posiada w cząsteczce grupę funkcyjnągrupę funkcyjną – grupę aldehydową (formylową), a więc należy do grupy związków określanych jako aldehydy.
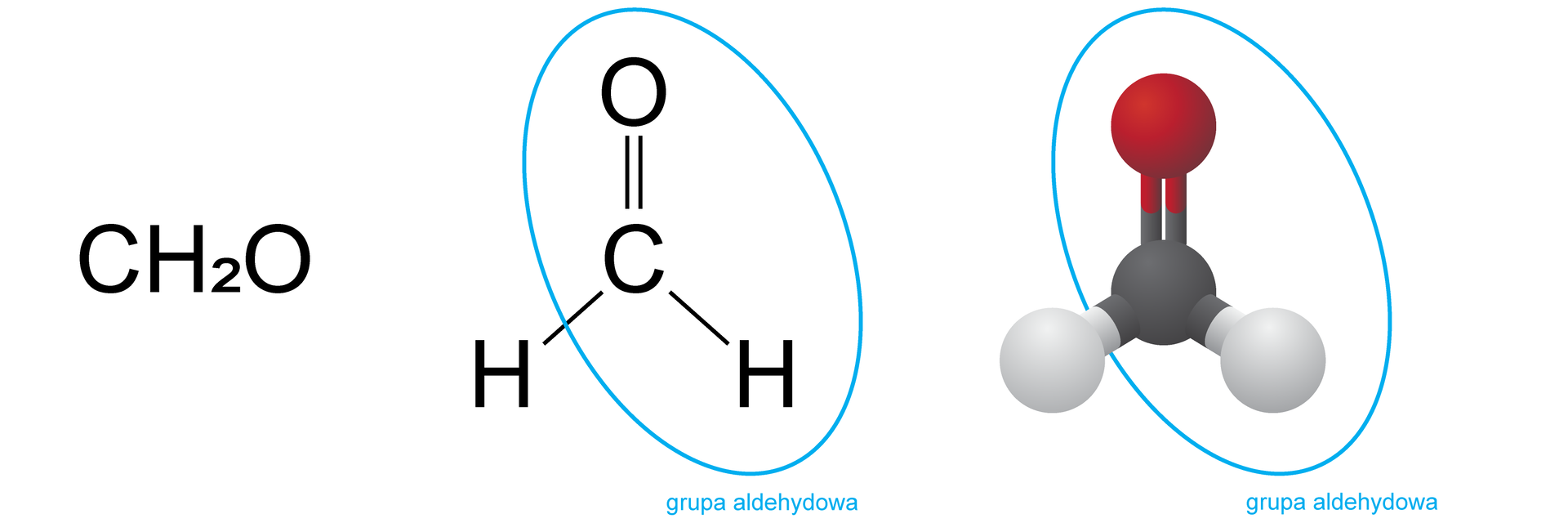
Dzięki obecności grupy aldehydowej, metanal ulega reakcjom z amoniakalnym tlenkiem srebra(I) (próba Tollensa) oraz wodorotlenkiem miedzi(II) (próba Trommera).
Badanie właściwości redukujących formaldehydu (metanalu)
Zapoznaj się z poniższym doświadczeniem dotyczącym badania właściwości redukującychwłaściwości redukujących formaldehydu. Uzupełnij puste miejsca w dzienniku laboratoryjnym.
Doświadczenie 1 – badanie właściwości redukujących metanalu
Schemat doświadczenia:


Wnioski:
W wyniku reakcji azotanu(V) srebra(I) z wodorotlenkiem sodu powstaje nierozpuszczalny wodorotlenek miedzi(II):
Tlenek srebra(I) reaguje z wodą amoniakalną, tworząc odczynnik Tollensa – związek kompleksowyzwiązek kompleksowy o nazwie wodorotlenek diaminasrebra(I). Równanie zostało zapisane w formie jonowej:
Odczynnik Tollensa reaguje z formaldehydem (metanalem) – zapis jonowy skrócony:
W celu uproszczenia przyjmuje się, że formaldehyd reaguje z tlenkiem srebra(I). Wówczas reakcja uproszczona wygląda następująco:
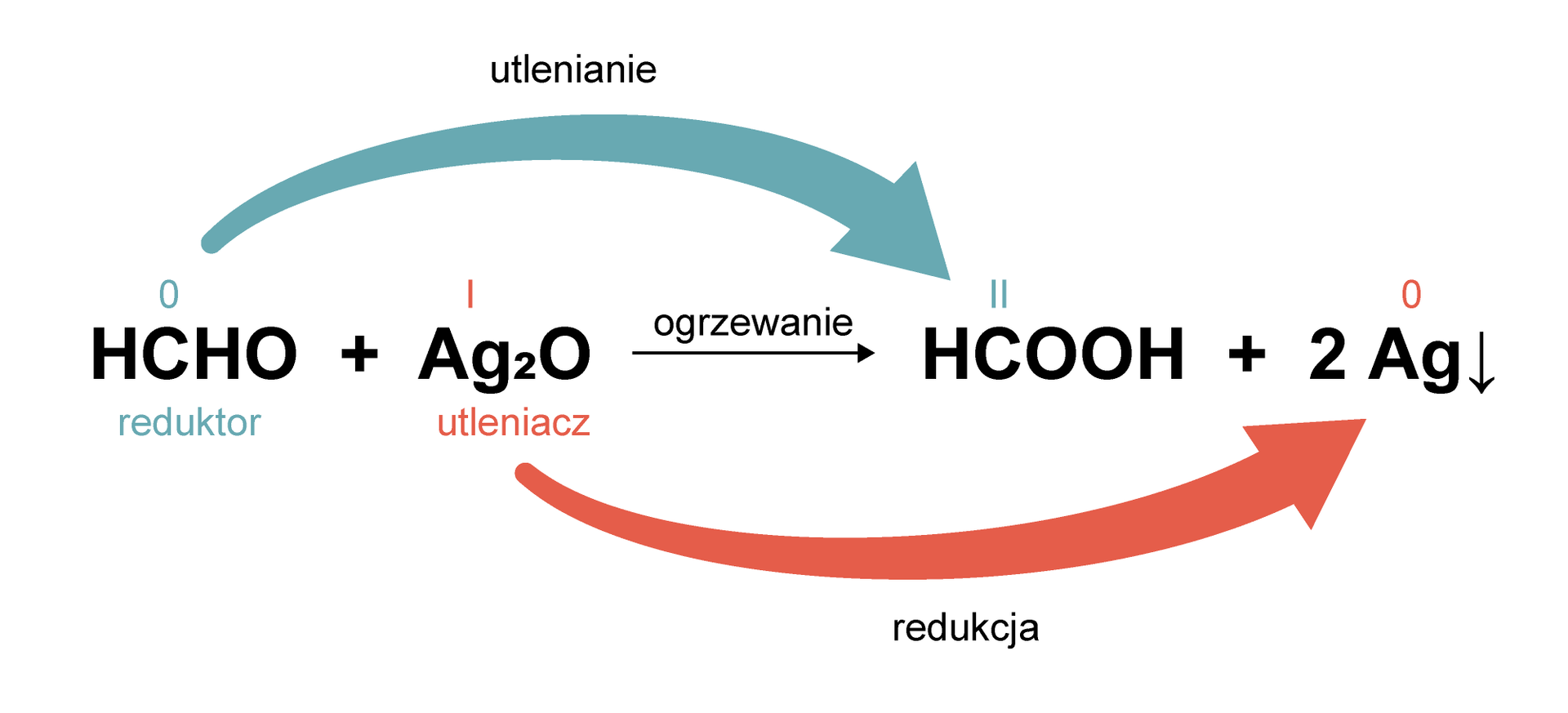
Atom węgla grupy aldehydowej w cząsteczce formaldehydu (metanalu) zwiększa swój stopień utlenienia z 0 na II, czyli ulega reakcji utlenianiareakcji utleniania, będąc reduktoremreduktorem. Z kolei atom srebra w cząsteczce tlenku srebra(I) zmniejsza swój stopień utlenieniastopień utlenienia z I na 0, czyli ulega reakcji redukcjireakcji redukcji, pełniąc rolę utleniaczautleniacza. Formaldehyd posiada właściwości redukujące, o czym świadczy pozytywny wynik próby Tollensa.
Próba Tollensa jest wykorzystywana przy nanoszeniu srebrnej warstwy m.in. na ozdoby choinkowe. Zapoznaj się z poniższym doświadczeniem dotyczącym badania właściwości redukujących formaldehydu. Uzupełnij puste miejsca dziennika laboratoryjnego.

Doświadczenie 2 – badanie właściwości redukujących formaldehydu (metanalu)
Schemat doświadczenia:
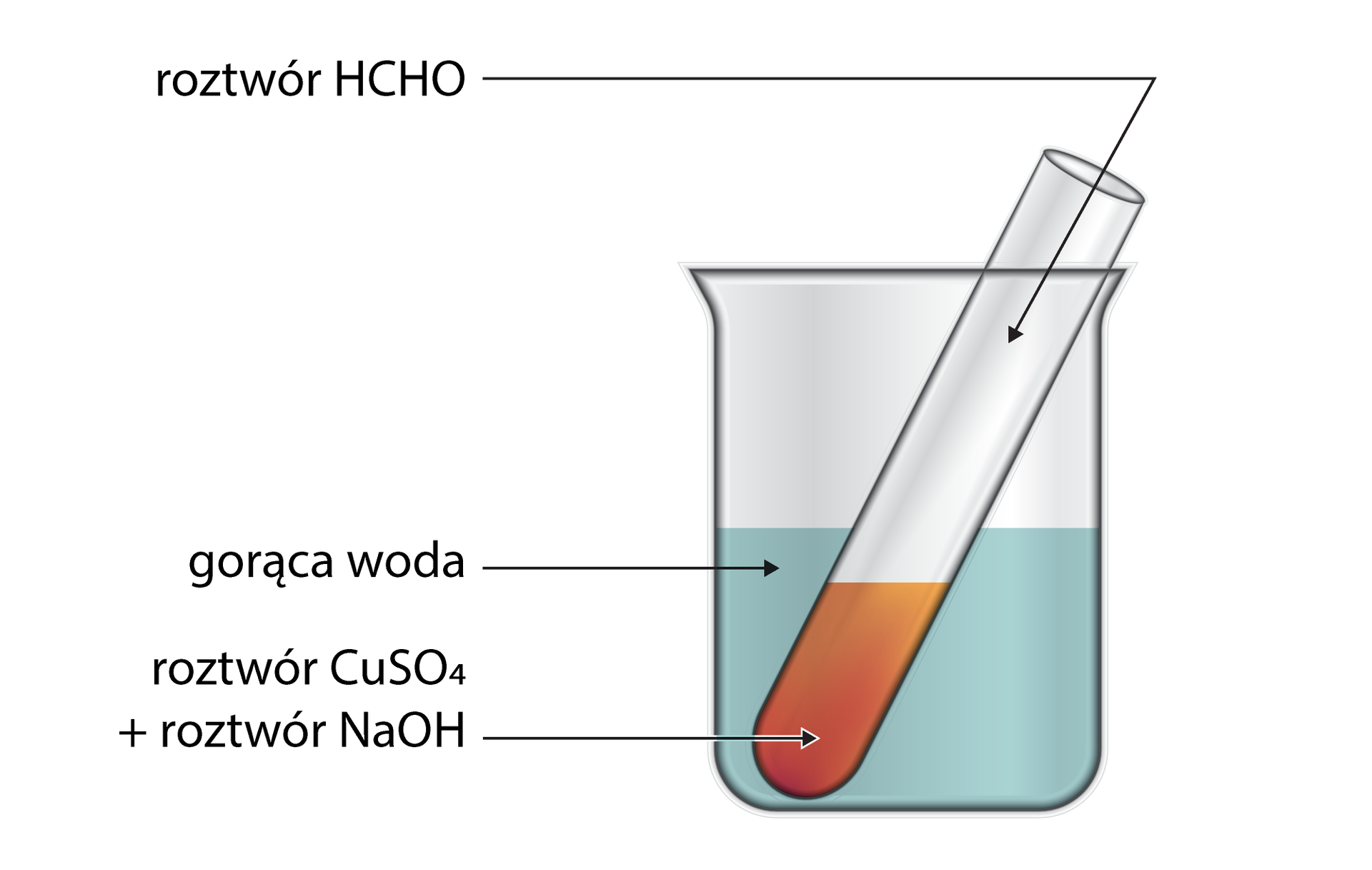

Wnioski:
W wyniku reakcji siarczanu(VI) miedzi(II) z wodorotlenkiem sodu powstaje nierozpuszczalny wodorotlenek miedzi(II):
Nierozpuszczalny w wodzie wodorotlenek miedzi(II) reaguje z formaldehydem (metanalem). W wyniku tej reakcji powstaje kwas mrówkowy (metanowy), woda oraz tlenek miedzi(I), który występuje w postaci ceglastoczerwonego osadu.
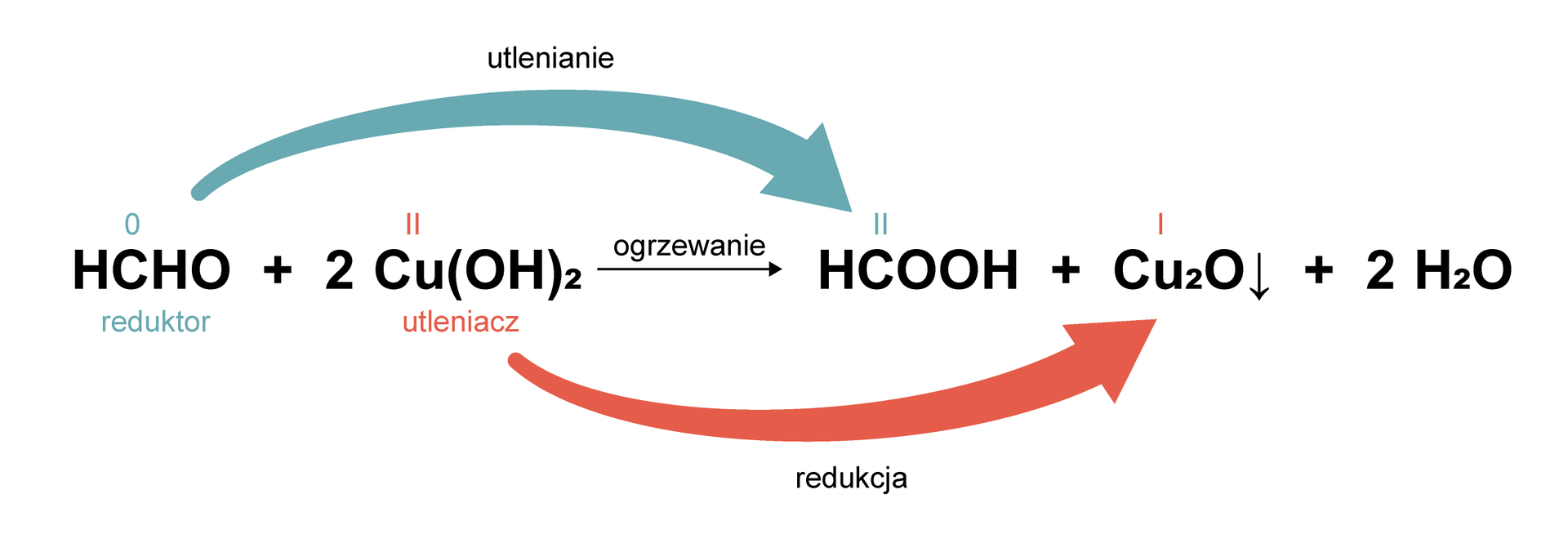
Równanie reakcji utleniania‑redukcji zachodzącej między wodorotlenkiem miedzi(II) a formaldehydem. Atom węgla w cząsteczce formaldehydu zwiększa swój stopień utlenienia z 0 na II, czyli bierze udział w reakcji utleniania, pełniąc rolę reduktora. Z kolei atom wodorotlenku miedzi(II) zmniejsza swój stopień utlenienia z II na I, czyli bierze udział w reakcji redukcji, pełniąc rolę utleniacza.
Formaldehyd posiada właściwości redukujące, o czym świadczy pozytywny wynik próby Trommera.
Podsumowanie
Formaldehyd (metanal) posiada właściwości redukujące, o czym świadczy pozytywny wynik próby Tollensa oraz próby Trommera.
Właściwości redukujące formaldehydu (metanalu) wynikają z jego budowy, a konkretnie z posiadania grupy aldehydowej.
W wyniku reakcji utleniania formaldehydu (metanalu) powstaje m.in. kwas karboksylowy – kwas mrówkowy (kwas metanowy).
Słownik
(łac. functio „czynność”) atom lub grupa atomów w związkach organicznych, która decyduje o właściwościach danego związku oraz jego przynależności do danej klasy związków
(łac. reductio „cofnięcie”, „odzyskanie”) zdolność substancji do redukowania innej substancji przy utlenianiu samej siebie; substancja, która posiada takie właściwości, oddaje elektrony innej substancji, przez co podwyższa swój stopień utlenienia; substancja, która posiada właściwości redukujące, jest nazywana reduktorem
(kompleks, związek koordynacyjny; łac. complexio „połączenie”, „związek”) związek chemiczny, którego cząsteczka składa się atomu/jonu tzw. centralnego, połączonego za pomocą wiązań koordynacyjnych z ligandami. Ligandem może być jon lub cząsteczka obojętna
(utlenianie, oksydacja – fr. oxygéne – dosłownie „kwasoród”; tlen) reakcja polegająca na oddawaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest podwyższenie ich stopnia utlenienia
(redukcja; łac. reductio „cofnięcie”, „odzyskanie”) reakcja polegająca na przyjmowaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest obniżenie ich stopnia utleniania
(łac. reductio „cofnięcie”, „odzyskanie”) substancja posiadająca właściwości redukujące. Substancja ta redukuje inną, utleniając się. Reduktor oddaje elektrony, przez co podwyższa swój stopień utlenienia
(fr. oxygéne – dosłownie „kwasoród”; tlen) substancja, która utlenia inną substancję, sama redukując się. Utleniacz przyjmuje elektrony, przez co obniża swój stopień utlenienia
liczba ładunku elementarnego, jaki posiadałby atom, gdyby w danej substancji wszystkie wiązania były jonowe
Bibliografia
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa, 2014.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla Liceum ogólnokształcącego, Liceum profilowanego, Technikum, Warszawa, 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa, 2016.
Hassa R., Mrzigod A., Mrzigod J., To jest chemia. Podręcznik dla szkół ponadgimnazjalnych. Zakres podstawowy, Warszawa 2016.
Kopaliński W., Słownik wyrazów obcych i zwrotów obcojęzycznych, Warszawa 1983.
Litwin M., Styka–Wlazło S., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Majewski W., Mechanizmy reakcji chemicznych, Lublin 2012.
McMurry J., Chemia organiczna 4, Warszawa 2004.
Pazdro K.M., Rola–Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.