Przeczytaj
Iloczyn rozpuszczalności
Pewne związki chemiczne, w których występują wiązania jonowe, są trudno rozpuszczalne w wodzie. Ta niewielka ilość substancji jonowej (soli lub wodorotlenku), która ulegnie rozpuszczeniu, rozpada się całkowicie na jony. W naczyniu ustala się zatem równowaga pomiędzy stałym osadem nierozpuszczonej soli lub wodorotlenku, a jonami znajdującymi się w roztworze.
Równowagę procesu rozpuszczania trudno rozpuszczalnego osadu opisuje równanie:
Gdzie i oznaczają odpowiednio kation i anion trudno rozpuszczalnego związku o wzorze .
Wyrażenie na stałą równowagistałą równowagi tej reakcji możemy zapisać w postaci:
– stężenie molowe jonów w roztworze nasyconym;
– stężenie molowe jonów w roztworze nasyconym;
– wartościowość reszty kwasowej (lub anionu wodorotlenkowego) równa liczbie kationów metalu;
– wartościowość metalu równa liczbie anionów reszt kwasowych (w przypadku soli) lub liczbie anionów wodorotlenkowych (w przypadku wodorotlenków).
Powyższe równanie oznacza, że w tym samym czasie tyle samo jonów przechodzi z fazy stałej do roztworu, ile się ich osadza na powierzchni osadu. W wyrażeniu tym stężenie osadu [] jest wielkością stałą i przyjmuje wartość 1. Z tego względu stężenia ciał stałych w wyrażeniu na iloczyn rozpuszczalności można włączyć do stałej.
(indeks so od ang. solubility „rozpuszczalność”) nazywana jest iloczynem rozpuszczalności,
a wyrażenie – iloczynem jonowym, który jest iloczynem stężeń molowych kationu i anionu podniesionych do odpowiednich potęg , , oznaczających współczynniki stechiometryczne z równania procesu rozpuszczania osadu trudno rozpuszczalnego.
Iloczyn rozpuszczalności (oznaczany czasem jako ) jest wartością stałą w określonych warunkach ciśnienia i temperatury oraz charakterystyczną dla danego układu. Wartości wyznaczane są doświadczalnie i zestawiane tabelarycznie do dalszego wykorzystania. Wartości iloczynów rozpuszczalności związków trudno rozpuszczalnych podawane są bez jednostek. Natomiast podczas obliczania stężenia jonów w roztworze (np. na podstawie iloczynu rozpuszczalności), jednostką stężenia jest .
Porównując wartości iloczynów rozpuszczalności substancji dysocjujących na tę samą liczbę kationów i tę samą liczbę anionów, możemy w łatwy sposób stwierdzić, która substancja jest lepiej rozpuszczalna w wodzie. Im mniejsza wartość iloczynu rozpuszczalności, tym rozpuszczalność mniejsza. W ten sposób możemy szybko stwierdzić, że chlorek srebra () jest lepiej rozpuszczalny od bromku srebra (). Nie powinniśmy jednak porównywać w ten sposób rozpuszczalności substancji o różnej budowie, np. i – pomimo znaczącej różnicy wartości iloczynów rozpuszczalności (; ) ich rozpuszczalności będą bowiem podobne (stężenia nasyconych roztworów wynoszą odpowiednio dla i dla ).
Podsumowując, aby ocenić, która substancja jest lepiej lub gorzej rozpuszczalna, należy pamiętać, że wartość można porównywać do substancji o tym samym składzie jonowym (czyli do takich, które dysocjują na taką samą liczbę jonów).
Kiedy wytrąca się osad?
Czy po zmieszaniu dwóch roztworów, zawierających jony soli (lub wodorotlenku), wytrąci się osad?
W sposób uproszczony można powiedzieć, że iloczyn rozpuszczalności wskazuje, jakie stężenia jonów należy osiągnąć, aby wytrącić osad. Istnieją trzy przypadki, z którymi spotykamy się w praktyce laboratoryjnej i obliczeniach chemicznych.
Iloczyn stężeń jonowych trudno rozpuszczalnego elektrolituelektrolitu (podniesionych do odpowiednich potęg) jest mniejszy od jego iloczynu rozpuszczalności. Wówczas osad nie wytrąca się, a substancja całkowicie rozpuszcza się w wodzie (roztwór nienasyconyroztwór nienasycony).
Iloczyn stężeń jonów (podniesionych do odpowiednich potęg) trudno rozpuszczalnego elektrolitu równa się jego iloczynowi rozpuszczalności. Otrzymujemy roztwór nasyconyroztwór nasycony, układ znajduje się w stanie równowagi dynamicznej.
Co istotne, stężenie jednego z jonów może przyjmować dowolną wartość, pod warunkiem, że stężenie drugiego jonu będzie takie, aby spełniona była powyższa zależność.
Gdy iloczyn stężeń jonowych trudno rozpuszczalnego elektrolitu (podniesionych do odpowiednich potęg) w roztworze jest większy od iloczynu rozpuszczalności, to należy spodziewać się wytrącenia nadmiaru substancji:
Wytrącenie substancji stałej spowoduje bowiem zmniejszenie stężeń obu jonów w roztworze, a w konsekwencji spadek iloczynu stężeń jonów (podniesionych do odpowiednich potęg) do wartości równej iloczynowi rozpuszczalności. Jednakże roztwór nadal będzie nasycony.
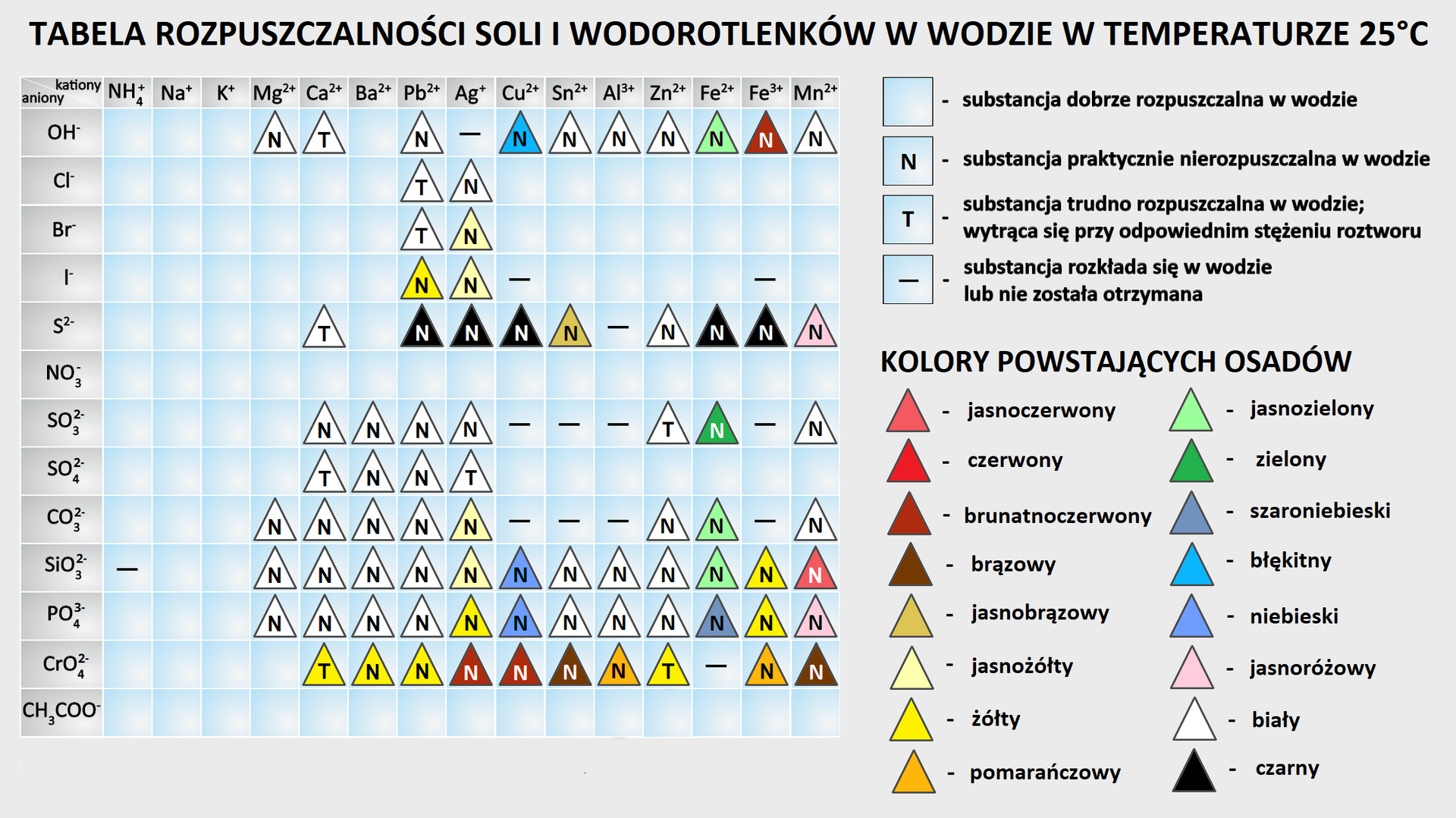
Podczas wytrącania osadów korzysta się z tabeli rozpuszczalności, w której znajdują się dane obrazujące charakter rozpuszczalności powstającego związku (osadu) w wodzie. Jeśli powstająca substancja jest:
rozpuszczalna – jej rozpuszczalność w wodzie jest większa niż 1 gram na 100 gramów wody;
trudno rozpuszczalna – strąca się w postaci osadu przy odpowiednim stężeniu roztworów (zazwyczaj z roztworów stężonych); jej rozpuszczalność w wodzie mieści się w granicach 0,1 – 1 grama na 100 gramów wody;
nierozpuszczalna – strąca się w postaci osadu z roztworów rozcieńczonych; jej rozpuszczalność w wodzie leży powyżej 0,1 grama na 100 gramów wody.
Indeks dolny /Źródło danych dotyczących wartości rozpuszczalności: wikipedia.org, data dostępu: 16.03.2020 r./ Indeks dolny koniec/Źródło danych dotyczących wartości rozpuszczalności: wikipedia.org, data dostępu: 16.03.2020 r./
Obliczanie stężeń jonów oraz w roztworze nasyconym siarczanu() baru
Rozwiązanie:
Rozpuszczalność w wodzie obrazuje poniższe równanie:
Jony pozostają z osadem w równowadze, a wyrażenie na iloczyn rozpuszczalności przyjmuje postać:

Wartość iloczynu rozpuszczalności w temperaturze 25°C dla siarczanu() baru () wynosi .
Indeks dolny Źródło: Lipiec T., Szmal Z, Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980. Indeks dolny koniecŹródło: Lipiec T., Szmal Z, Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980.
W wyniku rozpadu 1 mola na jony powstaje 1 mol kationów baru i 1 mol anionów siarczanowych(), zatem można zapisać:
Przyjmując stężenia jonów , jako równe , otrzymujemy:
Odpowiedź:
Stężenia jonów oraz w roztworze nasyconym wynoszą 1,05 ∙ 10Indeks górny -5-5 .
Czy po zmieszaniu roztworu o stężeniu oraz roztworu o stężeniu wytrąci się osad ?
Rozwiązanie
Krok 1. Zapisanie równania reakcji:
Wyobraźmy sobie, że mieszamy ze sobą dwie substancje dobrze rozpuszczalne w wodzie ( i ), zawierające jony oraz , w celu wytrącenia osadu . W trakcie mieszania roztworów zachodzi reakcja opisana równaniem:
Lub w postaci uproszczonej:
Po zmieszaniu roztworów oraz sumaryczna objętość roztworu wynosi 10 . Zmianie ulegają stężenia roztworów, a co za tym idzie stężenia jonów.
Krok 2. Obliczenie stężeń jonów po zmieszaniu roztworów i
1. :
-
Korzystamy ze wzoru na stężenie molowe:
Gdzie:
– stężenie;
– liczba moli;
– objętość roztworu.
Przyjmujemy, że:
Bierzemy pod uwagę fakt, że liczba moli przed zmieszaniem roztworów () oraz po zmieszaniu roztworów () nie ulega zmianie. Zmienia się wyłącznie objętość roztworu oraz jego stężenie. Zatem:
Stężenie końcowe roztworu można obliczyć z zależności:
Po przekształceniu równania względem otrzymujemy:
dysocjuje zgodnie z równaniem:
Stężenie jonów jest równe stężeniu roztworu :
2. :
Podobnie obliczamy stężenie końcowe roztworu :
dysocjuje zgodnie z równaniem:
Stężenie jonów jest równe stężeniu roztworu :
Krok 3. Zapisanie wyrażenia na iloczyn rozpuszczalności
Wartość iloczynu rozpuszczalności w temperaturze 25°C dla siarczanu() baru () wynosi .
Indeks dolny /Źródło: Lipiec T., Szmal Z., Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980./ Indeks dolny koniec/Źródło: Lipiec T., Szmal Z., Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980./
Do wytrącenia osadu konieczne jest przekroczenie wartości iloczynu rozpuszczalności , Zatem iloczyn ze stężeń jonów i musi być większy niż .
Obliczamy wartość iloczynu jonowego z warunków zadania, podstawiając stężęnia jonów z poprzedniego punktu (krok 2).
Odpowiedź
Osad wytrąci się, ponieważ został przekroczony iloczyn rozpuszczalności .
Efekt wspólnego jonu
Rozpuszczalność w czystej wodzie będzie większa niż rozpuszczalność w roztworze . Siarczan() sodu dysocjując, dostarcza do roztworu jony :
Jony te niejako zajmują miejsca przeznaczone dla jonów pochodzących z dysocjacji . Można więc powiedzieć, że roztwór posiada określoną ilość miejsc przeznaczonych dla jonów pochodzących z dysocjacji , czyli i . Jeśli miejsca te zajmie ktoś inny, np. jony pochodzące z innej substancji, to w konsekwencji mniejsza ilość będzie mogła ulec rozpuszczeniu w takim roztworze. Takie zjawisko opisujemy jako efekt wspólnego jonu.
Rozpuszczalność
Znajomość iloczynu rozpuszczalności pozwala na obliczenie rozpuszczalności danej substancji, a mianowicie rozpuszczalności molowej () . Jest ona wyrażona jako liczba moli substancji, którą można rozpuścić w roztworu. Rozpuszczalność molowa równa jest zatem całkowitemu stężeniu molowemu substancji rozpuszczonej w roztworze nasyconym tej substancji.
Obliczanie rozpuszczalności molowej soli trudno rozpuszczalnej o znanym iloczynie rozpuszczalności
Oblicz rozpuszczalność molową soli , której iloczyn rozpuszczalności wynosi .
Indeks dolny /Źródło danych K Indeks dolny koniec/Źródło danych KIndeks dolny s: Lipiec T., Szmal Z., Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980./ Indeks dolny koniecs: Lipiec T., Szmal Z., Chemia Analityczna z Elementami Analizy Instrumentalnej, Warszawa 1980./
Rozwiązanie
Równowagę pomiędzy stałym a roztworem opisuje zależność:
Wyrażenie na iloczyn rozpuszczalności:
Z równania rozpuszczania soli wynika, że rozpuszczeniu moli soli będzie towarzyszyć wprowadzenie do roztworu moli jonów oraz 2 moli jonów :
Zatem po podstawieniu wartości do wyrażenia na iloczyn rozpuszczalności otrzymujemy:
Przekształcamy wrażenie względem , co daje:
Odpowiedź
Rozpuszczalność molowa soli o wzorze wynosi .
Podsumowanie
Spójrz na mapę myśli dotyczącą iloczynu rozpuszczalności i zastanów się, co oznaczają umieszczone na niej pojęcia. W razie wątpliwości przejrzyj materiał ponownie.
Zapoznaj się z mapą myśli dotyczącą iloczynu rozpuszczalności i zastanów się, co oznaczają umieszczone na niej pojęcia. W razie wątpliwości przestudiuj materiał ponownie.
Słownik
stała równowagi, w której stężenia równowagowe są podniesione do potęg odpowiadającym współczynnikom stechiometrycznym
reakcja, która może zachodzić w obu kierunkach (w kierunku produktów lub substratów)
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
roztwór, w którym w danych warunkach ciśnienia i temperatury zwykle nie da się rozpuścić większej ilości danej substancji
roztwór, którego stężenie substancji rozpuszczonej jest mniejsze niż rozpuszczalność tej substancji w danych warunkach ciśnienia i temperatury
Bibliografia
Encyklopedia PWN
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Hejwowska S., Marcinkowski R., Staluszka J. Równowagi i procesy jonowe Chemia 3, Gdynia 2006.
Skoog D. A., West D. M., Holler J. F., Crouch S. R.: Podstawy Chemii Analitycznej, t. 1, Warszawa, 2006.
Minczewski J., Marczenko Z., Chemia analityczna. T.2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.
Schweda E., Chemia nieorganiczna tom 1 - wprowadzenie i analiza ilościowa, Wrocław 2014.
Sienko M. J., Plane R. A. Chemia podstawy i zastosowania, Warszawa 1999.
Pazdro K., Rola‑Noworyta A., Akademicki zbiór zadań z chemii ogólnej, Warszawa 2013.

