Przeczytaj
Reguła przekory a stężenie reagenta
Jednym z wyzwań przemysłu chemicznego jest osiągnięcie wysokiej wydajności produktów.
W związku z tym, zadaniem chemików jest manipulowanie warunkami reakcji w taki sposób, aby równowaga reakcjirównowaga reakcji była przesunięta w stronę tworzenia produktów. Do tego celu wykorzystywana jest reguła przekory, a jednym z czynników, który ułatwia powstawanie produktów, jest zmiana stężenia reagentów reakcji.
Czy manipulowanie stężeniem reagentów zawsze zwiększa wydajność reakcji?
Załóżmy, że zachodzi reakcja odwracalnareakcja odwracalna substancji A z substancją B, w wyniku której powstaje związek AB:
W stanie równowagi wyrażenie na stałą równowagistałą równowagi (KIndeks dolny cc) przyjmuje postać:
![Ilustracja przedstawia wzór: K C = [ A B ] [ A ] ⋅ [ B ] . AB znajduje się w czerwonym kole, A w zielonym, B w niebieskim. Koła są tej samej wielkości. Legenda: czerwone koło to stężenie związku AB w stanie równowagi. Zielone koło to stężenie substancji A w stanie równowagi. Niebieskie koło oznacza stężenie substancji B w stanie równowagi.](https://static.zpe.gov.pl/portal/f/res-minimized/RAYxfys89Wn9w/1616760049/1PH5y8s8uLboKn2rvVLMVjTKBiWyMCxz.png)
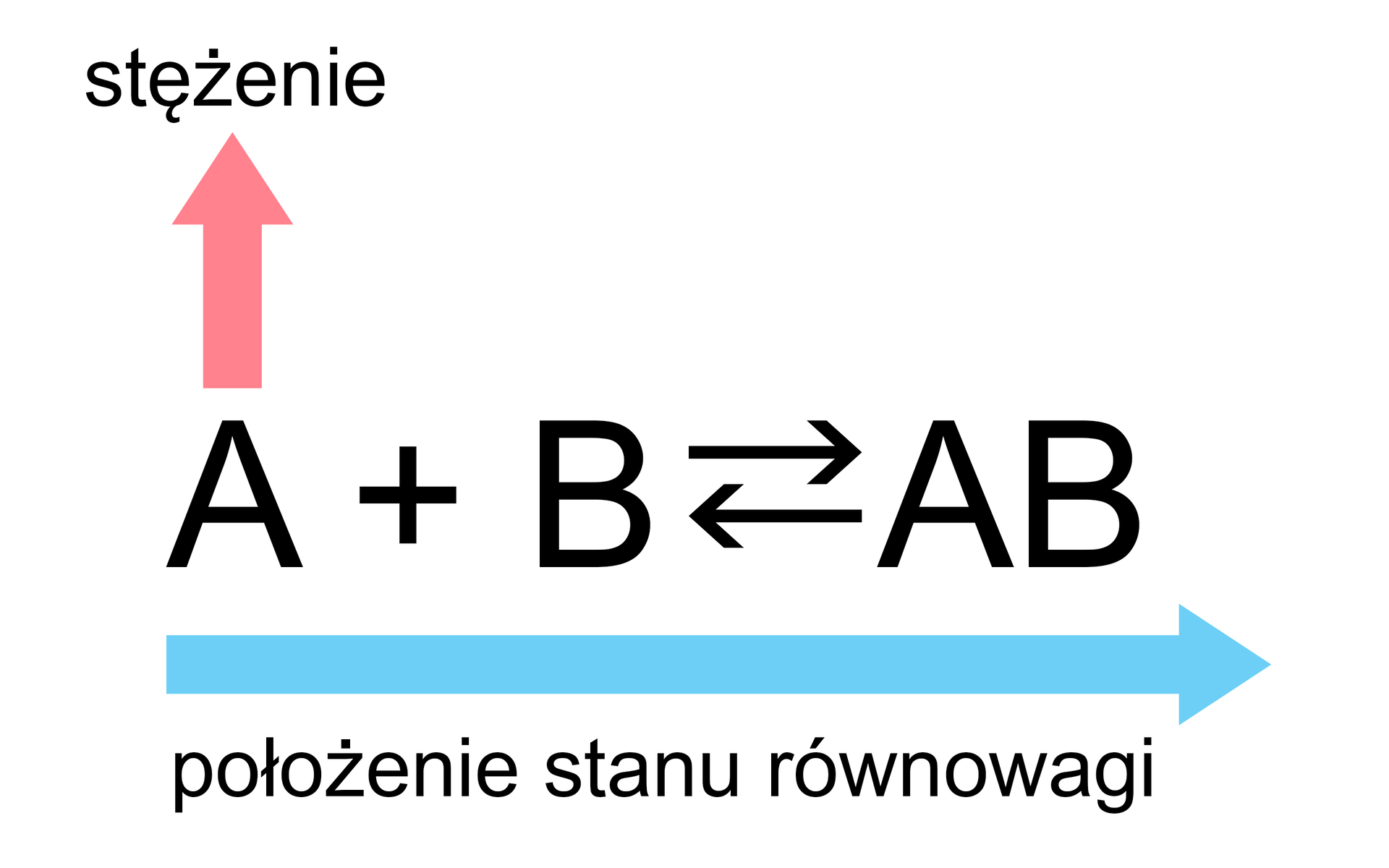
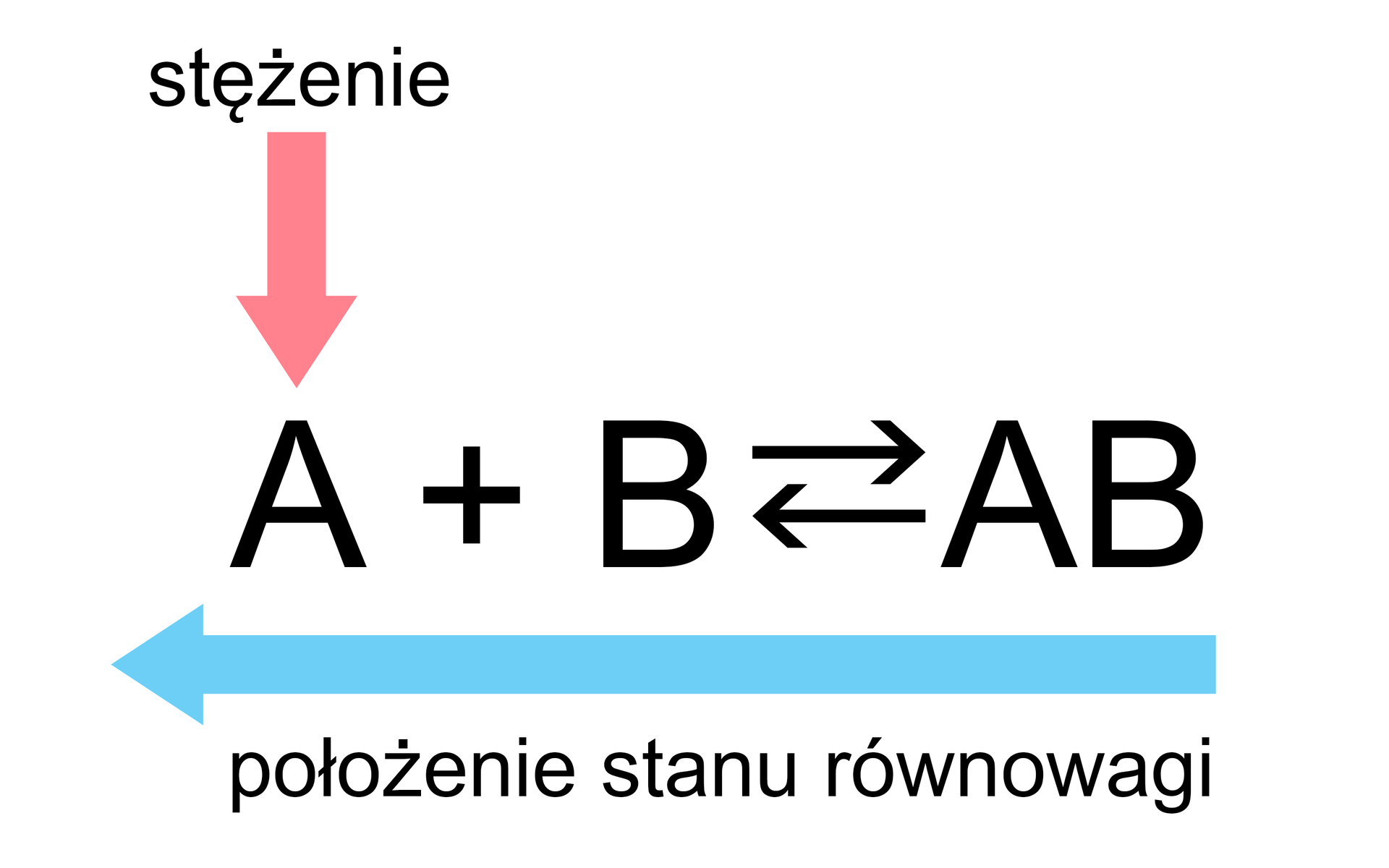
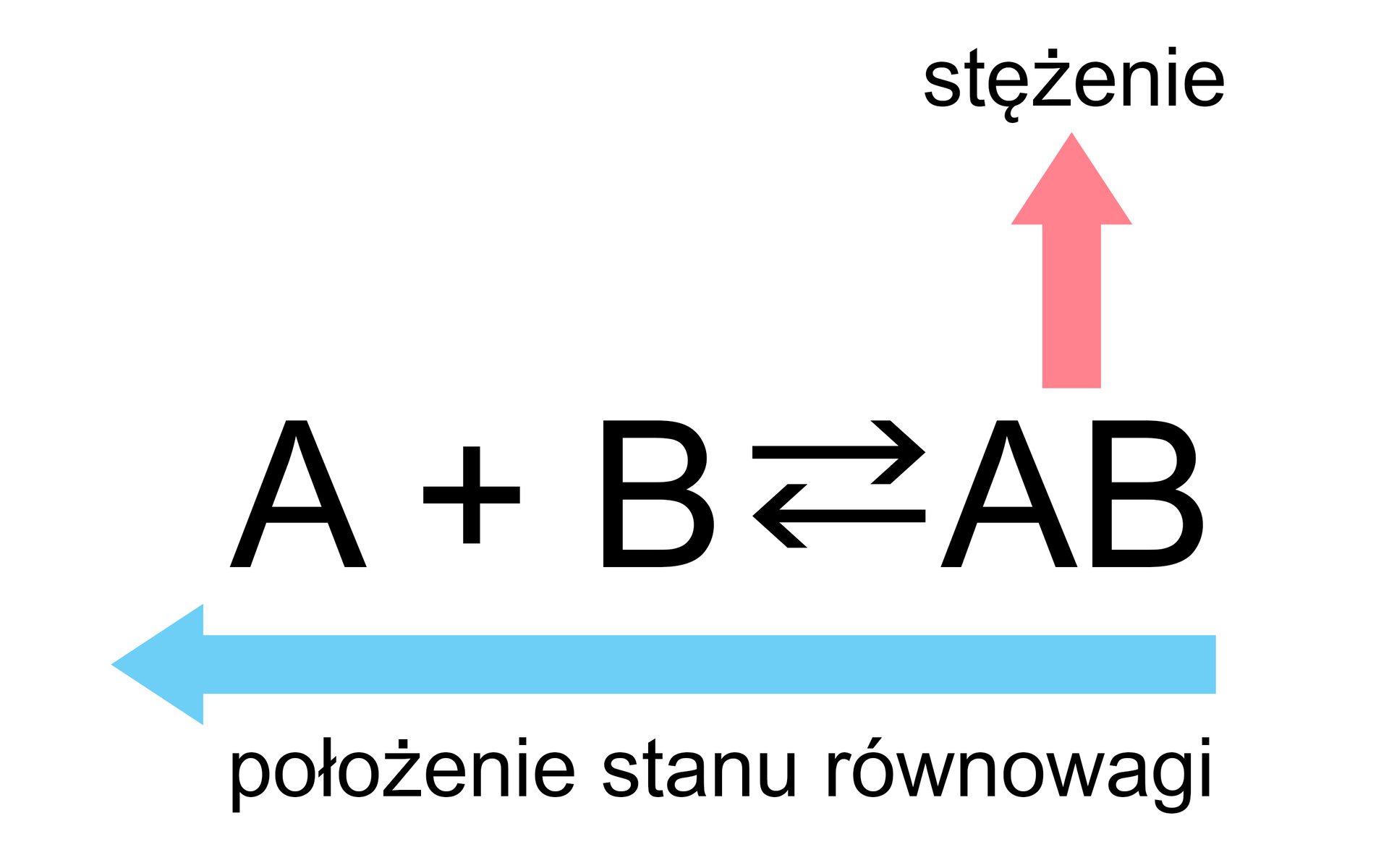
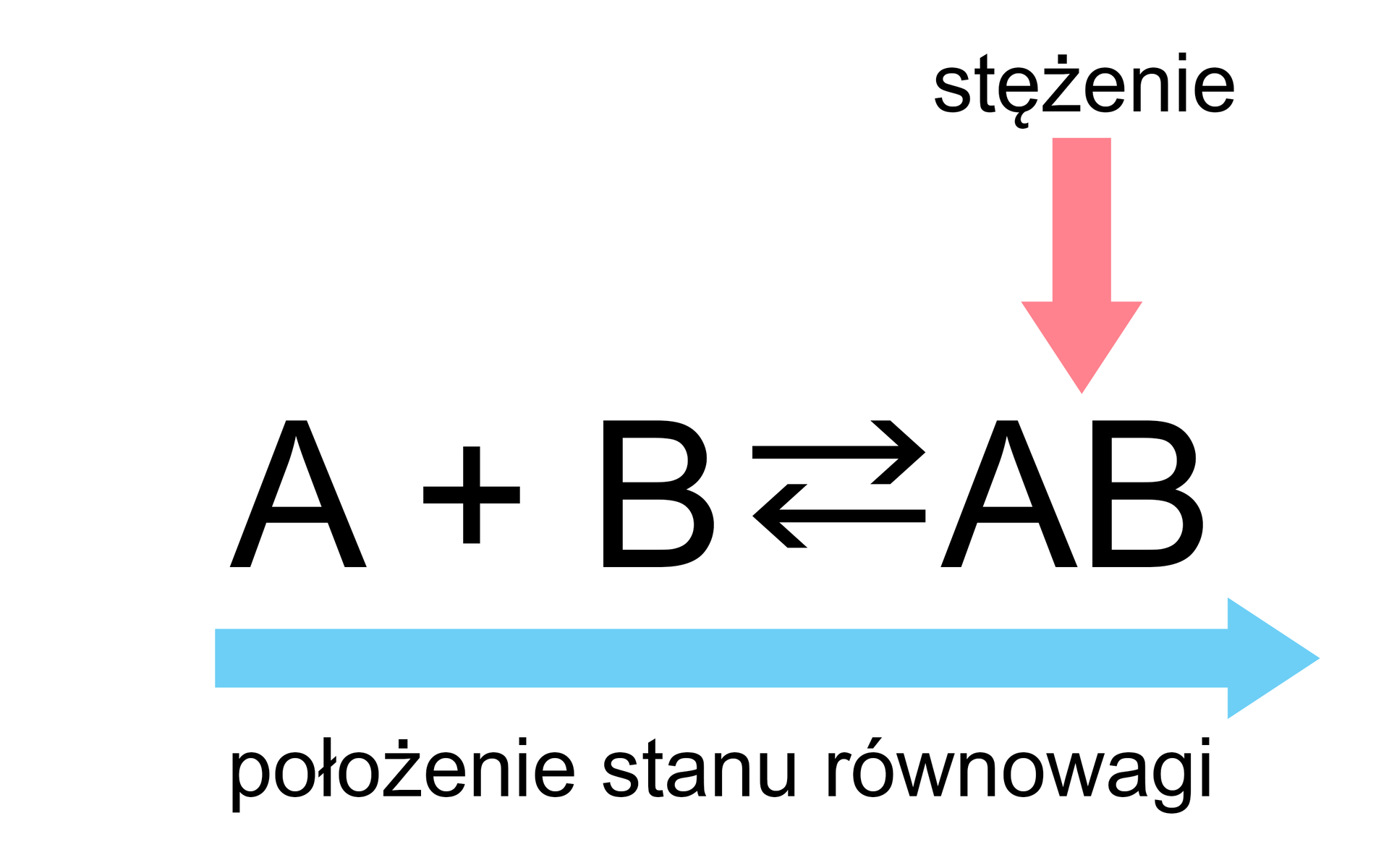
Zmiana położenia stanu równowagi powyższej reakcji może nastąpić poprzez:
Reguła przekory Le Chateliera-Brauna jest przydatnym przewodnikiem do identyfikacji tego, co dzieje się z układem podczas zmian warunków reakcji, będącej w stanie równowagi.
Jak pokazują powyższe przypadki, położenie stanu równowagi można przesuwać „w lewo” lub „w prawo”. Kiedy równowaga reakcji zostaje zaburzona, zainicjowane przemiany trwają tak długo, dopóki nie ustali się „nowy” stan równowagi, a szybkość reakcji, która biegnie w przeciwnych kierunkach, osiągnie tę samą wartość.
Równowaga, osiągnięta przez układ, ustala się przy nowych stężeniach. Co istotne, wartość stałej równowagi KIndeks dolny cc (w stałej temperaturze) nie ulega zmianie.
Uzupełnij tabelę, obrazującą wpływ stężenia reagentów na stan równowagi reakcji opisanej równaniem:
Zastanów się i wpisz w puste pola, jak zmienia się położenie równowagi oraz wydajność reakcji w wyniku różnych czynników? Wykorzystaj słowa: w prawo, w lewo, rośnie, maleje.
Wzrost stężenia substratów, Spadek stężenia substratów, Wzrost stężenia produktów, Spadek stężenia produktów
| Czynnik | Przesunięcie położenia równowagi | Wydajność |
|---|---|---|
| Wzrost stężenia substratów | ||
| Spadek stężenia substratów | ||
| Wzrost stężenia produktów | ||
| Spadek stężenia produktów |
Słownik
reakcja, która może zachodzić w obu kierunkach (w kierunku produktów lub substratów), celem osiągnięcia stanu równowagi
stan, w którym procesy biegnące w przeciwnym kierunku (w reakcjach odwracalnych) zachodzą z tą samą szybkością
stosunek iloczynu równowagowych stężeń produktów do iloczynu równowagowych stężeń substratów; jej wartość jest charakterystyczna dla danej reakcji i zmienia się wraz z temperaturą; oznaczana symbolem Kc
ilość produktów, które można otrzymać, zakładając, że reakcja przebiega w sposób ilościowy, a jeden z substratów przereagował całkowicie
Bibliografia
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Staluszka J., Chemia 3. Równowagi i procesy jonowe, Gdynia 2006.
Kaznowski K., Pazdro K., Chemia. Podręcznik dla liceów i techników. Część 1. Zakres rozszerzony, Warszawa 2019.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pazdro K. M., Rola‑Naworyta A., Akademicki zbiór zadań z chemii ogólnej, Warszawa 2013.
Sienko M. J., Plane R. A., Chemia. Podstawy i zastosowania, Warszawa 1999.
![Ilustracja przedstawia wzór: K C = [ A B ] [ A ] ⋅ [ B ] . AB znajduje się w czerwonym kole, A w zielonym, B w niebieskim. Koło zielone jest większe od pozostałych.](https://static.zpe.gov.pl/portal/f/res-minimized/R1DlaSpMYLlO9/1616760049/2GgFMAWN1Iea4eBejtfclcPtbdE4rPPK.png)
![Ilustracja przedstawia wzór:
K
C
=
[
A
B
]
[
A
]
⋅
[
B
]
. AB znajduje się w czerwonym kole, A w zielonym, B w niebieskim. Koło zielone jest dużo mniejsze od pozostałych.](https://static.zpe.gov.pl/portal/f/res-minimized/R14DhN2RkqCcf/1616760050/240bXzDCpO3pMNXYGoKDCdmJwiRk6ElA.png)
![Ilustracja przedstawia wzór:
K
C
=
[
A
B
]
[
A
]
⋅
[
B
]
. AB znajduje się w czerwonym owalu, A w zielonym kole, B w zielonym kole.](https://static.zpe.gov.pl/portal/f/res-minimized/Rhfdt7yMUJEp0/1616760050/1b0bGfdvNv6MmAsrl59SsaYq0iyCMKjO.png)
![Ilustracja przedstawia wzór:
K
C
=
[
A
B
]
[
A
]
⋅
[
B
]
. AB znajduje się w czerwonym kole, A w zielonym, B w niebieskim. Czerwone koło jest dużo mniejsze od pozostałych kół.](https://static.zpe.gov.pl/portal/f/res-minimized/RYMUcNRWtJJY9/1616760050/ADuwQffEZfVSXHtjfzyxkryjAJTf7qGk.png)