Przeczytaj
Izomeria
Izomeria to zjawisko polegające na różnej budowie cząsteczek związków chemicznych posiadających takie same wzory sumaryczne. Najczęściej z pojęciem izomerii spotykamy się w przypadku związków organicznych, które mogą tworzyć wiele izomerów różnego rodzaju. W zależności od tego, czym dokładnie różnią się cząsteczki izomerów, możemy wyszczególnić dwie główne grupy izomerii – izomerię konstytucyjną oraz stereoizomerięstereoizomerię. Izomery konstytucyjne mogą różnić się między sobą kolejnością lub/i sposobem połączenia atomów w cząsteczkach.
W cząsteczkach stereoizomerów kolejność i sposób połączenia atomów są takie same. Cząsteczki te różnią się jednak sposobem rozmieszczenia atomów (lub określonych grup atomów) w przestrzeni.
Diastereoizomeria typu / i cis-trans – warunki występowania
Jednym z rodzajów stereoizomerii jest tzw. diastereoizomeria. Diastereoizomery różnią się konfiguracją (w uproszczeniu – rozmieszczeniem atomów w przestrzeni) przy przynajmniej jednym i jednocześnie nie przy wszystkich atomach węgla w cząsteczkach.
Do diastereoizomerów zaliczamy m.in. izomery typu /, których szczególnym przypadkiem są izomery typu cis-trans.
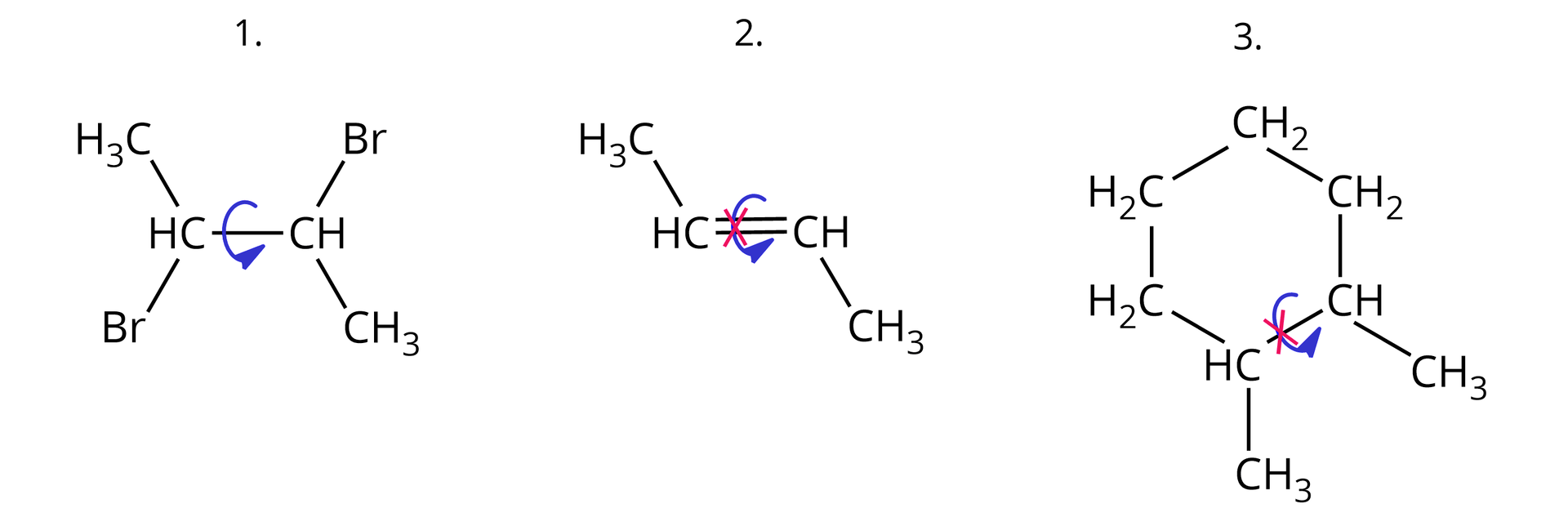
Jednym z warunków występowania zjawiska izomerii typu E/Zizomerii typu E/Z (w tym również izomerii typu cis-transizomerii typu cis-trans) jest ograniczona rotacja atomów bądź grup atomów wokół wiązania węgiel‑węgiel w cząsteczce.
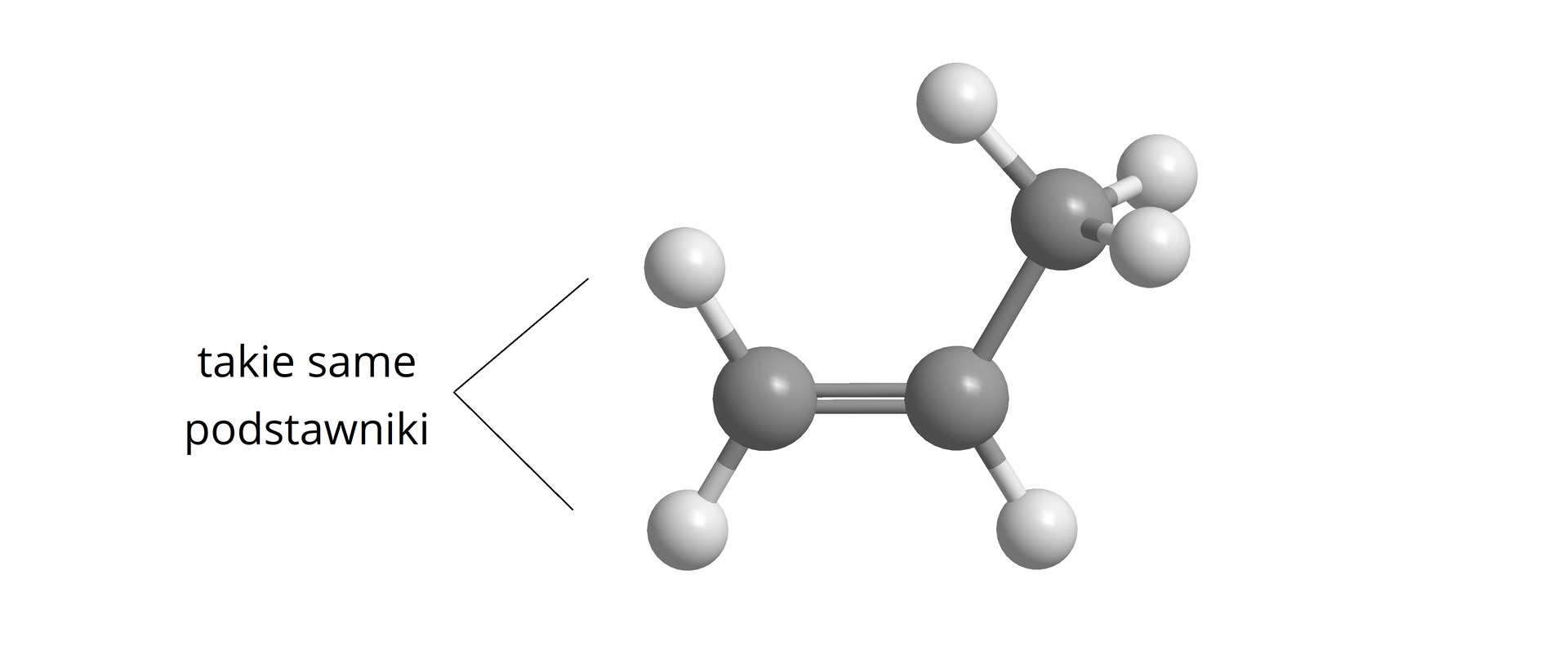
Z izomerią typu / mamy do czynienia wówczas, gdy rozpatrywane cząsteczki różnią się położeniem atomów lub grup atomów w stosunku do płaszczyzny odniesienia. W przypadku alkenówalkenów, płaszczyzną odniesienia jest płaszczyzna wiązania podwójnego.
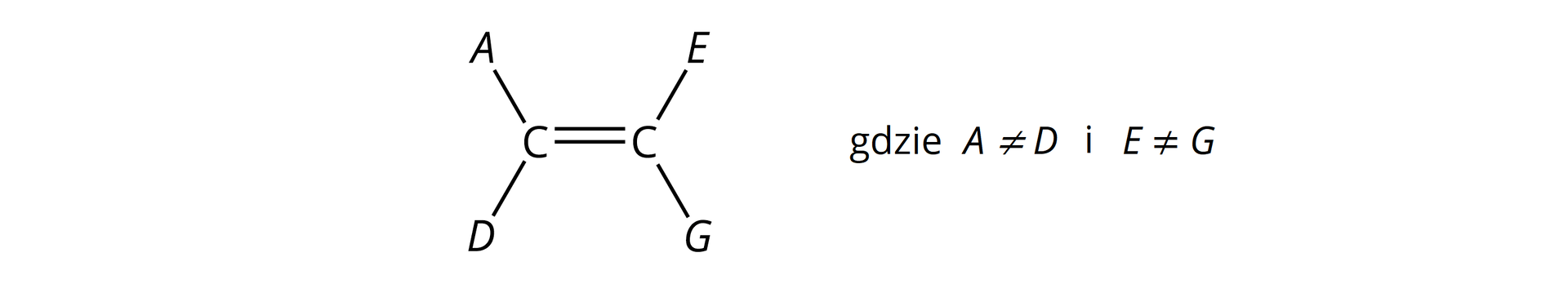
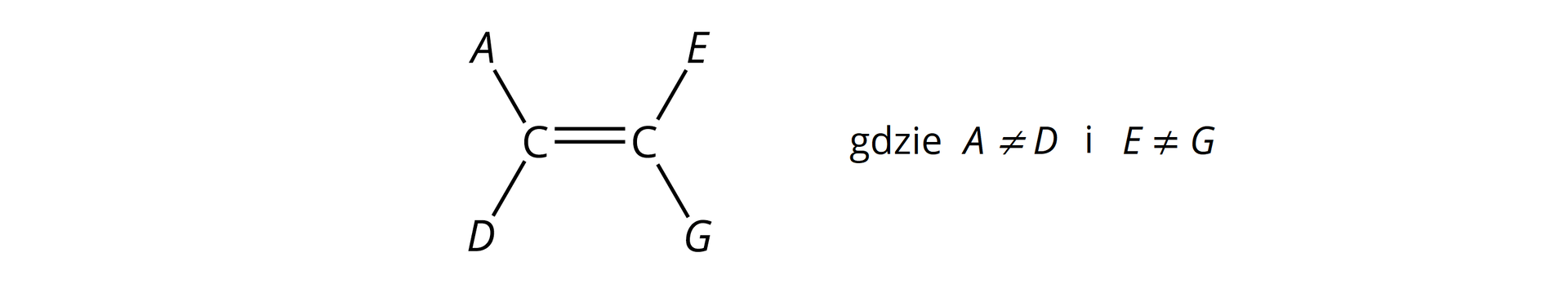
Jednak nie wszystkie alkeny, pomimo obecności wiązania podwójnego w cząsteczkach, mogą tworzyć izomery typu /. Kolejnym warunkiem do występowania izomerii typu / w alkenach jest bowiem obecność w ich cząsteczkach, przy atomach węgla połączonych wiązaniem podwójnym, podstawników parami nieidentycznych. Warunek ten zilustrowano na poniższej grafice.
Zastanów się i odpowiedz na pytanie, czy propen może tworzyć izomery typu /. Odpowiedź krótko uzasadnij.
Jak już wspomniano, izomeria typu cis-trans jest szczególnym przypadkiem izomerii typu /. Z izomerami typu cis-trans, w przypadku alkenów, mamy do czynienia wówczas, gdy przy każdym z atomów węgla, połączonych wiązaniem podwójnym, znajduje się jeden atom wodoru i podstawnik identyczny dla obydwu atomów węgla.

Rozpatrując izomerię typu / i cis-trans dla alkenów, często posługujemy się sformułowaniami, takimi jak: alken jednopodstawiony, dwupodstawiony, trójpodstawiony lub czteropodstawiony. Z alkenem czteropodstawionym mamy do czynienia wówczas, gdy w jego cząsteczce, do atomów węgla połączonych wiązaniem podwójnym, nie jest przyłączony żaden atom wodoru. W przypadku cząsteczki alkenu trójpodstawionego, do atomów węgla, uczestniczących w tworzeniu wiązania podwójnego, przyłączone są trzy podstawniki inne niż atom wodoru, w cząsteczce alkenu dwupodstawionego – do wspomnianych atomów węgla przyłączone są dwa podstawniki inne niż atomy wodoru, a w cząsteczce alkenu jednopodstawowego – jeden podstawnik inny niż atom wodoru.
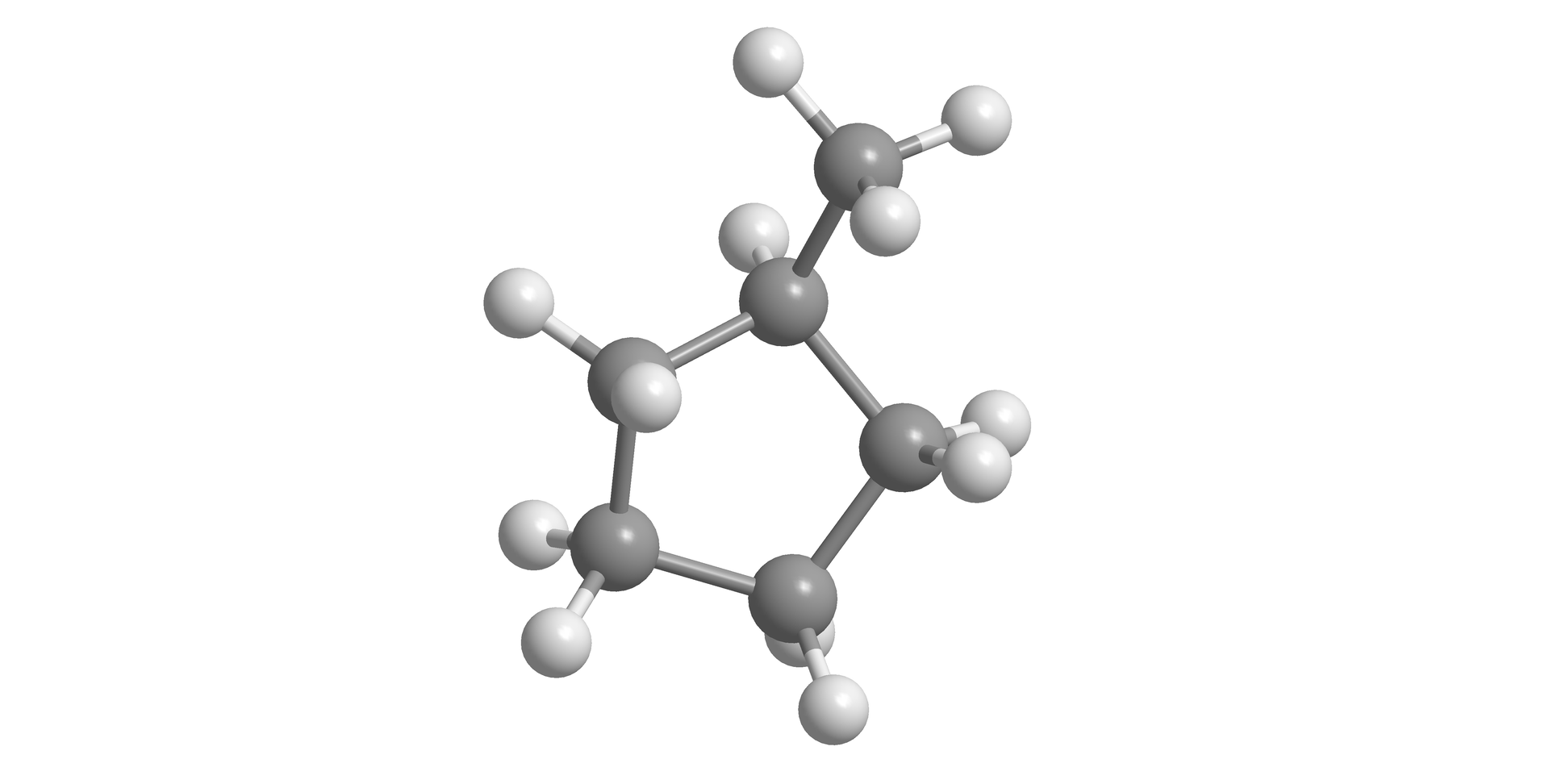
Zjawisko diastereoizomerii cis-trans dotyczy nie tylko alkenów, ale również cykloalkanów, w których cząsteczkach rotacja wokół pojedynczych wiązań węgiel‑węgiel w pierścieniu jest utrudniona. Dany cykloalkan (lub jego pochodna) może występować w postaci izomerów cis-trans wówczas, gdy w jego cząsteczce, do sąsiednich atomów węgla w pierścieniu, przyłączone są po dwa parami nieidentyczne podstawniki, przy czym jednym z nich w każdym przypadku jest atom wodoru.
Zastanów się i odpowiedz na pytanie, czy metylocyklopentan może tworzyć izomery typu cis-trans. Odpowiedź krótko uzasadnij.
Izomery typu cis-trans – nazewnictwo
Pamiętaj, że w alkenach izomerię typu cis-trans powinniśmy rozpatrywać tylko w przypadku alkenów dwupodstawionych, w cząsteczkach których do każdego z atomów węgla, połączonych wiązaniem podwójnym, dołączony jest jeden atom wodoru i jeden podstawnik identyczny dla obydwu wspomnianych atomów węgla.
Cząsteczki alkenów będących izomerami typu cis-trans różnią się położeniem atomów lub grup atomów w stosunku do płaszczyzny wiązania podwójnego. W izomerach cis identyczne podstawniki są po tej samej stronie płaszczyzny wiązania, a w izomerach trans – po przeciwnych stronach.
Przykładem alkenu, który wykazuje tego typu izomerię, jest but--en.
Cząsteczki cykloalkanów będących izomerami typu cis-trans różnią się położeniem atomów lub grup atomów w stosunku do płaszczyzny odniesienia, którą w tym przypadku stanowi „płaszczyzna” pierścienia. W izomerach cis, identyczne podstawniki znajdują się po tej samej stronie płaszczyzny pierścienia, a w izomerach trans – po przeciwnych jej stronach.
Przykładem cykloalkanu, który wykazuje tego typu izomerię, jest ,-dimetylocyklopropan.
Zwróć uwagę, że podając nazwę odpowiedniego izomeru typu cis-trans, przed nazwą związku umieszczamy przedrostek cis- lub trans-.
Izomery typu / – nazewnictwo
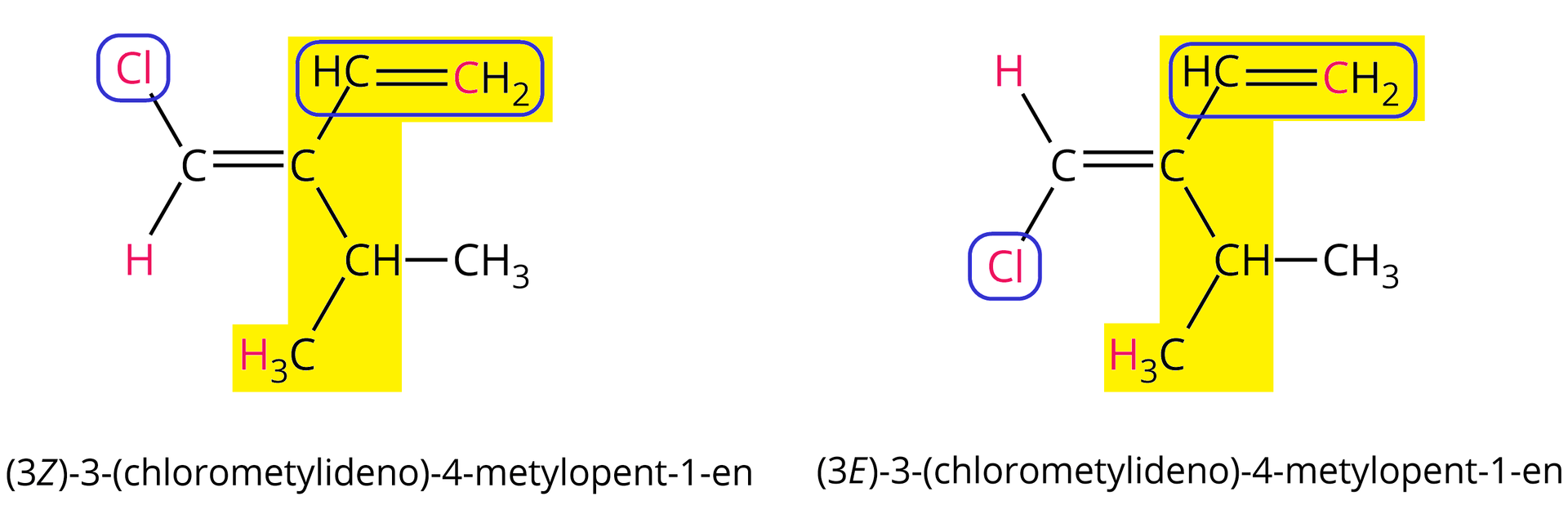
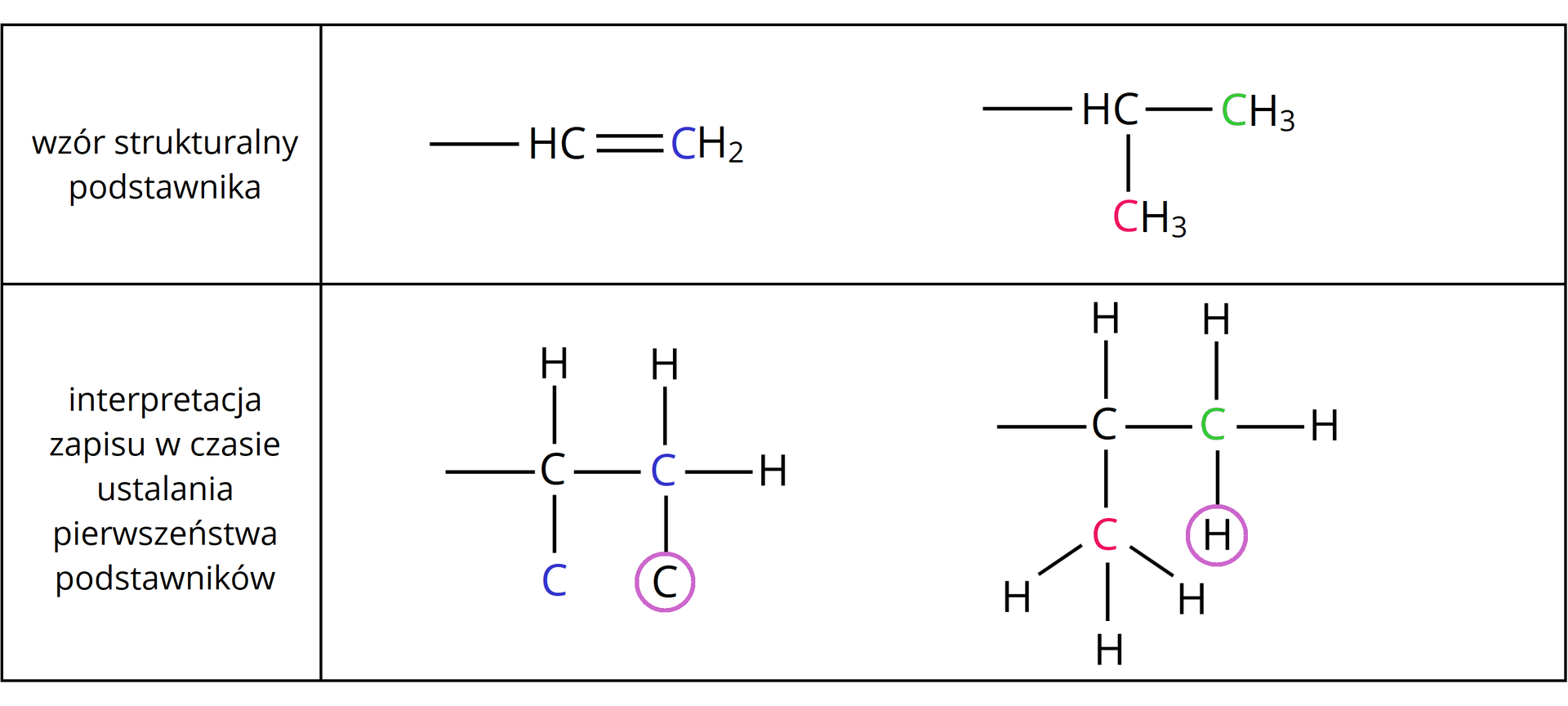
Aby ustalić nazwę alkenu występującego w postaci izomerów typu /, musimy określić tzw. „ważność” podstawników przy każdym atomie węgla biorącym udział w tworzeniu wiązania podwójnego.
W przypadku gdy podstawniki „ważniejsze” znajdują się po tej samej stronie płaszczyzny wiązania podwójnego, mamy do czynienia z izomerem typu Z (niem. zusammen = razem). Jeśli podstawniki „ważniejsze” znajdują się po przeciwnych stronach płaszczyzny wiązania podwójnego, rozpatrujemy izomer typu (niem. entgegen = osobno).
Do ustalenia wspomnianej „ważności” podstawników wykorzystujemy tzw. reguły pierwszeństwareguły pierwszeństwa, zwane regułami Cahna–Ingolda–Preloga.
Reguły pierwszeństwa podstawników
Atom o większej liczbie atomowej jest ważniejszy niż atom o mniejszej liczbie atomowej, np. .
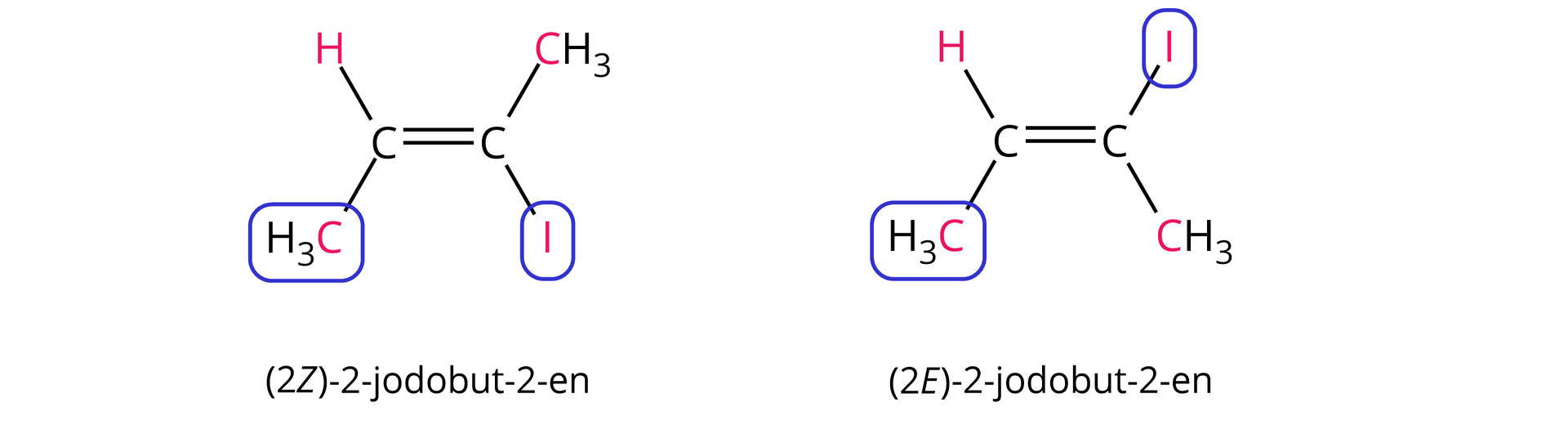
Zwróć uwagę, że podając nazwę odpowiedniego izomeru typu /, przed nazwą związku umieszczamy zapisany w nawiasie deskryptor stereochemiczny ( lub ) z odpowiadającym mu lokantem (numerem atomu węgla, którego deskryptor ten dotyczy).
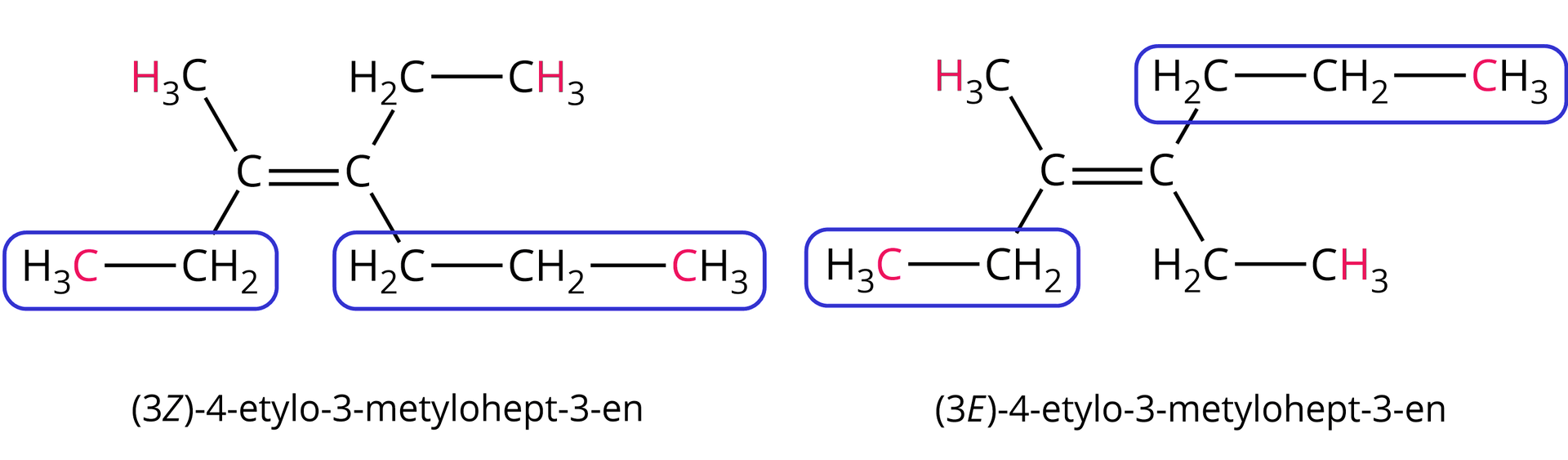
2. W przypadku gdy atomy bezpośrednio przyłączone do atomów węgla połączonych wiązaniem podwójnym nie różnią się liczbą atomową, należy porównać liczby atomowe kolejnych atomów (aż do rozstrzygnięcia).
3. W przypadku gdy atomy podstawnika połączone są wiązaniem wielokrotnym, należy rozpisać je na odpowiednią liczbę wiązań pojedynczych.
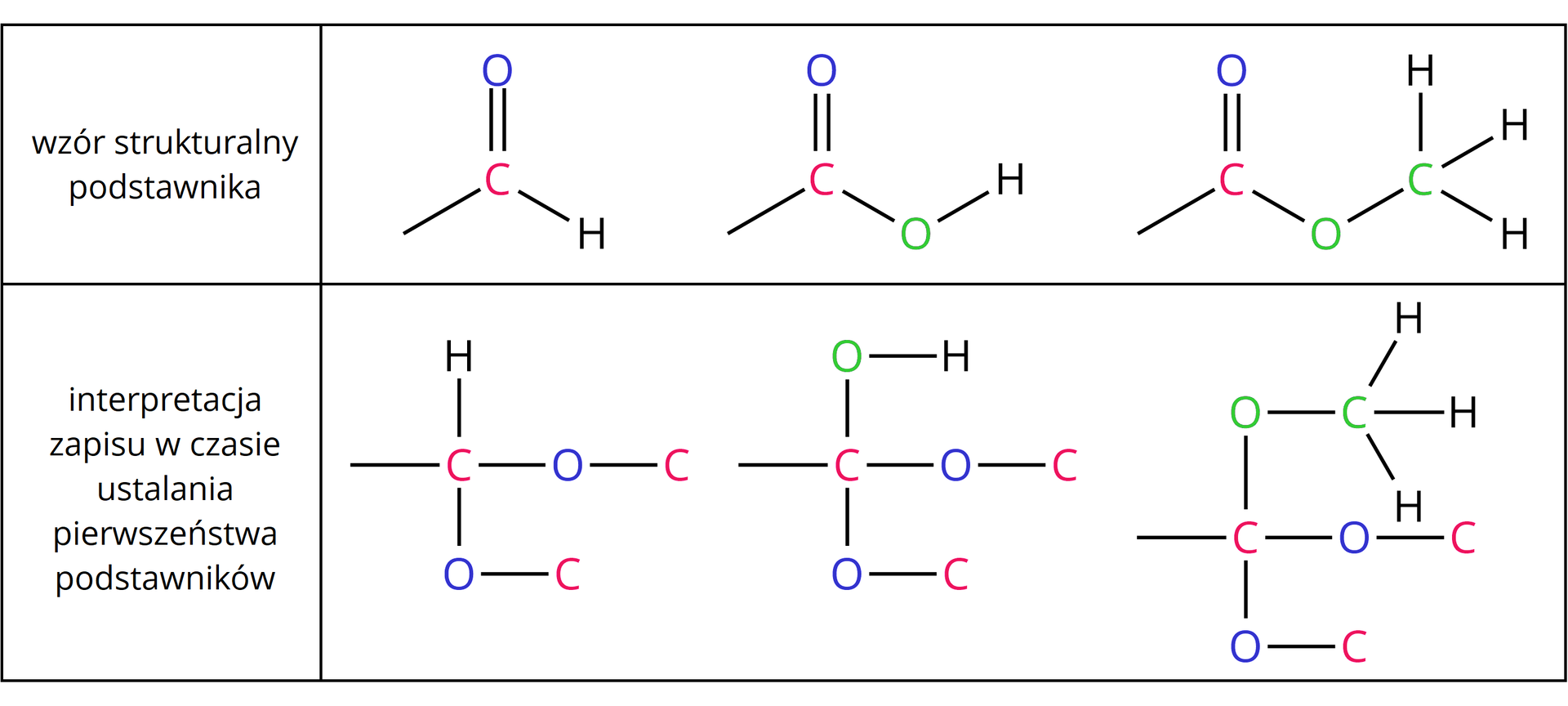
Stosując reguły pierwszeństwa podstawników, należy rozpisać atomy w rozpatrywanych powyżej wzorach podstawników w następujący sposób:
Pamiętaj, że formalnie każdy izomer typu cis jest jest jednocześnie izomerem typu , a każdy izomer typu trans – izomerem typu . Relacja ta nie jest jednak spełniona w drugą stronę – nie każdy izomer typu jest jednocześnie izomerem typu cis i nie każdy izomer typu jest izomerem typu trans.
Podsumowanie
Izomeria typu / jest przykładem stereoizomerii – izomery różnią się rozmieszczeniem atomów (lub grup atomów) w przestrzeni.
Warunkiem występowania izomerii typu / w alkenach jest obecność w ich cząsteczkach, przy atomach węgla połączonych wiązaniem podwójnym, podstawników parami nieidentycznych:
W celu ustalenia nazwy alkenu występującego w postaci izomerów typu /, należy określić tzw. „ważność” podstawników przy każdym atomie węgla biorącym udział w tworzeniu wiązania podwójnego, stosując do tego celu reguły pierwszeństwa (Cahna–Ingolda–Preloga).
W przypadku gdy podstawniki „ważniejsze” znajdują się po tej samej stronie płaszczyzny wiązania podwójnego, mamy do czynienia z izomerem typu , a gdy znajdują się po przeciwnych stronach płaszczyzny wiązania podwójnego – z izomerem typu .
Szczególnym przypadkiem izomerii typu / jest izomeria typu cis–trans. W alkenach, izomerię typu cis‑trans należy rozpatrywać tylko w przypadku alkenów dwupodstawionych, w cząsteczkach których do każdego z atomów węgla, połączonych wiązaniem podwójnym, dołączony jest jeden atom wodoru i jeden podstawnik identyczny dla obydwu wspomnianych atomów węgla.
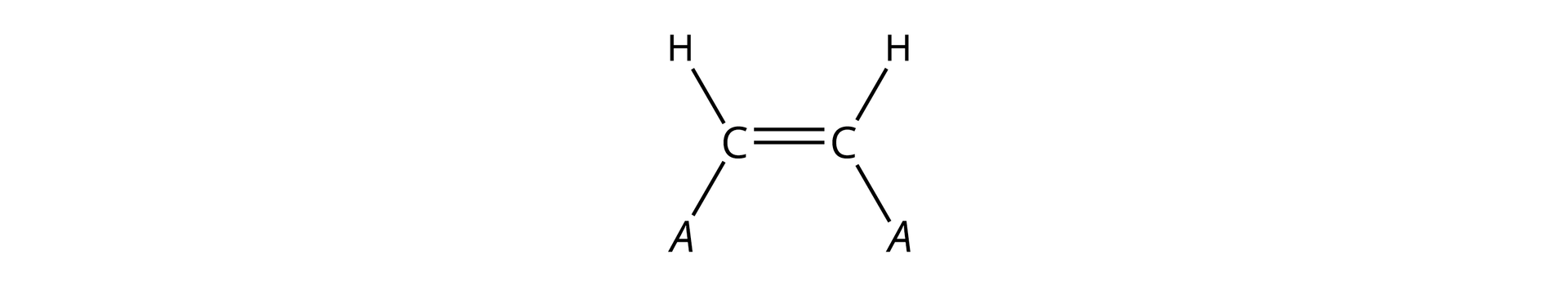
W cząsteczkach izomerów cis identyczne podstawniki są po tej samej stronie płaszczyzny wiązania, a w cząsteczkach izomerów trans – po przeciwnych stronach.
Słownik
węglowodór zawierający w cząsteczce jedno podwójne wiązanie węgiel‑węgiel; ogólny wzór sumaryczny szeregu homologicznego alkenów ma postać
izomeria związana z różnym przestrzennym rozmieszczeniem atomów (lub grup atomów) w cząsteczkach związków chemicznych o tej samej konstytucji, a więc sposobie i kolejności powiązania atomów
specyficzny przypadek izomerii typu /; z izomerami typu cis-trans, w przypadku alkenów, mamy do czynienia wówczas, gdy przy każdym z atomów węgla, połączonych wiązaniem podwójnym, znajduje się jeden atom wodoru i podstawnik identyczny dla obydwu atomów węgla; w cząsteczkach izomerów cis identyczne podstawniki znajdują się po tej samej stronie płaszczyzny wiązania podwójnego, a w cząsteczkach izomerów trans – po przeciwnych stronach; izomery typu cis-trans mogą tworzyć również odpowiednie cykloalkany, w których jako płaszczyznę odniesienia stosuje się płaszczyznę pierścienia
rodzaj diastereoizomerii obserwowanej w alkenach, w których cząsteczkach, przy atomach węgla połączonych wiązaniem podwójnym, znajdują się podstawniki parami nieidentyczne; ustalenie nazwy izomeru typu / wymaga uprzedniego ustalenia pierwszeństwa podstawników według reguł Cahna, Ingolda i Preloga, a następnie określenia, czy ważniejsze podstawniki znajdują się po tej samej stronie płaszczyzny wiązania podwójnego („zusammen” – wówczas jest to izomer ), czy po przeciwnych stronach („entgegen” – wówczas jest to izomer )
zwane regułami Cahna, Ingolda i Preloga, używane w stereochemii, pozwalają na określenie pierwszeństwa („ważności”) podstawników i ustalenie nazwy izomeru:
atom o większej liczbie atomowej jest ważniejszy niż atom o mniejszej liczbie atomowej, np. ;
jeżeli atomy bezpośrednio przyłączone do atomów węgla, połączonych wiązaniem podwójnym, nie różnią się liczbą atomową, należy porównać liczby atomowe kolejnych atomów (aż do rozstrzygnięcia);
każde wiązanie wielokrotne należy rozpisać na odpowiednią ilość wiązań pojedynczych
Bibliografia
Encyklopedia PWN
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.