Przeczytaj
Glin – informacje ogólne
Glin jest pierwiastkiem chemicznym należącym do grupy borowców. Nazwy „glin” używa się w odniesieniu do pierwiastka chemicznego i jego związków, natomiast nazwy „aluminium” używa się zwyczajowo, gdy mówi się o metalu użytkowym.
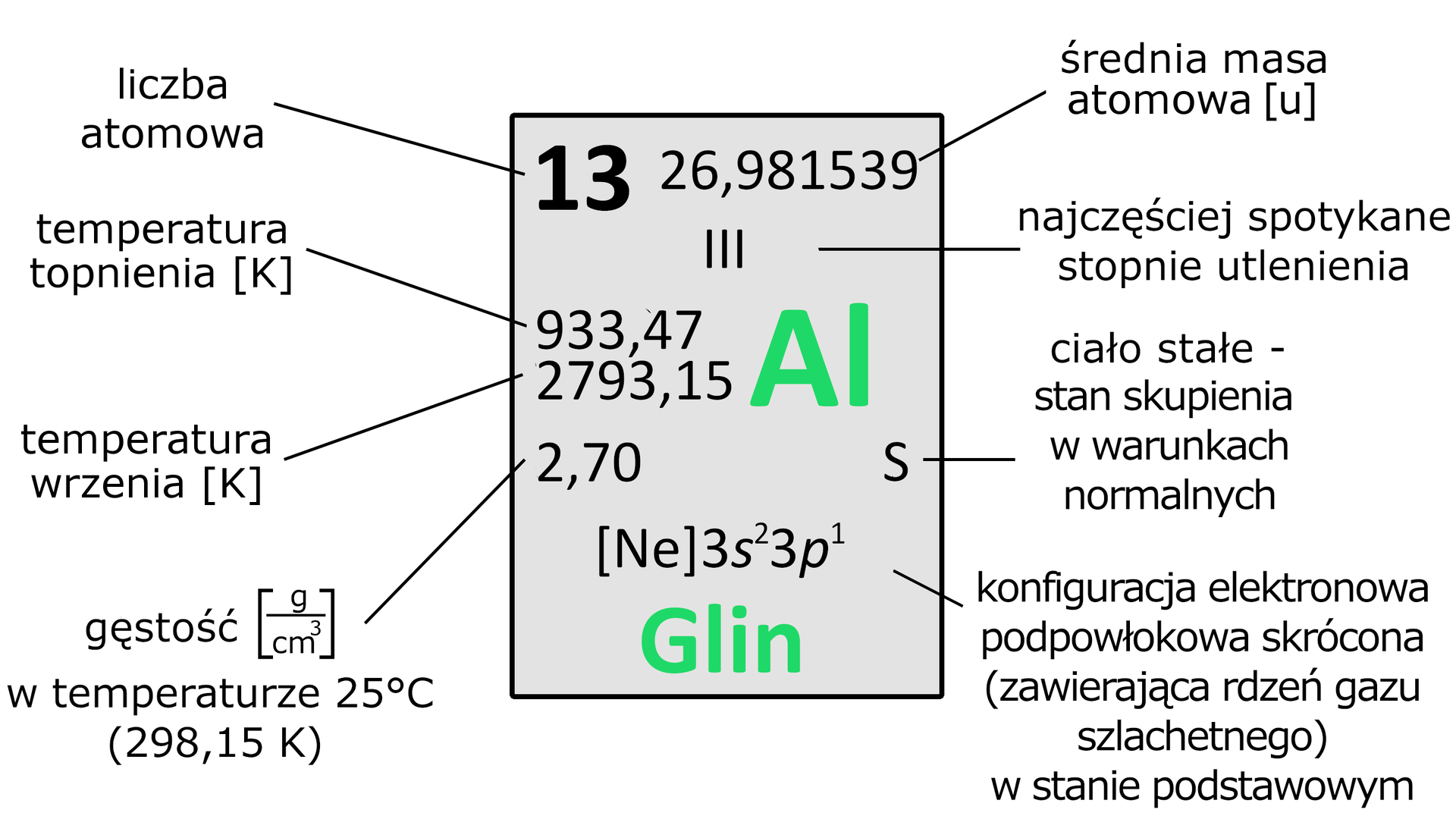
Atom glinu w stanie podstawowym posiada trzy elektrony walencyjne. Konfiguracja elektronowa atomu glinu w stanie podstawowym w zapisie pełnym podpowłokowym wygląda następująco:
Jedynym stabilnym izotopem glinu jest .

Glin – aktywność chemiczna
Glin jest pierwiastkiem o dużej elektroujemności ( wg skali Paulinga) i aktywności chemicznej. W normalnych warunkach, dzięki zjawisku pasywacjipasywacji, odznacza się niezwykle wysoką trwałością. W obecności tlenu tworzy na swojej powierzchni warstwę tlenku, chroniącą metal przed dalszym utlenieniem.
W przypadku starannego oczyszczenia powierzchni glinu z warstwy pasywnej i szybkiego wprowadzenia glinu do roztworu zawierającego jony rtęci (np. do wodnego roztworu chlorku rtęci), można zaobserwować wydzielanie się bezbarwnego gazu, pokrywanie się powierzchni glinu białym, puszystym nalotem oraz wydzielanie się “kuleczek” cieczy o metalicznym połysku. Glin, jako metal bardziej aktywny chemicznie, wypiera bowiem rtęć z roztworu jej soli:
Powstająca przy powierzchni glinu rtęć, tworzy z glinem stop – tzw. amalgamatamalgamat. Utworzona na powierzchni metalu warstewka stopu, utrudnia z kolei przyleganie pasywnej warstwy tlenku glinu do powierzchni tego metalu. W takim układzie, glin pokryty amalgamatem, reaguje z wodą, z wydzieleniem wodoru:
Spalanie glinu w tlenie
Glin ogrzany do wysokiej temperatury spala się, tworząc tlenek glinu:
Aluminoterapia
Glin należy do silnych reduktorów. W wysokich temperaturach wydziela metale z ich tlenków. Proces ten nosi nazwę aluminotermii:
AluminotermiaAluminotermia jest ważną metodą przemysłową, pozwalającą na otrzymywanie metali. W procesie tym mieszanina glinu i tlenku danego metalu, zwana mieszaniną termitową, jest ogrzewana do bardzo wysokiej temperatury, w której następuje redukcja metalu i utlenienie glinu. Wtedy właśnie powstaje odpowiedni metal i tlenek glinu.
Reakcje glinu z wybranymi kwasami słabo utleniającymi, w temperaturze pokojowej
Warstewka ochronna tlenku glinu może zostać zniszczona w roztworach niektórych mocnych kwasów. Do kwasów tych należą m.in. kwas chlorowodorowy (solny) – zarówno rozcieńczony jak i stężony oraz rozcieńczony kwas siarkowy.
Glin reaguje z tymi kwasami z wydzieleniem wodoru, przy czym reakcja z rozcieńczonym kwasem siarkowym przebiega bardzo wolno w odróżnieniu od reakcji z kwasem chlorowodorowym. Przebieg opisanych reakcji można zilustrować za pomocą równań:
Zapis jonowy skrócony powyższych równań reakcji jest taki sam i ma postać:
Reakcje glinu z kwasami utleniającymi, w temperaturze pokojowej
Po włożeniu blaszki wykonanej z glinu, do stężonego kwasu azotowego nie zaobserwuje się zmian. Podobna sytuacja będzie miała miejsce po wprowadzeniu blaszki glinowej do rozcieńczonego kwasu azotowego lub do stężonego kwasu siarkowego. Obserwacje te wynikają z faktu, iż glin w temperaturze pokojowej, ulega w obecności kwasów utleniających opisanej już wyżej pasywacji.
Fakt pasywacji glinu w kontakcie z kwasami utleniającymi (w temperaturze pokojowej) można potwierdzić poprzez dokładne oczyszczenie blaszki glinowej, np. przez wytrawienie jej powierzchni przy pomocy kwasu chlorowodorowego, a następnie szybkie umieszczenie oczyszczonej blaszki w danym kwasie utleniającym. Objawy reakcji będą wówczas praktycznie niezauważalne. Nie oznacza to jednak, że nie zachodzi wówczas żadna reakcja chemiczna.
Dla przykładu, jeśli zanurzymy dokładnie oczyszczoną blaszkę glinową w stężonym kwasie azotowym, to zajdzie proces pasywacji, który trwa ułamki sekundy. W czasie tego procesu zachodzi reakcja chemiczna, którą można opisać równaniem:
Reakcje glinu z kwasami utleniającymi, w podwyższonej temperaturze
Okazuje się, że glin może reagować z analizowanymi powyżej kwasami utleniającymi, przy czym z zauważalną szybkością reakcje te przebiegają dopiero w temperaturze powyżej 100°C. Aby przeanalizować równania tych reakcji kliknij interesujący Cię kafelek.
Duże znaczenie dla szybkości reakcji glinu z kwasami utleniającymi ma sama powierzchnia tego metalu. Jeśli jest ona gładka, wtedy powstająca w wyniku pasywacji powłoka jest bardziej szczelna i w temperaturze pokojowej reakcje roztwarzania glinu w kwasach utleniających praktycznie nie zachodzą.
Na podstawie przeprowadzonych badań stwierdzono, że w ciągu roku grubość blachy wykonanej z glinu, po zanurzeniu w stężonym kwasie azotowym zmniejsza się zaledwie o około , a po zanurzeniu w rozcieńczonym kwasie azotowym – niecałe .
Z kolei gdy powierzchnia glinu będzie chropowata, szczelność powstającej powłoki pasywacyjnej jest znacznie mniejsza i reakcje roztwarzania mogą zachodzić szybciej. Wówczas objawy tych reakcji (przebiegających zgodnie z równaniami prezentowanymi powyżej dla reakcji w podwyższonej temperaturze) są zauważalne po kilku minutach, nawet w temperaturze pokojowej.
Reakcje glinu ze stężonym roztworem wodorotlenku sodu
Warstewka ochronna tlenku glinu może zostać zniszczona również w roztworach mocnych zasad. Dla przykładu, glin reaguje ze stężonym roztworem wodorotlenku sodu tworząc m.in. wodór:
W nadmiarze stężonego roztworu wodorotlenku sodu reakcja przebiega zgodnie z równaniem:
Słownik
(łac. passivus „bierny”) pasywowanie; proces chem. lub elektrochem., powodujący zwiększenie odporności korozyjnej metalu, w wyniku wytworzenia na jego powierzchni bardzo cienkiej, szczelnej i dobrze związanej z podłożem warstewki tlenków lub soli
proces metalurgiczny, polega na redukcji tlenków metali sproszkowanym aluminium; podczas procesu, w wyniku utleniania aluminium, wydzielają się znaczne ilości ciepła, co powoduje wzrost temperatury (do ); aluminotermia jest stosowana do otrzymywania m.in. chromu, wanadu, manganu
(arab. al‑malgām „zlepek, mieszanina”) ortęć, stop określonego metalu z rtęcią
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Tom 2, Wydawnictwo Naukowe PWN, Warszawa 2007
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko‑Biała 2010.
Vargel C., Corrosion of Aluminium, Elsevier, 2020.